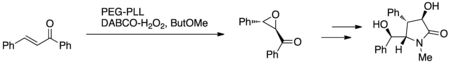Epoksydacja Julii – Colonny
Epoksydacja Juliá-Colonna to asymetryczna epoksydacja nukleofilowa katalizowana polileucyną olefin z niedoborem elektronów w układzie trójfazowym . Reakcja została opisana przez Sebastiana Juliá w Instytucie Chemicznym Sarriá w 1980 r., z dalszym opracowaniem zarówno Julii, jak i Stefano Colonna (Istituto di Chimica Industriale dell'Università, Mediolan, Włochy).
W pierwotnym protokole trójfazowym substrat chalkonowy jest rozpuszczalny w fazie organicznej, zwykle toluenie lub tetrachlorku węgla . Zasadowy utleniacz nadtlenku wodoru jest rozpuszczalny głównie w fazie wodnej, a reakcja zachodzi na nierozpuszczalnej warstwie polimeru na granicy faz dwóch faz. Opracowano alternatywne protokoły dwufazowe i jednofazowe ze zwiększoną dostępnością substratu i szybkością reakcji.
Wydajna enancjoselektywna katalityczna epoksydacja w łagodnych warunkach ma wielką użyteczność syntetyczną. Epoksydy są nie tylko skutecznymi syntonami dla szeregu przekształceń, ale mają znaczącą obecność w strukturach produktów naturalnych. Co więcej, reakcja została skutecznie powiększona do poziomów użytecznych w przemyśle, a prace prowadzone były w szczególności przez firmy Bayer i Evonik . Wreszcie, podobna do enzymu aktywność segmentów poliaminokwasowych sugeruje rolę tej reakcji w prebiotycznym pochodzeniu życia .
Mechanizm reakcji
Epoksydacja Juliá – Colonna to asymetryczna epoksydacja nukleofilowa olefin z niedoborem elektronów, takich jak α, β-nienasycone ketony . Ogólny mechanizm pokazany na rycinie 2 dotyczy wszystkich epoksydacji nukleofilowych, ale w tej reakcji jest kontrolowany przez katalizator polileucynowy.
Anion wodoronadtlenkowy i chalkon łączą się w kompleks z katalizatorem polileucynowym przed reakcją z wytworzeniem pośredniego nadtlenku enolanu. Produkt pośredni następnie zamyka się, zgodnie z kontrolą struktury katalizatora, tworząc produkt epoksydowy stereoselektywnie.
Formacja kompleksu trójskładnikowego
Nici polileucynowe wykazują kinetykę podobną do enzymu z zależnością pierwszego rzędu i ewentualnym nasyceniem zarówno anionem wodoronadtlenkowym (K M = 30 mM), jak i substratem olefinowym (K M = 110 mM). Badanie kinetyczne sugeruje, że reakcja przebiega przez losowe tworzenie w stanie ustalonym trójskładnikowego kompleksu (polileucyna + anion wodoronadtlenkowy + olefina) . Oba substraty muszą się związać przed reakcją i chociaż każdy z nich może się związać jako pierwszy, kinetycznie korzystne jest wstępne wiązanie wodoronadtlenku. Po szybkiej równowadze umożliwiającej tworzenie kompleksów następuje ograniczające szybkość tworzenie się nadtlenku enolan (ryc. 3).
Mechanistyczne pochodzenie stereoselektywności
Wszystkie reagenty łączą się z katalizatorem polileucynowym przed reakcją, tworząc półprodukt w postaci wodoronadtlenku enolanu. Katalizator orientuje reagenty i, co ważniejsze, enolan nadtlenku będącego produktem pośrednim poprzez serię wiązań wodorowych z czterema N-końcowymi grupami aminowymi w α-helisie poli-leucyny . Chociaż zaproponowano inne modele, obliczenia Kelly i in. zasugerowali, że NH-2, NH-3 i NH-4 tworzą trójkąt równoramienny dostępny dla wiązań wodorowych jako pośrednio stabilizujący otwór oksyanionowy . Podczas gdy olefina wiąże się z endo lub egzostrona helisy jest dozwolona sterycznie, tylko wiązanie endo orientuje grupę NH-4 do wiązania się z ugrupowaniem wodoronadtlenku, umożliwiając wypieranie wodorotlenku w końcowym etapie reakcji (Rysunek 4).
Katalizator
Selekcja poliaminokwasów
Enancjoselektywność jest maksymalizowana przez sekwencje poliaminokwasowe zawierające największą zawartość α-helisy; należą do nich polileucyna i polialanina . Zarówno poli-L-, jak i poli-D-aminokwasy są dostępne i powodują przeciwną stereoindukcję.
Generacja katalizatorów

Oryginalne katalizatory polileucynowe powstały w reakcji bezwodników leucyno-N-karboksylowych z inicjatorem, takim jak amina, alkohol lub woda (ryc. 5). W układach trójfazowych katalizator polimerowy musi być zanurzony w rozpuszczalniku organicznym i roztworze nadtlenku, aby wytworzyć żel przed reakcją. – Zwłaszcza w układach dwufazowych czas reakcji można skrócić, a enancjoselektywność zwiększyć, aktywując katalizator NaOH przed reakcją. Ponadto w układach dwufazowych polimer może być immobilizowany na polistyrenie , glikolu polietylenowym (PEG) lub krzemionce żel i uformować w pastę.
Struktura drugorzędowa katalizatora
Aktywny składnik katalizatora przyjmuje strukturę α-helikalną , w której cztery do pięciu reszt N-końcowych aktywnie uczestniczy w katalizie. Chociaż aktywne katalizatory zostały wygenerowane ze skalemicznej leucyny, spójna enancjomerów musi być utrzymana w regionie N-końcowym, aby nadać strukturze odpowiednią zgodność. Podczas gdy największą enancjoselektywność pierwotnie obserwowano, gdy n=30 reszt, 10-merowy polipeptyd leucyny ma długość wystarczającą do zapewnienia znaczącej enancjoselektywności. liczba N-końców dostępnych na zastosowaną masę.
Zakres
Epoksydacja Juliá-Colonna olefin z niedoborem elektronów została pierwotnie zademonstrowana za pomocą chalkonów, ale wkrótce została rozszerzona na inne układy z ugrupowaniami odciągającymi elektrony, takimi jak α, β-nienasycone ketony, estry i amidy. Reakcja wykazała również skuteczność z sulfonowymi , a zakres reakcji jest rozszerzany o dalsze badania metodologiczne.
Jednak kilka klas podłoży nie nadaje się do epoksydacji Juliá – Colonna. Obejmują one:
- związki wrażliwe na wodorotlenek.
- związki z kwasowymi protonami w pozycjach α lub α'.
- olefiny bogate w elektrony.
Epoksydacja nukleofilowa jest naturalnie komplementarna w zakresie epoksydacji elektrofilowych, takich jak epoksydacja Sharplessa i epoksydacja Jacobsena .
Stereoselektywność
Struktura katalizatora
Stereoindukcja epoksydacji Juliá – Colonna zależy od α-helikalnej struktury drugorzędowej katalizatora polileucynowego. Podczas gdy do tej indukcji niezbędna jest spójna stereochemia N-końcowych aminokwasów, nawet 10-merowy polipeptyd leucynowy ma wystarczającą długość, aby zapewnić znaczną enancjoselektywność.
Amplifikacja chiralna za pomocą katalizatorów skalemicznych
Ta zależność wyłącznie od N-końcowego regionu helisy jest najbardziej wyraźna w enancjoselektywnej stereoindukcji przez katalizatory skalemiczne. Nawet 40% enancjomeryczny nadmiar L w stosunku do D-leucyny podczas tworzenia katalizatora może dać ten sam epoksyd wzbogacony w enancjomer, co enancjomerycznie czysty katalizator. Związek między czystością enancjomeryczną katalizatora i produktu można w przybliżeniu przybliżyć za pomocą modelu statystycznego Bernoulla : ee n = (L n -D n )/(L n + D n ) gdzie L i D to proporcje L- i D-leucyny użytej do wytworzenia polimerów katalitycznych, a n to długość składnika katalitycznego.
Chiralne aminokwasy, w tym leucyna, zostały wygenerowane w eksperymentach z wyładowaniami elektrycznymi zaprojektowanymi w celu naśladowania warunków prebiotycznych na Ziemi i zostały znalezione w mieszaninach skalemicznych w meteorytach. Sugerowano, że fragmenty poliaminokwasów analogiczne do katalizatora Juliá-Colonna mogły być inicjowane przez imidazolu lub cyjanku , a powstałe fragmenty mogły odgrywać rolę katalityczną w powstawaniu wzbogacenia enancjomerycznego wszechobecnego w dzisiejszym życiu.
Wariacje
Katalizatory szczepione krzemionką
Wykazano, że polileucyna szczepiona krzemionką skutecznie katalizuje epoksydację α, β-nienasyconych ketonów aromatycznych. Szczepiona krzemionka umożliwia łatwe odzyskanie katalizatora przy jedynie niewielkiej utracie aktywności i jest szczególnie przydatna w reakcjach zwiększania skali.
Dwufazowe (niewodne) warunki reakcji
W alternatywnym protokole dwufazowym substrat olefinowy rozpuszcza się w tetrahydrofuranie (THF) wraz z utleniaczem nadtlenkiem wodoru mocznika ( UHP) i trzeciorzędową zasadą aminową, taką jak 8-diazabicyklo[5.4.0]undec-7-en (DBU). Immobilizowany katalizator polimerowy tworzy pastę, która służy jako miejsce reakcji. Dwufazowe warunki reakcji rozszerzyły zakres enonów, do których można było zastosować reakcję.
Jednofazowe warunki reakcji z polileucyną unieruchomioną na PEG
Rozpuszczalny inicjator O,O'-bis(2-aminoetylo)glikol polietylenowy (diaminoPEG) do składania polileucyny wykorzystano do wytworzenia rozpuszczalnego w THF trójblokowego polimeru . Wykorzystanie tego katalizatora w jednorodnych warunkach reakcji umożliwiło znaczne rozszerzenie metodyki na α,β-nienasycone ketony , dieny i bis -dieny.
Kokataliza przeniesienia fazowego
Dodatek bromku tetrabutyloamoniowego jako katalizatora przeniesienia fazowego radykalnie zwiększa szybkość reakcji. Zakłada się, że kokatalizator zwiększa stężenie utleniacza nadtlenkowego w fazie organicznej, umożliwiając bardziej efektywny dostęp do reaktywnego kompleksu trójskładnikowego. Warunki te zostały opracowane do zastosowania w systemach dwufazowych, ale działają również w systemach trójfazowych i zostały wykorzystane do skali 100g
Skalowanie
Unieruchomione katalizatory były stosowane w reaktorach membranowych i są badane pod kątem zastosowania w reaktorach ze złożem stałym o przepływie ciągłym.
Zastosowania do syntezy
Całkowita synteza diltiazemu
Adger i in. wykorzystali dwufazową epoksydację Juliá-Colonna z immobilizowaną poli-L-leucyną (I-PLL) i nadtlenkiem wodoru mocznika (UHP) oraz 8-diazabicyklo[5.4.0]undec-7-en (DBU) jako kluczowy etap w wydajna synteza diltiazemu (ryc. 6.) Diltiazem jest dostępnym w handlu farmaceutykiem, który działa jako bloker kanału wapniowego .
Całkowita synteza (+)-klausenamidu
Cappi i in. wykorzystali epoksydację Juliá-Colonna z unieruchomioną na PEG poli-L-leucyną (PEG-PLL) i nadtlenkiem wodoru DABCO (DABCO-H 2 O 2 ) lub nadtlenkiem wodoru mocznika (UHP) w miniaturowym układzie reaktora przepływowego ze stałym złożem ( Ryc. 7.) Protokół ten wykorzystano do syntezy (+)-klausenamidu jako dowód słuszności koncepcji w opracowaniu nowego protokołu reakcji; (+)-klausenamid wykazuje działanie przeciwamnezyjne i hepatoprotekcyjne.
Całkowita synteza (+)-goniotriolu 7, (+)-goniofufuronu 8, (+)-8-acetygoniotriolu 9 i gonio-pironu
Chen i in. wykorzystał protokół dwufazowej epoksydacji Juliá – Colonna z nadtlenkiem wodoru mocznika (UHP), poli-L-leucyną (PLL) i 8-diazabicyklo [5.4.0]undec-7-enem (DBU) jako kluczowym etapem syntezy rodzina laktonów styrylowych wyizolowanych z Goniothalamus giganteus (ryc. 8). Związki te, w tym (+)-goniotriol 7, (+)-goniofufuron 8, (+)-8-acetylogoniotriol 9 i gonio-piron, wykazały działanie cytotoksyczne wobec ludzkie komórki nowotworowe.
Zobacz też
- Reakcja Prilezhaeva
- Epoksydacja Jørgensena
- Asymetryczna epoksydacja nukleofilowa