Epoksydacja Shi
| Epoksydacja Shi | |
|---|---|
| Nazwany po | Yian Shi |
| Typ reakcji | Reakcja tworzenia pierścienia |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
Epoksydacja Shi jest reakcją chemiczną opisaną jako asymetryczne epoksydowanie alkenów za pomocą oksonu (peroksymonosiarczanu potasu) i katalizatora pochodzącego z fruktozy ( 1 ) . Uważa się, że ta reakcja przebiega przez dioksiran , generowany z ketonu katalizatora przez oxone (nadtlenomonosiarczan potasu). Dodanie grupy siarczanowej przez okson ułatwia tworzenie dioksiranu, działając jako dobra grupa opuszczająca podczas zamykania pierścienia. Wyróżnia się zastosowaniem katalizatora niemetalicznego i stanowi wczesny przykład organokataliza . Reakcja została po raz pierwszy odkryta przez Yian Shi (史一安, pinyin : Shǐ Yī-ān) z Colorado State University w 1996 roku.
Historia
Przed odkryciem przeprowadzono wiele prób syntezy wydajnego katalizatora niemetalicznego. Problemem z poprzednimi katalizatorami był szybki rozkład/utlenianie półproduktu dioksiranowego i brak elektrofilowości reaktywnego ketonu. Zaproponowano aromatyczne ketony i wiele kolejnych odmian soli oksoamoniowych były stosowane, ale były nieskuteczne w promowaniu epoksydacji z powodu niestabilności oksydacyjnej grup amidowych i dużej elastyczności siedmioczłonowych pierścieni. Enancjoselektywność tych wczesnych katalizatorów została również obniżona z powodu dużych odległości między asymetrycznymi podjednostkami a centrami reakcji, dając mniej niż 10 procent nadmiaru enancjomerycznego .
Katalizator odkryty przez grupę Yian Shi w 1996 roku pochodził z D-fruktozy i ma centrum stereogeniczne blisko centrum reakcji (ketonu) - sztywna sześcioczłonowa struktura pierścieniowa katalizatora i przylegająca do niego czwartorzędowa grupa pierścieniowa minimalizuje epimeryzację tego stereocentrum . Utlenianie przez aktywny katalizator dioksiranowy odbywa się z powierzchni si , z powodu zawady sterycznej przeciwnej powierzchni zwrotnej. Katalizator ten działa wydajnie jako katalizator asymetryczny dla niefunkcjonalizowanych trans-olefin.
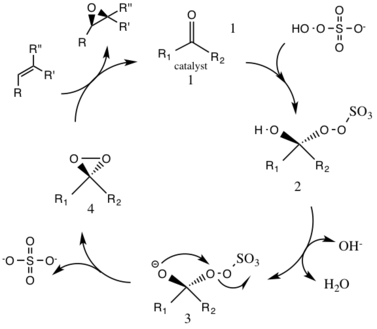
Tworzenie katalizatora dioksranowego
W normalnych warunkach pH ze względu na dużą szybkość rozkładu potrzebny jest nadmiar 3 stechiometrycznych ilości katalizatora ketonowego. W zasadowych warunkach pH większych niż 10 (pH 10,5) do epoksydacji potrzebne są substechiometryczne ilości (0,2–0,3), zmniejszające rozkład odczynników przez niekorzystne reakcje uboczne Baeyera-Villigera. Wyższe temperatury powodują dalszy rozkład; w związku z tym stosowana jest niska temperatura zero stopni Celsjusza.
Rozkład reagentów jest dwucząsteczkowy ( szybkość reakcji drugiego rzędu ), dlatego stosuje się niewielkie ilości oksonu i katalizatora.
W reakcji pośredniczy katalizator pochodzący od D-fruktozy, który wytwarza enancjomer (R,R) otrzymanego epoksydu. Rozpuszczalność organicznego substratu olefinowego i utleniacza (oksonu) jest różna, dlatego potrzebny jest ośrodek dwufazowy . Wytwarzanie aktywnych form katalizatora odbywa się w warstwie wodnej i jest przenoszone do warstwy organicznej z reagentami przez siarczan tetrabutyloamoniowy. Katalizator ketonowy jest stale regenerowany w cyklu katalitycznym, a zatem może katalizować epoksydację w małych ilościach.
Pierwszym etapem reakcji w cyklu katalitycznym jest reakcja addycji nukleofilowej oksonu z grupą ketonową na katalizatorze (półprodukt 1). To tworzy reaktywny gatunek pośredni numer 2, półprodukt Criegee które mogą potencjalnie prowadzić do niepożądanych reakcji ubocznych, takich jak reakcja Baeyera-Villigera (patrz poniżej). Generowanie form pośrednich numer 3 zachodzi w warunkach zasadowych, z usunięciem wodoru z grupy hydroksylowej w celu utworzenia nukleofilowego anionu tlenowego. Grupa siarczanowa ułatwia późniejsze tworzenie dioksiranu, gatunku pośredniego numer 4, działając jako dobra grupa opuszczająca podczas cyklizacji 3-egzo-tet . Aktywowane gatunki katalityczne dioksiranu następnie przenoszą atom tlenu do alkenu, co prowadzi do regeneracji pierwotnego katalizatora.
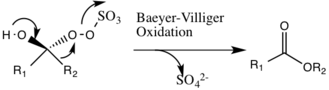
Reakcje uboczne
Potencjalną reakcją uboczną, która może wystąpić, jest reakcja Baeyera-Villigera związku pośredniego 2, w której następuje przegrupowanie grupy nadtlenowej , co prowadzi do powstania odpowiedniego estru. Zakres tej reakcji ubocznej zmniejsza się wraz ze wzrostem pH i zwiększa nukleofilowość oksonu, czyniąc podstawowe warunki korzystne dla ogólnej epoksydacji i reaktywności form katalitycznych.
Mechanizmy epoksydacji
Sn2 . wytworzonej na katalizatorze organicznym jest przenoszony do alkenu, co uważa się za mechanizm uzgodniony, chociaż może wystąpić obecność pośredniego anionu tlenu poprzez mechanizm
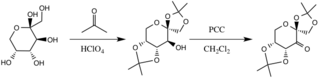
Przygotowanie pochodnej D-fruktozy
Katalizator powstaje w reakcji z acetonem w warunkach zasadowych, przy czym grupy hydroksylowe pierścienia fruktozy działają jak nukleofile, a ich nukleofilowość wzrasta w warunkach zasadowych tworzonych przez węglan potasu . Podstawniki odciągające elektrony (grupy alfa-eterowe) sprzyjają tworzeniu się ketonu z utleniacza chlorochromianu pirydyniowego poprzez zwiększenie elektrofilowości węgla karbonylowego poprzez stabilizującą delokalizację tworzących się wiązań π CC do wiązań σ * CO sąsiednich etery.
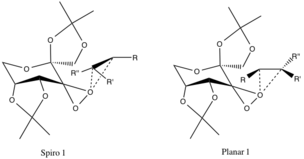
Stany przejściowe i selektywność enancjomeryczna
Istnieją dwa proponowane stany przejściowe, których geometrie są spekulowane i nie są potwierdzone przez dowody eksperymentalne, ale są przypisywane efektom stereoelektronicznym . Stan przejściowy spiro jest faworyzowany w stosunku do płaskiego ze względu na niewiążące orbitale wyższego tlenu przekazujące do antywiążących orbitali CC π * reagującego alkenu, zapewniając stabilizującą delokalizację elektronów.
Darowizna tych elektronów do tworzących się wiązań CO σ wiązań epoksydowych również sprzyja tworzeniu spiro-produktu (geometria produktu jest również wyrównana). Konfiguracja płaska jest niekorzystna ze względu na brak wiązań zwrotnych pi i zawadę steryczną grup alkilowych z dużymi alkilowymi grupami funkcyjnymi pierścienia katalitycznego.
Wspomniane wcześniej konfiguracje są preferowane w stosunku do stanów przejściowych przeciwnych enancjomerów z powodu niekorzystnych oddziaływań sterycznych między grupami R-alkilowymi (patrz poniżej) a eterowo-alkilowymi grupami funkcyjnymi pierścienia katalizatora.
Sukces enancjomeryczny tego epoksydowania jest stosunkowo wysoki w porównaniu z katalizatorami metalowymi i generalnie skutkuje wysokim nadmiarem enancjomerycznym przekraczającym 80 procent.
Wydajność reakcji i stereoselektywność
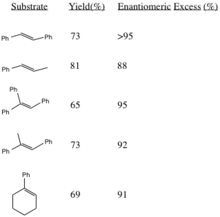
Ta procedura generuje epoksydy z dużymi nadmiarami enancjomerycznymi z trans-dipodstawionych alkenów i tripodstawionych alkenów. Cis-dipodstawione alkeny i styreny są asymetrycznie epoksydowane przy użyciu podobnego katalizatora. Generowanie epoksydów (R,R) z odpowiednich alkenów zwiększa stereoselektywność wraz ze wzrostem masy przestrzennej podstawników R (zwłaszcza w trans-olefinach).
Zobacz też
- ^ Wydajna katalityczna asymetryczna metoda epoksydacji Zhi-Xian Wang, Yong Tu, Michael Frohn, Jian-Rong Zhang i Yian Shi J. Am. chemia soc. 1997 , 119(46) , 11224-11235. ( doi : 10.1021/ja972272g )
- Bibliografia _ Shi, Y. Synthesis 2000 , 14 , 1979-2000 doi : 10.1055/s-2000-8715 . (Recenzja)
- Bibliografia _ Ona, X.; Shu, L.; Yu, H.; Shi, YJ Am. chemia soc. 2000 , 122 , 11551-11552. ( doi : 10.1021/ja003049d )
- Bibliografia _ Ona, X.; Xu, J.; Shi, Y. Org. Łotysz. 2001 , 3 , 1929-1931. ( doi : 10.1021/ol010066e )
- Epoksydacja Shi < https://www.organic-chemistry.org/namedreactions/shi-epoxidation.shtm >
- Dania, Wu i in. „Rozwój chiralnych, nieracemicznych dioksiranów do katalitycznej, enancjoselektywnej epoksydacji alkenów”. (13 kwietnia 1999) < https://www.thieme-connect.de/products/ejournals/pdf/10.1055/s-1999-3123.pdf >
- Frohn, Shi, Tu, Wang, Zhang i in. „Wydajna metoda asymetrycznej epoksydacji”. (8 lipca 1997) < http://pubs.acs.org/doi/pdf/10.1021/ja972272g >
- Shi, Wang i in. „Nowy typ katalizatora ketonowego do asymetrycznej epoksydacji”. (12 września 1997). < http://pubs.acs.org/doi/pdf/10.1021/jo971701q >