Kataliza utleniania wody
Kataliza utleniania wody (WOC) to przyspieszenie (kataliza) przemiany wody w tlen i protony:
- 2 H. 2 O → 4 H. + + 4 mi - + O 2
Skutecznych jest wiele katalizatorów, zarówno katalizatorów homogenicznych , jak i heterogenicznych . Najlepszym przykładem jest kompleks wydzielający tlen w procesie fotosyntezy. Wytwarzanie tlenu przez utlenianie wody nie ma sensu, ponieważ tlen można łatwo uzyskać z powietrza. Zamiast tego zainteresowanie utlenianiem wody jest motywowane jego znaczeniem dla rozszczepiania wody , co zapewniłoby „ wodór słoneczny”. ”, tj. utlenianie wody generowałoby elektrony i protony do produkcji wodoru. Idealny WOC działałby szybko przy niskim nadpotencjale, wykazywałby wysoką stabilność i byłby tani, pochodzący z nietoksycznych składników.
Zasady mechanistyczne i energetyczne
Woda jest trudniejsza do utlenienia niż jej sprzężony wodorotlenek zasadowy . Wodorotlenek jest stabilizowany przez koordynację z kationami metali. Niektóre wodorotlenki metali, zawierające centra metali o aktywności redoks, można utlenić, otrzymując metaliczne kompleksy okso . Atak wody na metaliczne centra okso stanowi jedną ze ścieżek tworzenia wiązania OO, prowadzącego do ditlenku. Alternatywnie, decydujący etap tworzenia wiązania OO może powstać przez połączenie odpowiednio rozmieszczonych par metalicznych centrów hydroksylowych. Mechanizm molekularny OEC nie został wyjaśniony.
Konwersja nawet hydroksykompleksów metali do O 2 wymaga bardzo silnych utleniaczy. W fotosyntezie takie utleniacze są dostarczane przez dziury elektronowe na kationach rodników porfirynowych. W przypadku zastosowań w urządzeniach zasysanym utleniaczem jest fotowoltaiczny . Do badań przesiewowych WOC azotan cerowo-amonowy jest typowym akceptorem elektronów.

Kataliza homogeniczna
kompleksy rutenu
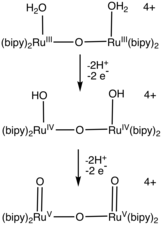
Szereg kompleksów ruten-woda katalizuje utlenianie wody. Większość katalizatorów zawiera ligandy bipirydynowe i terpirydynowe . Katalizatory zawierające pirydyno-2-karboksylan wykazują szybkości (300 s -1 ) porównywalne z fotoukładem II . Prace w tej dziedzinie zapoczątkowały wiele nowych ligandów polipirydylowych.
Kompleksy kobaltu i żelaza
Wczesne przykłady WOC na bazie kobaltu cierpiały na niestabilność. Jednorodny WOC [Co(Py 5 )(H 2 O)](ClO 4 ) 2 działa na zasadzie przenoszenia elektronów sprzężonych z protonami, tworząc formę [Co III –OH] 2+ , która po dalszym utlenieniu tworzy Co IV mediator. Utworzony związek pośredni reaguje z wodą uwalniając O2 . Kompleks kobaltu- polioksometalanu [Co 4 (H 2 O) 2 (α-PW 9 O 34 ) 2 ] 10− jest wysoce wydajnym WOC.
Niektóre kompleksy żelaza katalizują utlenianie wody. Rozpuszczalny w wodzie kompleks [Fe(OTf) 2 (Me 2 Pytacn)] (Pytacn = trimetylotriazacyklononan podstawiony pirydyną ; OTf = triflat ) jest wydajnym WOC. Stwierdzono, że stężenie katalizatora i utleniacza silnie wpływa na proces utleniania. Aktywnymi katalizatorami są liczne pokrewne kompleksy z nietrwałymi miejscami cis. Stwierdzono, że większość kompleksów ulega degradacji w ciągu kilku godzin. Wyższą stabilność katalizatora cząsteczkowego można osiągnąć stosując silne ligandy klatrochelatowe, które stabilizują wysokie stopnie utlenienia żelaza i zapobiegają szybkiej degradacji katalizatora. Oceniono liczbę i stereochemię reaktywnych miejsc koordynacyjnych na Fe, ale pojawiło się niewiele wytycznych.
kompleksy irydu
Kompleksy [Ir(ppy) 2 (OH2 ) 2 ] + ( ppy = 2-fenylopirydyna) wykazują wysokie obroty, ale niskie szybkości katalityczne. Zastąpienie ppy przez Cp* (C 5 Me 5 ) skutkuje zwiększeniem aktywności katalitycznej, ale zmniejszeniem liczby obrotów. Stwierdzono, że atak nukleofilowy wody na cząsteczki Ir=O był odpowiedzialny za O2 .
Kataliza heterogeniczna
Tlenek irydu jest stabilnym katalizatorem WOC w masie o niskim nadpotencjale.
Warstwa tlenku na bazie Ni uwalnia tlen w warunkach quasi-neutralnych przy nadpotencjale ~ 425 mV i wykazuje długotrwałą stabilność. Spektroskopia rentgenowska ujawniła obecność mostków di-µ-tlenkowych między jonami Ni III /Ni IV , ale nie znaleziono dowodów na mostkowanie mono-µ-tlenkowe między jonami. Podobne struktury można znaleźć w filmach Co-WOC i katalizatorach Mn-WOC.
Zbadano, że tlenki kobaltu (Co 3 O 4 ) działają na tym samym schemacie, co inne sole kobaltu. Fosforany kobaltu są również aktywnymi WOC przy neutralnym pH. Stabilne i wysoce aktywne WOC można wytworzyć przez adsorpcję Co II na nanocząstkach krzemionki.
Związki spinelu są również bardzo skuteczne w utlenianiu wody. Gdy nanowymiarowe spinele są powlekane hydrotermicznie materiałami węglowymi, po czym następuje dalsza redukcja, mogą wykazywać wysoką skuteczność elektrochemicznego rozdzielania wody.
Dodatkowe recenzje
- Meyer, TJ, Chemiczne podejście do sztucznej fotosyntezy. Relacje z Badań Chemicznych 1989, 22, 163–170.
- Balzani, V.; Credi, A.; Venturi, M., Fotochemiczna konwersja energii słonecznej. ChemSusChem 2008, 1, 26–58.
- Sala, X.; Romero, I.; Rodriguez, M.; Escriche, L.; Llobet, A., Molekularne katalizatory, które utleniają wodę do tlenu. Angewandte Chemie International Edition 2009, 48, 2842–2852.
- Gratzel, M., Komórki fotoelektrochemiczne. Natura 2001, 414, 338–344.
- Eisenberg R.; Gray, HB, Przedmowa na temat wytwarzania tlenu. Chemia nieorganiczna 2008, 47, 1697–1699.
- Słońce, L.; Hammarstrom, L.; Akermark, B.; Styring, S., W kierunku sztucznej fotosyntezy: chemia rutenu i manganu do produkcji energii. Recenzje Towarzystwa Chemicznego 2001, 30, 36–49.
- Podmuch, D.; Moore, TA; Moore, AL, Paliwa słoneczne poprzez sztuczną fotosyntezę. Rachunki badań chemicznych 2009, 42, 1890–1898.
- ^ Umena, Yasufumi; Kawakami, Keisuke; Shen, Jian-Ren; Kamiya, Nobuo (maj 2011). „Struktura krystaliczna fotosystemu II wydzielającego tlen w rozdzielczości 1,9 Å” (PDF) . Natura . 473 (7345): 55–60. Bibcode : 2011Natur.473...55U . doi : 10.1038/natura09913 . PMID 21499260 . S2CID 205224374 .
-
^ abc Liu , F
.; Poczęcie, JJ; Jurss, JW; Cardolaccia, T.; Templeton, JL; Meyer, TJ (2008). „Mechanizmy utleniania wody od niebieskiego dimeru do fotosystemu II”. Chemia nieorganiczna . 47 (6): 1727–1752. doi : 10.1021/ic701249s . PMID 18330966 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Tsuge, K.; Tanaka, K. (2000). „Elektrochemiczne utlenianie wody do tlenu katalizowane przez utlenioną postać kompleksu bis (ruten - hydroksy) w H 2 O”. Angewandte Chemie wydanie międzynarodowe . 39 (8): 1479-1482. doi : 10.1002/(SICI)1521-3773(20000417)39:8<1479::AID-ANIE1479>3.0.CO;2-4 . PMID 10777648 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
Bibliografia
_ Romero, I.; Rodriguez, M.; Llobet, A.; Parella, T.; Benet-Buchholz, J. (2004). „Nowy kompleks Ru zdolny do katalitycznego utleniania wody do cząsteczkowego tlenu”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 126 (25): 7798–7799. doi : 10.1021/ja0486824 . PMID 15212526 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
Bibliografia
_ Fischer, A.; Xu, Y.; Słońce, L. (2009). „Izolowany kompleks dimeru Ru (IV) o siedmiu współrzędnych z [HOHOH] - Ligand mostkujący jako związek pośredni do katalitycznego utleniania wody”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 131 (30): 10397–10399. doi : 10.1021/ja9034686 . PMID 19601625 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
Bibliografia
_ Bozoglian, F.; Mandal, S.; Stewart, B.; Priwałow, T.; Llobet, A.; Słońce, L. (2012). „Molekularny katalizator rutenowy o aktywności utleniania wody porównywalnej z fotosystemem II”. Nat. chemia . 4 (5): 418–423. Bibcode : 2012NatCh...4..418D . doi : 10.1038/nchem.1301 . PMID 22522263 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Thummel, RP (2005). „Nowa rodzina kompleksów Ru do utleniania wody”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 127 (37): 12802–12803. doi : 10.1021/ja054791m . PMID 16159265 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) -
Bibliografia
_ Zong, R.; Tseng, H.-W.; Thummel, RP (2008). „Kompleksy Ru (II) czterokleszczowych ligandów związanych z 2,9-di (piryd-2'-ylo) -1,10-fenantroliną”. Chemia nieorganiczna . 47 (3): 990–998. doi : 10.1021/ic701798v . PMID 18183971 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) . - ^ Brunszwik, BS; Chou, MH; Creutz, C.; Ghosh, P.; Sutin, N., Mechanizmy utleniania wody do tlenu: kobalt(IV) jako związek pośredni w reakcji katalizowanej akwokobaltem(II). Journal of American Chemical Society 1983, 105, 4832-4833.
- ^ Wasylenko, DJ; Ganesamoorthy, C.; Borau-Garcia, J.; Berlinguette, CP, Elektrochemiczne dowody na katalityczne utlenianie wody, w którym pośredniczy wysokowartościowy kompleks kobaltu. Komunikacja chemiczna 2011, 47, 4249-4251.
- ^ Yin, Q .; Tan, JM; Besson, C.; Geletii, YV; Musajew, DG; Kuzniecow, AE; Luo, Z.; Hardcastle, KI; Hill, CL, Szybko rozpuszczalny, bezwęglowy katalizator utleniania wody cząsteczkowej, oparty na obfitych metalach. Nauka 2010, 328, 342-345.
- ^ Fritsky, Igor O.; Berggren, Gustaw; SA, Jacinto; Mamedov, Fikret; D'Amario, Luca; Pawliuk, Maria V.; Shylin, Sergii I. (2019-02-18). „Wydajne utlenianie wody pod wpływem światła widzialnego, katalizowane przez kompleks klatrochelatowy żelaza (IV)” . Komunikacja chemiczna . 55 (23): 3335–3338. doi : 10.1039/C9CC00229D . ISSN 1364-548X . PMID 30801592 .
- Bibliografia _ Codola, Z.; Garcia-Bosch, I.; Gomez, L.; Pla, JJ; Costas, M., Wydajne katalizatory utleniania wody na bazie łatwo dostępnych kompleksów koordynacyjnych żelaza. Nat Chem 2011, 3, 807-813.
-
^
Kadłub, JF; Balcells, D.; Blakemore, JD; Incarvito, CD; Eisenstein, O.; Brudvig, GW; Crabtree, RH (2009). „Wysoce aktywne i wytrzymałe kompleksy Cp * irydu do katalitycznego utleniania wody” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 131 (25): 8730–8731. doi : 10.1021/ja901270f . PMC 2742501 . PMID 19496565 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Schley, Dakota Północna; Balcells, D.; Kadłub, JF; Olack, GW; Incarvito, CD; Eisenstein, O.; Brudvig, GW; Crabtree, RH (2010). „Half-sandwich kompleksy irydu do jednorodnej katalizy utleniania wody”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 132 (45): 16017–16029. doi : 10.1021/ja104775j . PMID 20964386 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
^
Youngblood, WJ; Lee, S.-HA; Maeda, K.; Mallouk, TE (2009). „Rozszczepianie wody w świetle widzialnym za pomocą półprzewodników tlenkowych uczulonych barwnikiem”. Rachunki badań chemicznych . 42 (12): 1966–1973. doi : 10.1021/ar9002398 . PMID 19905000 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ Dincă, M .; Surendranath, Y.; Nocera, DG, niklowo-boranowy katalizator wydzielający tlen, który działa w łagodnych warunkach. Proceedings of the National Academy of Sciences 2010, 107, 10337-10341.
- Bibliografia _ Klingan, K.; Heidkamp J.; Ehrenberg, D.; Czernew, P.; Zaharieva, I.; Dau, H., Struktura niklowo-tlenkowa filmu katalizatora utleniającego wodę. Komunikacja chemiczna 2011, 47, 11912-11914.
- ^ Zahariewa, I.; Najafpour, MM; Wiechen, M.; Haumann, M.; Kurz, P.; Dau, H., Syntetyczne tlenki manganu i wapnia naśladują funkcjonalnie i strukturalnie utleniający wodę kompleks fotosyntezy. Nauki o energii i środowisku 2011, 4, 2400-2408.
- Bibliografia _ Yano, J.; Surendranath, Y.; Dincă, M.; Yachandra, VK; Nocera, DG, Struktura i wartościowość katalizatora utleniania wody z fosforanem kobaltu określona za pomocą spektroskopii rentgenowskiej in situ. Journal of the American Chemical Society 2010, 132, 13692-13701.
- Bibliografia _ Pickering, IJ; Tomasz, JM; Christensen, PA, Tlenki metali jako heterogeniczne katalizatory wydzielania tlenu w warunkach fotochemicznych. Journal of the Chemical Society, Faradaya Transactions 1: Physical Chemistry in Condensed Phases 1988, 84, 2795-2806.
-
^
Matthew W. Kanan, Yogesh Surendranatha, Daniel G. Nocera (2009). „Związek wydzielający tlen kobaltu i fosforanu”. chemia soc. ks . 38 (1): 109–114. doi : 10.1039/B802885K . PMID 19088970 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) -
Bibliografia
_ Zhang, L.; Szafirowicz, W.; Lymar, SV (2012). „Utlenianie wody katalizowane przez kobalt (II) zaadsorbowany na nanocząstkach krzemionki”. Dziennik Amerykańskiego Towarzystwa Chemicznego . 134 (35): 14275–14278. doi : 10.1021/ja304030y . PMID 22913479 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) - ^ P. Sahoo, J. Tan, Z.-M. Zhang, SK Singh, T.-B. Lu. Inżynieria struktury powierzchni binarnych/trójskładnikowych nanocząstek ferrytu jako wysokowydajnych elektrokatalizatorów do reakcji ewolucji tlenu. ChemCatChem, 2018, 10, 1075. doi: 10.1002/cctc.201701790
- ^ J. Tan, P. Sahoo, J.-W. Wang, Y.-W. Hu, Z. Zhang, Z.-M. Zhang, T.-B. Lu, Wysoce wydajne elektrokatalizatory wydzielania tlenu przygotowane przez grawerowane redukcyjnie ferryty na tlenku grafenu. Granice chemii nieorganicznej, 2018, 5, 310. doi: 10.1039/C7QI00681K