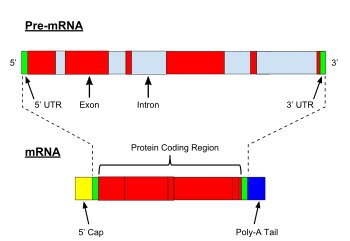
Mniejszy spliceosom
Mniejszy spliceosom jest kompleksem rybonukleoproteinowym , który katalizuje usuwanie ( splatanie ) nietypowej klasy intronów spliceosomalnych (typu U12) z informacyjnych RNA w niektórych kladach eukariontów. Proces ten nazywany jest splicingiem niekanonicznym, w przeciwieństwie do splicingu kanonicznego zależnego od U2. Introny typu U12 stanowią mniej niż 1% wszystkich intronów w komórkach ludzkich. Jednak znajdują się one w genach pełniących podstawowe funkcje komórkowe.
Wczesne dowody
Godną uwagi cechą eukariotycznych jądrowych intronów pre-mRNA jest stosunkowo wysoki poziom zachowania pierwotnych sekwencji miejsc splicingowych 5' i 3' w wielu organizmach.
W latach 1989-1991 kilka grup zgłosiło cztery niezależne przykłady intronów z miejscem składania, które różniło się od wspólnego intronu:
- Gen białka macierzy chrząstki (CMP/MATN1) u ludzi i kurczaków
- Proliferujący gen białka jąderkowego komórki P120 (NOL1) u ludzi
- Mysi gen Rep3, przypuszczalnie zaangażowany w naprawę DNA
- Gen Drosophila prospero, który koduje białko homeoboksu
W 1991 roku, porównując sekwencje intronów genów P120 i CMP, IJ Jackson poinformował o istnieniu miejsc splicingowych ATATCC (5') i YYCAC (3') w tych intronach. Odkrycie wskazuje na możliwy nowy mechanizm splicingu.
W 1994 roku SL Hall i RA Padgett porównali pierwotną sekwencję wszystkich doniesień na temat czterech wspomnianych powyżej genów. Wyniki sugerują nowy typ intronów z miejscami splicingowymi ATATCCTT 5' i miejscami splicingowymi YCCAC 3' oraz prawie niezmienną sekwencją TCCTTAAC w pobliżu końca 3' intronów (tzw. element 3' upstream). Poszukiwanie małych jądrowych sekwencji RNA, które są komplementarne do tych miejsc splicingowych, sugerowało, że U12 snRNA (pasuje do sekwencji 3') i U11 snRNA (pasuje do sekwencji 5') jako przypuszczalne czynniki zaangażowane w splicing tego nowego typu intronów.
We wszystkich tych czterech genach pre-mRNA zawiera inne introny, których sekwencje są zgodne z sekwencjami głównych intronów. Ani rozmiar, ani pozycja intronu AT-AC w genie gospodarza nie jest zachowana.
W 1996 roku Woan-Yuh Tarn i Joan A. Steitz opisali system in vitro , który składa substrat pre-mRNA zawierający intron AT-AC pochodzący z ludzkiego genu P120. Sieciowanie psoralenem potwierdza przewidywaną przez Halla i Padgetta interakcję parowania zasad między miejscem rozgałęzienia substratu pre-mRNA i RNA U12 . Natywna elektroforeza żelowa ujawnia, że snRNP U11, U12 i U5 łączą się z pre-mRNA P120, tworząc kompleksy splicingowe.
Struktura intronów typu U12
Chociaż pierwotnie określane jako introny AT-AC, nie wszystkie te introny są ograniczone przez dinukleotydy AT-AC. Niektóre z nich mają przynajmniej końcówki GT-AG lub AT-AG. Właściwsze jest więc mówienie o maszynach do ich obróbki, rozróżniając typ U2 (kanoniczny lub główny) i U12 (niekanoniczny lub drugorzędny). Głównymi wyznacznikami rozróżniania intronów typu U2 i U12 są sekwencje miejsca splicingowego 5' i miejsca rozgałęzienia.
Mniejszy spliceosom składa się z U11 , U12 , U4atac i U6atac wraz z U5 i nieznaną liczbą białek innych niż snRNP. U11, U12 i U4atac/U6atac snRNP są funkcjonalnymi odpowiednikami U1 , U2 i U4 / U6 snRNP w głównym spliceosomie. Chociaż pomniejsze snRNA U4atac i U6atac są funkcjonalnymi analogami odpowiednio U4 i U6, mają one jedynie ograniczoną homologię sekwencji (ok. 40%). Co więcej, sekwencja U11 w porównaniu z U1, jak również U12 w porównaniu z U2, nie są ze sobą powiązane. Pomimo tego faktu, mniejsze snRNA U11, U12, U4atac i U6atac można złożyć w struktury podobne odpowiednio do U1, U2, U4 i U6.
Lokalizacja mniejszej aktywności spliceosomów
Większość ekspertów uważa, że miejsce aktywności spliceosomu dla spliceosomu niższej klasy znajduje się w jądrze. [ Potrzebne źródło ] Jednak pojedynczy artykuł twierdził, że mniejszy spliceosom jest aktywny w cytosolu. Dane przedstawione w tym artykule nie są w pełni akceptowane w tej dziedzinie i bezpośrednio stoją w sprzeczności z wieloma innymi artykułami.
Ewolucja
Podobnie jak główny spliceosom, mniejszy spliceosom miał wczesne pochodzenie: kilka jego charakterystycznych składników jest obecnych w reprezentatywnych organizmach ze wszystkich supergrup eukariotycznych, dla których istnieją jakiekolwiek istotne informacje o sekwencji genomu. Ponadto funkcjonalnie ważne elementy sekwencji zawarte w intronach typu U12 i snRNA są wysoce konserwatywne podczas ewolucji.
Zobacz też
Artykuły przeglądowe:
-
Turunen, JJ, Niemelä, EH, Verma, B. i Frilander, MJ (styczeń – luty 2013). „Znaczący inny: splicing przez mniejszy spliceosom” . Wiley Interdyscyplinarne Recenzje: RNA . 4 (1): 61–76. doi : 10.1002/wrna.1141 . PMC 3584512 . PMID 23074130 .
{{ cite journal }}: CS1 maint: wiele nazwisk: lista autorów ( link ) Recenzja. - Will CL, Lührmann R (sierpień 2005). „Splatanie rzadkiej klasy intronów przez spliceosom zależny od U12”. Biol. chemia . 386 (8): 713–24. doi : 10.1515/BC.2005.084 . PMID 16201866 . S2CID 35468060 . Recenzja.
Klasyczne papiery:
- Jackson IJ (25 lipca 1991). „Ponowna ocena niezgodnych z konsensusem miejsc składania mRNA” . Kwasy nukleinowe Res . 19 (14): 3795–8. doi : 10.1093/nar/19.14.3795 . PMC 328465 . PMID 1713664 .
- Hall SL, Padgett RA (1994). „Konserwowane sekwencje w klasie rzadkich eukariotycznych intronów jądrowych z niekonsensusowymi miejscami składania”. J. Mol. Biol . 239 (3): 357–65. doi : 10.1006/jmbi.1994.1377 . PMID 8201617 .
- Tarn WY, Steitz JA (8 marca 1996). „Nowy spliceosom zawierający snRNP U11, U12 i U5 wycina intron klasy podrzędnej (AT-AC) in vitro ” . komórka . 84 (5): 801–11. doi : 10.1016/S0092-8674(00)81057-0 . PMID 8625417 .
- Russell AG, Charette JM, Spencer DF, Gray MW (19 października 2006). „Wczesne ewolucyjne pochodzenie mniejszego spliceosomu”. Natura . 443 (7113): 863–6. Bibcode : 2006Natur.443..863R . doi : 10.1038/natura05228 . PMID 17051219 . S2CID 4419061 .
Inne referencje: