Obustronna polimikrogyria czołowo-ciemieniowa
| Obustronna polimikrogyria czołowo-ciemieniowa | |
|---|---|
| Inne nazwy | BFPP |
Obustronna polimikrogyria czołowo-ciemieniowa jest chorobą genetyczną dziedziczoną autosomalnie recesywnie , która powoduje wady rozwojowe kory mózgowej. Nasz mózg ma fałdy w korze , aby zwiększyć powierzchnię zwaną gyri , a pacjenci z polimikrogyrią mają większą liczbę fałd i fałdów mniejszych niż zwykle. Polimikrogyria jest definiowana jako wada rozwojowa kory mózgowej, w której normalny wzór zakrętów powierzchni mózgu jest zastąpiony nadmierną liczbą małych, połączonych zakrętów oddzielonych płytkimi bruzdami i nieprawidłową blaszką korową . Z trwających badań wynika, że mutacja w GPR56, członku rodziny receptorów sprzężonych z białkiem adhezyjnym G (GPCR), skutkuje BFPP. Mutacje te są zlokalizowane w różnych regionach białka bez żadnych dowodów na związek między pozycją mutacji a ciężkością fenotypową. Stwierdzono również, że GPR56 odgrywa rolę w wzorcu korowym.
Prezentacja
- Objawy : opóźnienie rozwoju, opóźnienie psychomotoryczne , upośledzenie umysłowe - umiarkowane do ciężkiego, przesadne odruchy i drgawki (epilepsja)
Powiązane warunki
BFPP to przypominająca brukowiec wada korowa mózgu. Zakłócenia w rozwoju kory mózgowej spowodowane nieprawidłową migracją i pozycjonowaniem neuronów zwykle prowadzą do zaburzeń korowych, w tym brukowca bezmózgowia . Bezmózgowie typu Cobblestone jest zwykle obserwowane w trzech różnych zespołach wrodzonej dystrofii mięśniowej u ludzi: wrodzonej dystrofii mięśniowej Fukuyamy , zespole Walkera-Warburga i chorobie mięśniowo-oczo-mózgowej . W bezmózgowiu z bruku powierzchnia mózgu ma w rzeczywistości wyboisty kontur spowodowany obecnością kolekcji źle rozmieszczonych neuronów i komórek glejowych , które migrowały poza normalne granice powierzchni mózgu. Czasami regiony zaludnione przez te źle umieszczone komórki powodowały błędną diagnozę radiologiczną polimikrogyrii. Jednak obecność innych nieprawidłowości w tych zespołach brukowca lissencephaly, w tym anomalii oczu, wrodzonej dystrofii mięśniowej, ventriculomegalii i dysplazji móżdżku, zwykle odróżnia te zaburzenia od polimikrogyrii. Nie ma badań anatomopatologicznych, które scharakteryzowałyby wzór laminarnych zmian korowych u pacjentów z mutacjami genu GPR56, ale zasugerowano, że cechy obrazowe BFPP, w tym mielinizacji i dysplazja kory móżdżku , przypominają cechy tzw. brukowiec (choroba mięśniowo-oczno-mózgowa i wrodzona dystrofia mięśniowa Fukuyamy), które są również związane z defektami N-glikozylacji w rozwijającym się mózgu.
Lissencephaly („gładki mózg”) jest skrajną postacią pachygyrii . W lissencephaly na powierzchni korowej widać niewiele bruzd lub nie widać ich wcale, co skutkuje szerokim, gładkim wyglądem całego mózgu. Lissencephaly można radiologicznie pomylić z polimikrogyrią, szczególnie przy obrazowaniu o niskiej rozdzielczości, ale gładkość i brak nieregularności w połączeniu szaro-białym, wraz ze znacznie zwiększoną grubością kory, wyróżnia lissencephaly.
Mutacja GPR56 może również powodować ciężką encefalopatię, która jest związana z elektroklinicznymi cechami zespołu Lennoxa-Gastauta . Zespół Lennoxa-Gastauta może być kryptogenny lub objawowy, ale postacie objawowe są związane z wieloma etiologiami i nieprawidłowym rozwojem kory mózgowej. BFPP spowodowane mutacjami GPR56 jest przejawem wady rozwojowej kory, która powoduje zespół Lennoxa-Gastauta.
Polimikrogyria jest często mylona z pachygyrią; dlatego należy go odróżnić od pachygyrii, odrębnej wady rozwojowej mózgu, w której fałdy powierzchniowe są nadmiernie szerokie i rzadkie. Pachygyria i polymikrogyria mogą wyglądać podobnie w neuroobrazowaniu o niskiej rozdzielczości, takim jak CT, ponieważ grubość kory może wydawać się zwiększona, a zakręty mogą wydawać się szerokie i gładkie w obu przypadkach. Dlatego do prawidłowej diagnozy konieczne jest neuroobrazowanie o wyższej rozdzielczości, takie jak MRI.
Genetyka
GPR56 jest zgrupowany w rodzinie B GPCR. Ta grupa GPCR ma długie N-końce charakteryzujące się zewnątrzkomórkową „pudełkiem cysteiny” i hydrofilowym, potencjalnie mucynę . Pudełko cysteinowe zawiera cztery konserwatywne cysteiny i dwa tryptofany ułożone w określony sposób (C-x2-W-x6-16-W-x4-C-x10-22-CxC) tuż przed pierwszą domeną transbłonową i służy jako miejsce cięcia u niektórych członków tej grupy receptorów sprzężonych z białkiem G. Chociaż mechanizmy molekularne i komórkowe regulujące rozwój mózgu przez GPR56 pozostają w dużej mierze nieznane. Te typy receptorów odgrywają istotną rolę w procesach biologicznych, w tym w rozwoju embrionalnym, ośrodkowym układzie nerwowym (OUN), układzie odpornościowym i powstawaniu nowotworów .
Tryb dziedziczenia
Rodzice probanda
- Rodzice osoby dotkniętej chorobą są obligatoryjnymi heterozygotami i dlatego są nosicielami jednego zmutowanego allelu.
- Heterozygoty (nosiciele) są bezobjawowe.
Rodzeństwo probandu
- W momencie poczęcia każde rodzeństwo osoby dotkniętej chorobą ma 25% szans na zachorowanie, 50% szans na bycie bezobjawowym nosicielem i 25% szans na to, że nie zostanie dotknięte chorobą i nie będzie nosicielem.
- Kiedy wiadomo, że rodzeństwo z grupy ryzyka jest nienaruszone, ryzyko, że jest nosicielem, wynosi 2/3.
- Heterozygoty (nosiciele) są bezobjawowe .
Potomstwo probanda
- Potomstwo probanda jest obligatoryjną heterozygotą i dlatego będzie nosiło jeden zmutowany allel.
- W populacjach o wysokim wskaźniku pokrewieństwa potomstwo osoby z BFPP związanej z GPR56 i partnera rozrodczego, który jest nosicielem BFPP związanego z GPR56, ma 50% szans na odziedziczenie dwóch alleli chorobotwórczych GPR56 i posiadanie BFPP i 50% szans na bycie nosicielami.
Inni członkowie rodziny probanta .
- Każde rodzeństwo rodziców probanta jest w 50% narażone na bycie nosicielem
Diagnoza
Kryteria diagnostyczne dla pacjenta z BFPP obejmują heterozygotyczny genotyp z delecją regionu chromosomu 16q12.1-q21, w tym genu GPR56. Jak dotąd jedynym znanym genem związanym z polimikrogyrią jest GPR56. Testowanie obustronnej polimikrogyrii czołowo-ciemieniowej związanej z GPR56 jest dostępne klinicznie. Mutacje w GPR56 utrudniają kolagenowi III, jego specyficznemu ligandowi , wiązanie się w rozwijającym się mózgu. Do tej pory zidentyfikowano łącznie czternaście mutacji związanych z BFPP, w tym jedną delecję, dwie splicingowe i jedenaście mutacji zmiany sensu . Dwie mutacje w domenie miejsca proteolitycznego GPCR (GPS), C346S i W349S, powodują wady rozwojowe mózgu poprzez uwięzienie zmutowanych białek w retikulum endoplazmatycznym .
GPR56 należą do klasy B rodziny GPCR , największej rodziny genów powierzchniowych komórek w ludzkim genomie . W obrębie tej rodziny istnieją różne typy cząsteczek bioaktywnych, które przekazują swój sygnał do wewnątrzkomórkowego poprzez interakcję z tym typem receptora. Dzieci często mają opóźnienie w rozwoju, spastyczność lub drgawki; często mają też mikrocefalię . Niektórzy pacjenci z polimikrogyrią pozostają niezdiagnozowani, dopóki nie urodzą dzieci z tym zaburzeniem, które mają cięższe objawy. Z perspektywy czasu ci pacjenci często zgłaszają pewne trudności w swojej historii medycznej lub edukacyjnej. Pacjenci z BFPP wykazują upośledzenie umysłowe, upośledzenie językowe, opóźnienie rozwoju motorycznego i zaburzenia napadowe, takie jak padaczka. Związek padaczki występuje u około 50% do 85% pacjentów dotkniętych BFPP.
Klinicznymi objawami polimikrogyrii są stabilne deficyty neurologiczne:
W najłagodniejszej postaci polimikrogyria jest jednostronna i dotyczy tylko jednego małego obszaru mózgu; problemy neurologiczne mogą nie być oczywiste.
W cięższych postaciach mogą występować ogniskowe problemy motoryczne, czuciowe, wzrokowe lub poznawcze, w zależności od lokalizacji dotkniętego obszaru mózgu.
W najcięższych postaciach wielozakrętowość jest obustronna i uogólniona, co powoduje ciężką niepełnosprawność intelektualną, porażenie mózgowe i padaczkę oporną na leczenie.
Osoby z łagodniejszymi postaciami polimikrogyrii przeżywają do dorosłości, podczas gdy osoby z najcięższymi postaciami, takimi jak BFPP, mogą umrzeć w młodym wieku w wyniku powikłań, takich jak drgawki lub zapalenie płuc. Częstość występowania izolowanej polimikrogyrii jest nieznana. Naukowcy uważają, że ogólnie może to być stosunkowo powszechne, chociaż BFPP jest prawdopodobnie rzadkie.
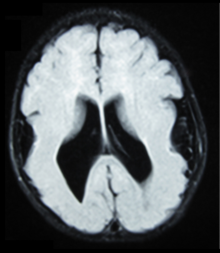
- Wyniki radiologiczne (MRI) wykazały symetryczną uogólnioną polimikrozakrętowość ze zmniejszającym się gradientem przednio-tylnym, najbardziej widocznym w korze czołowo-ciemieniowej.
- Liczne zakręty na korze
- Mały gyri i sulci
- Cienka kora
Metody/testy

Istnieją różne testy lub metody stosowane do określania ekspresji GPR56 lub wizualizacji mózgu w celu analizy określonych sekcji, których to dotyczy. Testy te, na przykład, z wykorzystaniem zwierząt, takich jak myszy, RNAi , test behawioralny, mikroskopia elektronowa, tomografia komputerowa lub MRI, wykazują różne wyniki, które kończą pacjenta z BFPP. MRI ujawnia albo nieregularność powierzchni korowej, sugerującą liczne małe fałdy, albo nieregularny, pofałdowany wygląd połączenia istoty szarej z istotą białą.
Neuroobrazowanie Diagnozę polimikrogyrii stawia się zwykle za pomocą rezonansu magnetycznego (MRI), ponieważ tomografia komputerowa (CT) i inne metody obrazowania na ogół nie mają wystarczająco wysokiej rozdzielczości lub odpowiedniego kontrastu, aby zidentyfikować małe fałdy, które definiują ten stan. Kora mózgowa często wydaje się również nienormalnie gruba, ponieważ wiele małych zakrętów jest połączonych, pofałdowanych i nałożonych na wygląd.
Neuropatologia Pełne badanie neuropatologiczne ujawnia wzór złożonych zwojów kory mózgowej, z miniaturowymi zakrętami zrośniętymi i nałożonymi na siebie, co często skutkuje nieregularną powierzchnią mózgu. Wstęga korowa może wydawać się zbyt gruba w wyniku fałdowania i łączenia wielu małych zakrętów.
Badanie mikroskopowe pokazuje, że kora mózgowa jest w rzeczywistości nienormalnie cienka i ma nieprawidłową laminację; zazwyczaj kora jest niewarstwowa lub ma cztery warstwy, w przeciwieństwie do normalnych sześciu warstw. Najbardziej powierzchowne warstwy między sąsiednimi małymi zakrętami wydają się stopione, z pia (warstwa opon mózgowych) łączącą wiele zakrętów. prenatalna BFPP jest również dostępna dla ciąż zagrożonych, jeśli mutacje GPR56 zostały zidentyfikowane u chorego członka rodziny.
Leczenie
Plany leczenia będą się różnić w zależności od ciężkości stanu i jego objawów u każdego pacjenta. Obszary, które prawdopodobnie będą wymagały oceny i oceny, obejmują mowę, wzrok, słuch i EEG . Środki lecznicze mogą obejmować fizjoterapię, terapię zajęciową, terapię logopedyczną, leki przeciwpadaczkowe i urządzenia ortopedyczne. Może być konieczna operacja, aby złagodzić spastyczne problemy motoryczne. Różne środki wspomagające, takie jak przykurcze stawów, które mogą zapobiegać powikłaniom. Może być również zalecane poradnictwo genetyczne
Rokowanie
Po ustaleniu rozpoznania polimikrogyrii u danej osoby, do omówienia rokowania można zastosować następujące podejście:
Należy zebrać historię ciąży, ze szczególnym uwzględnieniem infekcji, urazów, ciąż mnogich i innych udokumentowanych problemów. Odpowiednie może być badanie przesiewowe w kierunku powszechnych infekcji wrodzonych związanych z polimikrogyrią za pomocą standardowego testu TORCH. Inne specyficzne testy ukierunkowane na poszczególne zaburzenia neurometaboliczne można uzyskać, jeśli zasugeruje to klinicznie.
Poniższe informacje mogą pomóc w ustaleniu etiologii genetycznej:
Historia rodzinna
Ważne jest, aby pytać o obecność problemów neurologicznych u członków rodziny, w tym napadów padaczkowych, opóźnienia poznawczego, upośledzenia motorycznego, objawów rzekomopuszkowych i ogniskowego osłabienia, ponieważ wielu dotkniętych chorobą członków rodziny, zwłaszcza starszych, mogło nie mieć wykonanego MRI, nawet jeśli te problemy zgłoszą się do lekarza. Ponadto, chociaż większość osób z polimikrogyrią ma problemy neurologiczne w okresie niemowlęcym, dziecięcym lub dorosłym, osoby z łagodnymi postaciami mogą nie wykazywać żadnych wyraźnych deficytów lub tylko drobne objawy, takie jak zwykłe seplenienie lub izolowane trudności w uczeniu się. Dlatego, jeśli podejrzewa się rodzinny zespół wielozakrętowości, rozsądne może być wykonanie rezonansu magnetycznego u krewnych, którzy nie mają objawów lub mają drobne zmiany. Obecność pokrewieństwa u rodziców dziecka może sugerować autosomalny recesywny rodzinny zespół polimikrogyrii.
Badanie lekarskie
Ogólne badanie fizykalne probanta może zidentyfikować powiązane wady rozwojowe twarzoczaszki , mięśniowo-szkieletowe lub trzewne , które mogą wskazywać na konkretny zespół. Badanie neurologiczne powinno oceniać zdolności poznawcze i umysłowe, czynność nerwów czaszkowych, funkcję motoryczną, odruchy ze ścięgien głębokich, funkcje czuciowe, koordynację i chód (jeśli dotyczy).
Badania genetyczne

