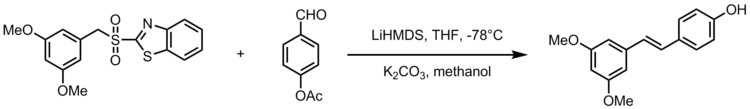Olefinowanie Julii
| Olefinowanie Julii | |
|---|---|
| Nazwany po | Marek Julia |
| Typ reakcji | Reakcja sprzęgania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
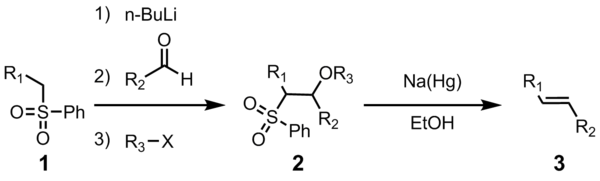
Olefinowanie Julii (znane również jako olefinowanie Julii – Lythgoe ) to reakcja chemiczna stosowana w chemii organicznej fenylosulfonów (1) z aldehydami (lub ketonami ) w celu uzyskania alkenów (olefin ) (3) po funkcjonalizacji alkoholu i eliminacji redukcyjnej za pomocą sodu amalgamat lub SmI 2 . Reakcja została nazwana na cześć francuskiego chemika Marca Julii .
Użyteczność tej łączącej reakcji olefinowania wynika z jej wszechstronności, szerokiej tolerancji grup funkcyjnych i łagodnych warunków reakcji, w których przebiega reakcja.
Wszystkie cztery etapy można przeprowadzić w pojedynczym naczyniu reakcyjnym, a użycie R3X jest opcjonalne. Jednakże oczyszczanie sulfonowego związku pośredniego 2 prowadzi do wyższej wydajności i czystości. Najczęściej R3 oznacza acetyl lub benzoil , z bezwodnikiem octowym lub chlorkiem benzoilu stosowanym do wytwarzania 2.
Historia
W 1973 roku Marc Julia i Jean-Marc Paris opisali nową syntezę olefin, w której β-acyloksysulfony były redukcyjnie eliminowane do odpowiednich di-, tri- lub tetrapodstawionych alkenów. Basil Lythgoe i Philip J. Kocienski zbadali zakres i ograniczenia reakcji, a dziś ta olefinacja jest formalnie znana jako olefinacja Julii-Lythgoe. Reakcja obejmuje dodanie karboanionu stabilizowanego grupą sulfonylową do związku karbonylowego, a następnie eliminację z wytworzeniem alkenu. W początkowych wersjach reakcji eliminację prowadzono w warunkach redukcyjnych. Niedawno opracowano zmodyfikowaną wersję, która pozwala uniknąć tego kroku. Pierwsza wersja jest czasami określana jako olefinacja Julii-Lythgoe, podczas gdy druga nazywana jest olefinacją Julii-Kocienskiego. W wariancie redukcyjnym addukt jest zwykle acylowany, a następnie traktowany środkiem redukującym, takim jak amalgamat sodu lub SmI 2 . Opublikowano kilka recenzji tych reakcji.
Mechanizm reakcji
Pierwsze kroki są proste. Anion fenylosulfonowy (2) reaguje z aldehydem, tworząc alkoholan (3). Alkoholan jest funkcjonalizowany R3-X z wytworzeniem trwałego związku pośredniego (4). Dokładny mechanizm redukcji amalgamatu sodowego nie jest znany, ale wykazano, że zachodzi on poprzez grupę rodników winylowych (5). Protonowanie rodnika winylowego daje pożądany produkt (6).
Stereochemia alkenu (6) jest niezależna od stereochemii pośredniego sulfonu 4. Uważa się, że rodnikowe związki pośrednie są w stanie osiągnąć równowagę, tak że najczęściej wytwarzana jest bardziej stabilna termodynamicznie trans-olefina. Ta przemiana bardzo sprzyja powstawaniu E -alkenu.
Wariacje
Zmodyfikowane olefinowanie Julii
Zmodyfikowana olefinacja Julii, znana również jako olefinacja Julii w jednym naczyniu, jest modyfikacją klasycznej olefinacji Julii. Zastąpienie fenylosulfonów heteroarylosulfonami znacznie zmienia ścieżkę reakcji. Najpopularniejszym przykładem jest benzotiazolu . Reakcja benzotiazolosulfonu (1) z diizopropyloamidkiem litu (LDA) daje metalowany benzotiazolilosulfon, który szybko reaguje z aldehydami (lub ketonami), dając pośredni alkoholan (2). W przeciwieństwie do fenylosulfonów, ten pośredni alkoholan (2) jest bardziej reaktywny i ulegnie przegrupowaniu Smilesa otrzymując sól sulfinianową (4). Sól sulfinianowa (4) spontanicznie eliminuje dwutlenek siarki i benzotiazolon litu (5), tworząc pożądany alken (6).
Ponieważ odmiana benzotiazolu olefinowania Julii nie obejmuje równoważących związków pośrednich, wynik stereochemiczny jest wynikiem stereochemii początkowej addycji karbonylu. W wyniku tej reakcji często powstaje mieszanina stereoizomerów alkenu.
Olefinowanie Julii-Kocieńskiego
| Olefinowanie Julii-Kocieńskiego | |
|---|---|
| Nazwany po |
Marc Julia Philip Joseph Kocienski |
| Typ reakcji | Reakcja sprzęgania |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
Olefinacja Julii-Kocienskiego, dalsze udoskonalenie olefinacji Modified Julia, zapewnia bardzo dobrą E -selektywność. W olefinacji Julii-Kocienskiego czynnikiem alkilującym jest tetrazol . Postępuje według tego samego mechanizmu, co powyższy sulfon benzotiazolu. Wysoka E -selektywność olefinowania Julii-Kocieńskiego jest wynikiem kontrolowanej kinetycznie diastereoselektywnej addycji metalowanych 1-fenylo-1H-tetrazol-5-ilo(PT)sulfonów do nieskoniugowanych aldehydów. Daje to anty-β-alkoksysulfony, które stereospecyficznie rozkładają się do E -alkeny. W jednej adaptacji, z t-butylotetrazoilometylosulfonem, warunki reakcji to bis (trimetylosililo) amid sodu w temperaturze -70 ° C w tetrahydrofuranie lub węglan cezu w temperaturze + 70 ° C. Ta reakcja została nazwana na cześć Philipa J. Kocienskiego za jego modyfikację olefinowania Julii.
Aplikacje syntetyczne
Julia lub zmodyfikowana reakcja olefinowania Julii to potężna i wszechstronna transformacja syntetyczna, szeroko stosowana w konstruowaniu złożonych produktów naturalnych z doskonałą kontrolą izomerii geometrycznej.
Pterostilben
Pterostilben jest stilbenoidem chemicznie spokrewnionym z resweratrolem. Należy do grupy fitoaleksyn, produkowanych przez rośliny środków zwalczających infekcje. Pterostilben jest naturalnie występującym analogiem eteru dimetylowego resweratrolu. Uważa się, że związek ten ma również przeciwcukrzycowe , jednak jak dotąd niewiele przebadano na ten temat.
W porównaniu z reakcjami Wittiga , Wittiga-Hornera, Perkina lub reakcjami katalizowanymi metalami przejściowymi w celu syntezy pterostylebenu, olefinowanie Julii oferuje prostą, ekonomiczną alternatywną metodę wytwarzania pterostilbenu.
Resweratrol
Jedna adaptacja olefinacji Julii-Kocienskiego daje syntezę resweratrolu stilbenoidowego , naturalnego związku występującego w popularnych produktach spożywczych, takich jak winogrona, wina i orzechy. Resweratrol jest biologicznie ważnym stilbenoidem, który, jak sugerowano, ma wiele korzyści zdrowotnych. Olefinowanie Julii-Kocienskiego służy jako silna reakcja w syntezie analogów resweratrolu z 3,5-bis(trifluorometylo)fenylosulfonami. Poniższy schemat przedstawia ogólny schemat syntezy analogów resweratrolu, gdzie R2 oznacza grupę arylową.
(-)-Kallystatyna A
W asymetrycznej całkowitej syntezie (-)-kalistatyny A przeprowadzonej przez Amosa Smitha zastosowano dwie oddzielne olefiny Julii do przyłączenia dwóch ugrupowań E -alkenowych. (-)-kalistatyna A należy do rodziny antybiotyków leptomycyny. Poniższy schemat przedstawia olefinowanie Julii-Kocienskiego użyte do uzyskania prekursora produktu naturalnego, na co wskazuje użycie PT-sulfonu.
Zobacz też
- Reakcja Hornera – Wadswortha – Emmonsa
- Reakcja Johnsona-Coreya-Czajkowskiego
- olefinowanie Petersona
- Reakcja Wittiga
- Bibliografia _ Paryż, J.-M. Czworościan Lett. 1973, 14 , 4833-4836. ( doi : 10.1016/S0040-4039(01)87348-2 )
- ^ Kocieński, PJ; Lythgoe, B.; Ruston, SJ Chem. Soc., Perkin Trans. 1 1978, 829.
- Bibliografia _ Savin, KA; Węglarz, mgr J. Org. chemia 1995, 60 , 3194-3204. ( doi : 10.1021/jo00115a041 )
- ^ Kocienski, PJ Fosfor i siarka 1985, 24 , 97–127. (Recenzja)
- ^ Kelly, SE Kompleksowa synteza organiczna 1991, 1 , 792–806. (Przegląd) ( doi : 10.1016/B978-0-08-052349-1.00020-2 )
- ^ Blakemore, PR J. Chem. Soc., Perkin Trans. 1 2002, 2563–2585. ( doi : 10.1039/b208078h )
- Bibliografia _ Hareau, G.; Julia, SA; Ruel, O. Tetrahedron Lett. 1991, 32 , 1175. ( doi : 10.1016/S0040-4039(00)92037-9 )
- ^ Rozejm, MY; Kreider, EM; Marka, WW Org. Reagować. 1970, 18 , 99. (Recenzja)
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocieński, Andrew Morley Synlett 1998, 26–28. ( doi : 10.1055/s-1998-1570 )
- ^ Christophe Aïssa J. Org. chemia 2006, 71 , 360–63. ( doi : 10.1021/jo051693a )
- ^ Zając, B. i Kumar, R. (2010). Synteza fluoroolefin metodą olefinowania Julii-Kocienskiego. Synthesis , 2010(11), 1822–1836.( doi : 10.1055/s-0029-1218789 )
- Bibliografia _ Cena, RJ (1977). „Nowa klasa fitoaleksyn z winorośli”. Experientia 33 (2): 151–2. ( doi : 10.1007/BF02124034 ) PMID 844529 .
- Bibliografia _ Cardoso, FSP; Correia, CRD Heck arylowanie styrenów solami arenediazoniowymi: krótka, wydajna i stereoselektywna synteza resweratrolu, DMU-212 i analogów. Czworościan Lett. 2008, 49(39), 5668–5671.
- ^ Prabhakar Peddikotla, Amar G. Chittiboyina, Ikhlas A. Khan, (2014) ChemInform Abstract: Synthesis of Pterostilbene by Julia Olefination. ChemInform 45, doi : 10.1002/chin.201408101 .
- ^ Alonso DA, Fuensanta M, Najera C, Varea MJ Org. chemia 2005; 70:6404–6416. PMID 16050703 .
- ^ AB Smith, III i BM Brandt. Całkowita synteza (-)-Kallystatyny A. Org. Łotysz. 2001, 3, 1685–1688.
- Bibliografia _ Pospíšil, J. O pochodzeniu selektywności E / Z w zmodyfikowanej olefinacji Julii: znaczenie etapu eliminacji; Eur. J.Org. chemia 2013, 836–840.