Reakcja wstawiania
Reakcja insercji to reakcja chemiczna , w której jedna jednostka chemiczna ( cząsteczka lub fragment cząsteczki) wstawia się w istniejące wiązanie zazwyczaj drugiej jednostki chemicznej, np .:
Termin odnosi się tylko do wyniku reakcji i nie sugeruje mechanizmu . Reakcje wstawiania obserwuje się w chemii organicznej , nieorganicznej i metaloorganicznej . W przypadkach, gdy zaangażowane jest wiązanie metal- ligand w kompleksie koordynacyjnym , reakcje te mają zazwyczaj charakter metaloorganiczny i obejmują wiązanie między metalem przejściowym a węglem lub wodorem . Zwykle jest zarezerwowany dla przypadku, gdy liczba koordynacyjna i stopień utlenienia metalu pozostaje niezmieniony. Kiedy te reakcje są odwracalne, usunięcie małej cząsteczki z wiązania metal-ligand nazywa się wytłaczaniem lub eliminacją.
-
()
-
()
Istnieją dwie popularne geometrie wstawiania — 1,1 i 1,2 (na ilustracji powyżej). Dodatkowo, wstawiona cząsteczka może działać jako nukleofil lub jako elektrofil kompleksu metalu. SO2 Te zachowania zostaną omówione bardziej szczegółowo dla CO , zachowania nukleofilowego i , zachowania elektrofilowego.
Chemia organiczna
Reakcje homologacji , takie jak homologacja estru Kowalskiego, dostarczają prostych przykładów procesu insercji w syntezie organicznej. W reakcji Arndta-Eisterta jednostka metylenowa jest wstawiana do wiązania karboksylowo -węglowego kwasu karboksylowego , tworząc następny kwas w szeregu homologicznym . Organic Syntheses dostarcza przykładu ( S ) -fenyloalaniny zabezpieczonej t -BOC (kwas 2-amino-3-fenylopropionowy) poddaje się sekwencyjnej reakcji z trietyloaminą , chloromrówczanem etylu i diazometanem w celu wytworzenia α-diazoketonu , który następnie poddaje się reakcji z trifluorooctanem srebra / trietyloaminą w roztworze wodnym w celu wytworzenia zabezpieczonej postaci t -BOC ( Kwas S )-3-amino-4-fenylobutanowy.
Mechanistycznie α-diazoketon przechodzi przegrupowanie Wolffa , tworząc keten w przegrupowaniu 1,2 . W konsekwencji grupa metylenowa α- w stosunku do grupy karboksylowej w produkcie jest grupą metylenową z odczynnika diazometanu. Wykazano, że przegrupowanie 1,2 zachowuje stereochemię centrum chiralności, ponieważ produkt utworzony z S )-fenyloalaniny zabezpieczonej t -BOC zachowuje stereochemię ( S ) z podanym nadmiarem enancjomerycznym wynoszącym co najmniej 99%.
Pokrewną transformacją jest reakcja Nierensteina , w której grupa metylenowa diazometanu jest wstawiana do wiązania węgiel-chlor chlorku kwasowego w celu wytworzenia α-chloroketonu. Przykład opublikowany w 1924 r. Ilustruje reakcję w układzie podstawionego chlorku benzoilu :
Być może zaskakująco, α-bromoacetofenon jest drugorzędnym produktem, gdy tę reakcję prowadzi się z bromkiem benzoilu , przy czym głównym produktem jest dimeryczny dioksan . Azydki organiczne również stanowią przykład reakcji insercji w syntezie organicznej i, podobnie jak w powyższych przykładach, przemiany przebiegają z utratą gazowego azotu . Kiedy azydek tosylu reaguje z norbornadienem , rozszerzenie pierścienia zachodzi reakcja, w której atom azotu zostaje wstawiony w wiązanie węgiel-węgiel α- do mostka:
Przegrupowanie Beckmanna to kolejny przykład reakcji rozszerzania pierścienia, w której heteroatom jest wstawiany w wiązanie węgiel-węgiel. Najważniejszym zastosowaniem tej reakcji jest konwersja cykloheksanonu do jego oksymu, który jest następnie przegrupowywany w warunkach kwasowych z wytworzeniem ε- kaprolaktamu , surowca do produkcji nylonu 6 . Roczna produkcja kaprolaktamu przekracza 2 miliardy kilogramów.
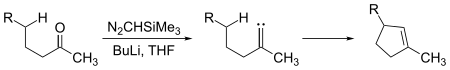
Karbeny podlegają zarówno reakcjom insercji międzycząsteczkowej , jak i wewnątrzcząsteczkowej . Ugrupowania cyklopentenu można wytworzyć z wystarczająco długołańcuchowych ketonów w reakcji z trimetylosililodiazometanem , (CH 3 ) 3 Si – CHN 2 :
Tutaj pośredni karben wstawia się w wiązanie węgiel-wodór, tworząc wiązanie węgiel-węgiel potrzebne do zamknięcia pierścienia cyklopentenu. Insercje karbenu w wiązania węgiel-wodór mogą również zachodzić międzycząsteczkowo:
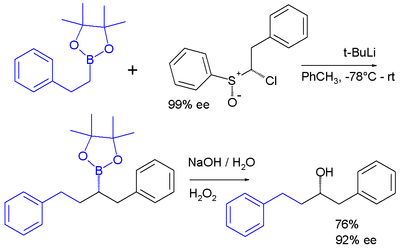
Karbenoidy to reaktywne półprodukty , które zachowują się podobnie do karbenów. Jednym z przykładów jest odczynnik karbenoidowy chloroalkilolitu przygotowany in situ z sulfotlenku i t -BuLi , który wstawia się w wiązanie węgiel-bor estru boronowego pinakolu :
Chemia metaloorganiczna
Wiele reakcji w chemii metaloorganicznej obejmuje wstawienie jednego ligandu (L) do wiązania metal-wodorek lub metal-alkil/aryl. Ogólnie to grupa wodorkowa, alkilowa lub arylowa migruje do L, którym często jest CO, alken lub alkin.
Karbonylacje
Wstawianie tlenku węgla i alkenów do wiązań metal-węgiel jest szeroko stosowaną reakcją mającą główne zastosowania przemysłowe.
Takie reakcje podlegają zwykłym parametrom, które wpływają na inne reakcje w chemii koordynacyjnej, ale efekty steryczne są szczególnie ważne przy określaniu stereochemii i regiochemii reakcji. Reakcja odwrotna, de-insercja CO i alkenów, ma również fundamentalne znaczenie w wielu cyklach katalitycznych.
Powszechnie stosowanymi zastosowaniami migracji grup karbonylowych są hydroformylowanie i karbonylowa produkcja kwasu octowego. Ten pierwszy przekształca alkeny, wodór i tlenek węgla w aldehydy. Produkcja kwasu octowego przez karbonylowanie odbywa się za pomocą dwóch podobnych procesów przemysłowych. Bardziej tradycyjny jest proces z kwasem octowym Monsanto na bazie rodu , ale proces ten został zastąpiony przez proces Cativa na bazie irydu . Do 2002 roku światowa roczna produkcja kwasu octowego wynosiła 6 milionów ton, z czego około 60% pochodzi z procesu Cativa.
cykl katalityczny procesu Cativa obejmuje zarówno etapy wstawiania, jak i usuwania. Oksydacyjna reakcja addycji jodku metylu z ( 1 ) obejmuje formalne wstawienie centrum irydu (I) do wiązania węgiel-jod, podczas gdy etapy ( 3 ) do ( 4 ) są przykładem migracyjnego wstawienia tlenku węgla do irydu -wiązanie węglowe. Aktywne formy katalizatora są regenerowane przez redukcyjną eliminację jodku acetylu z ( 4 ), reakcję de-insercji.
Wstawienie olefin
Wstawienie etylenu i propylenu do alkilotytanu jest kamieniem węgielnym katalizy Zieglera-Natty , komercyjnej drogi polietylenu i polipropylenu. Ta technologia obejmuje głównie katalizatory heterogeniczne, ale powszechnie przyjmuje się, że zasady i obserwacje dotyczące układów jednorodnych mają zastosowanie do wersji w stanie stałym. Powiązane technologie obejmują proces Shell Higher Olefin Process , w ramach którego wytwarzany jest detergent prekursory. olefinę można dopasować do metalu przed włożeniem. W zależności od gęstości ligandu metalu, dysocjacja ligandu może być konieczna, aby zapewnić miejsce koordynacyjne dla olefiny.
Inne reakcje insercji w chemii koordynacyjnej
Wiele elektrofilowych tlenków wstawia się w wiązania metali z węglem; obejmują one dwutlenek siarki , dwutlenek węgla i tlenek azotu. Reakcje te mają ograniczone znaczenie praktyczne, ale mają znaczenie historyczne. W przypadku alkili metali przejściowych tlenki te zachowują się jak elektrofile i włączają się w wiązanie między metalami a ich względnie nukleofilowymi ligandami alkilowymi. Jak omówiono w artykule na temat kompleksów dwutlenku siarki z metalami , wstawienie SO 2 zostało szczegółowo zbadane.
Więcej reakcji insercji w chemii organicznej
Metale elektrododatnie, takie jak sód, potas, magnez, cynk itp. Mogą wstawiać się do halogenków alkilowych, przerywając wiązanie węgiel-halogenek (halogenkiem może być chlor, brom, jod) i tworząc wiązanie węgiel-metal. Ta reakcja zachodzi za pośrednictwem mechanizmu SET (mechanizm przeniesienia pojedynczego elektronu). Jeśli magnez reaguje z halogenkiem alkilu, tworzy odczynnik Grignarda , a jeśli lit reaguje, powstaje odczynnik litoorganiczny . Zatem ten typ reakcji insercji ma ważne zastosowania w syntezie chemicznej .