Reporter fluorescencyjny wrażliwy na glutaminian
Genetycznie zmodyfikowane białko fluorescencyjne , które zmienia swoją fluorescencję po związaniu z neuroprzekaźnikiem glutaminianem . Reportery fluorescencyjne wrażliwe na glutaminian (iGluSnFR, potocznie wymawiane jako „ sniffer kleju ”) są używane do monitorowania aktywności zakończeń presynaptycznych za pomocą mikroskopii fluorescencyjnej . GluSnFR to klasa optogenetycznych stosowanych w badaniach neurologicznych . Mikroskopia dwufotonowa w tkance mózgowej jest zwykle używany do monitorowania fluorescencji GluSnFR.
Projekt
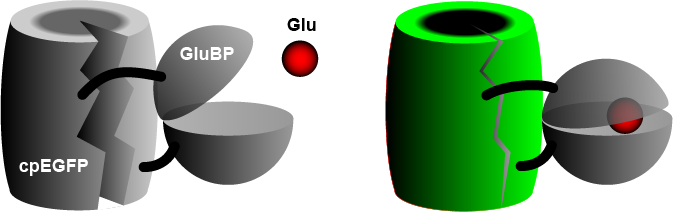
Szeroko stosowany iGluSnFR składa się z permutowanego kołowo białka wzmocnionej zielonej fluorescencji (cpEGFP) połączonego z białkiem wiążącym glutaminian (GluBP) z bakterii . Kiedy GluBP wiąże glutaminianu , zmienia swój kształt, ściągając razem beczkę EGFP , zwiększając fluorescencję. Specyficzny segment peptydowy ( PDGFR ) jest zawarty w celu przeniesienia czujnika na zewnątrz błony komórkowej . W nowszej wersji Aggarwal et al. (2022) badacze wprowadzili iGluSnFR do dwóch dodatkowych domen kotwiących, kotwicy glikozylophostydyloinozytolu (GPI) i zmodyfikowanej postaci cytozolowej domeny cterminalnej Stargazin z ligandem PDZ.
Historia
Pierwsze genetycznie zakodowane fluorescencyjne czujniki glutaminianu (FLIPE, GluSnFR i SuperGluSnFR) zostały skonstruowane poprzez przyłączenie cyjanowego białka fluorescencyjnego (CFP) i żółtego fluorescencyjnego białka (YFP) do bakteryjnego białka wiążącego glutaminian (GluBP ) . Wiązanie glutaminianu zmieniło odległość między CFP i YFP, zmieniając efektywność transferu energii ( FRET ) między dwoma fluoroforami . Przełom w wizualizacji uwalniania glutaminianu został osiągnięty dzięki iGluSnFR, czujnikowi glutaminianu z pojedynczym fluoroforem opartemu na EGFP powodując ~5-krotny wzrost fluorescencji. Aby zmierzyć transmisję synaptyczną przy wysokich częstotliwościach, opracowano niedawno nowe warianty iGluSnFR o przyspieszonej kinetyce.