SLC35A1-CDG
| SLC35A1-CDG | |
|---|---|
| Inne nazwy | CDG IIf, WRODZONE ZABURZENIE GLIKOZYLacji TYPU IIf, CDG2F, zespół CDG typu IIf, niedobór transportera CMP-kwasu sialowego, zespół niedoboru węglowodanów glikoprotein typu IIf, wrodzone zaburzenie glikozylacji typu 2f, wrodzone zaburzenie glikozylacji typu IIf, CDG-IIIf, SLC35A1-CDG |
 | |
| Specjalność | Genetyka medyczna |
| Objawy | Nieprawidłowości układu naczyniowego |
| Komplikacje | Wczesna śmierć |
| Zwykły początek | Narodziny-dzieciństwo |
| Czas trwania | Trwający całe życie |
| Powoduje | Mutacja genetyczna |
| Zapobieganie | nic |
| Rokowanie | Średni - słaby |
| Częstotliwość | bardzo rzadko, w literaturze medycznej opisano tylko 3 przypadki |
| Zgony | spośród 3 osób, u których zdiagnozowano tę chorobę, podejrzewa się, że 1 nadal żyje, a pozostałe 2 zmarły z powodu powikłań chirurgicznych, które zostały zaostrzone przez ich stan. |
SLC35A1-CDG to rzadkie zaburzenie dziedziczne, które wpływa głównie na układ naczyniowy organizmu. Stanowi część dużej grupy zaburzeń zwanych wrodzonymi zaburzeniami glikozylacji . Jest to spowodowane mutacjami w SLC35A1 , zlokalizowanym w szóstym chromosomie.
Symptomy i objawy
Poniższa lista zawiera objawy tego stanu (wymienione przez HPO):
- Zwiększona podatność na krwawienia
- Nieprawidłowości strukturalne megakariocytów
- Anomalie ziarnistości płytek krwi
- cellulit
- Olbrzymie płytki krwi (płytki krwi większe niż 7 mikrometrów)
- Niski poziom tlenu we krwi
- Neutropenia
- Zapalenie płuc
- Dłuższy czas zatrzymania krwawienia w uszkodzonych obszarach skóry
- Krwotok płucny
- Niewydolność oddechowa
- Zwiększona podatność na powstawanie siniaków
- Małopłytkowość
Komplikacje
Istnieją różne komplikacje związane z tym stanem, z których wszystkie są związane z objawami wymienionymi powyżej.
Na przykład hipoksemia (obniżony poziom tlenu we krwi) może skutkować niedotlenieniem , które nieleczone będzie miało poważniejszy wpływ na serce i mózg.
Diagnoza
Ten stan można zdiagnozować, wykonując sekwencjonowanie całego genomu i badanie fizykalne.
Genetyka
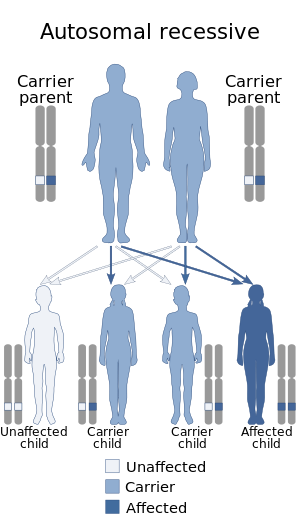
Jak sama nazwa wskazuje, ten stan jest spowodowany mutacjami w genie SLC35A1 , zlokalizowanym w długim ramieniu szóstego chromosomu. Mutacje te są dziedziczone w sposób autosomalny recesywny, co oznacza, że tylko osoby homozygotyczne pod względem mutacji genu będą wykazywać cechy z nią związane.
Leczenie
Leczenie koncentruje się na objawach:
- Cellulitis można leczyć za pomocą przepisanych doustnych antybiotyków.
- Hipoksemię można leczyć metodami takimi jak butle z tlenem.
- Leczenie zapalenia płuc różni się w zależności od ciężkości tego schorzenia, ale ogólnie łagodne zapalenie płuc można leczyć antybiotykami, regularnie pić płyny i odpoczywać. Inne metody leczenia obejmują stosowanie środków przeciwbólowych w celu zmniejszenia bólu i gorączki, które zwykle towarzyszą przypadkom zapalenia płuc.
- Leczenie krwotoku płucnego różni się w zależności od tego, czy jest zlokalizowane, ale w takich przypadkach (krwawienie miejscowe) metody takie jak leczenie bronchostopowe i operacja mogą pomóc w leczeniu.
- Leczenie niewydolności oddechowej ma na celu usunięcie przyczyny, ale ogólnie dodatkowy tlen, mechaniczne urządzenia do wentylacji i leki mogą pomóc w jej leczeniu.
Rozpowszechnienie
Podobnie jak inne wrodzone zaburzenia glikozylacji, ten stan występuje niezwykle rzadko, z (według OMIM) dotychczas opisanych w literaturze medycznej tylko 3 niespokrewnionych pacjentów. (sierpień 2022)
Sprawy
Poniższa lista zawiera jedyne 3 przypadki SLC35A1 kiedykolwiek zgłoszone w historii (zgodnie ze stroną OMIM dla stanu: #603585 WRODZONE ZABURZENIE GLIKOZYLACJI, TYP IIf; CDG2F)
- 2001: Willig i in. opisuje pierwszy w historii medycznej przypadek SLC35A1-CDG u 4-miesięcznego dziecka płci męskiej, u którego doszło do samoistnego krwawienia do komory tylnej prawego oka, któremu towarzyszyły krwotoki skórne, dalsze badania laboratoryjne wykazały małopłytkowość i neutropenię. W ciągu następnych 30 miesięcy (2 lata i 6 miesięcy) swojego życia cierpiał na duże ilości epizodycznych krwawień wieloukładowych, z jednym z tych epizodów obejmującym ciężki krwotok płucny. Dziecko cierpiało również na częste nawracające infekcje bakteryjne, później zmarło w wyniku powikłań przeźroczystego szpiku kostnego w wieku 37 miesięcy (3 lata i 1 miesiąc). W 2005 roku Martinez-Duncker i in. znaleźli dwie złożone heterozygotyczne mutacje zmiany sensu w genie SLC35A1 wspomnianego dziecka, z tych dwóch mutacji jedna była patogenną mutacją skracającą, podczas gdy druga była powszechną mutacją polimorfizm pojedynczego nukleotydu .
- 2013: Mohamed i in. opisuje przypadek 22-letniej kobiety, która była dzieckiem spokrewnionych rodziców pochodzenia tureckiego. Zaczęły rozwijać się u niej opóźnienia płatnicze i uogólnione napady toniczno-kloniczne w wieku 7 lat (mimo że normalnie rozwijała się przed tym wiekiem), a następnie pojawiły się u niej problemy behawioralne w okresie dojrzewania. Miała małogłowie , łagodny przypadek ataksji , osłabienie odruchów dystalnych kończyn dolnych, hipotonię , niepełnosprawność intelektualną , szmer skurczowy serca związany z niedomykalnością aorty, hipoteloryzm , płaska potylica, głęboko osadzone oczy, skrócona rynienka podnosowa, płetwiasta szyja, klinodaktylia palców, haluksy na obu stopach i nadmierna ruchomość stawów do 20 roku życia. Dalsze badania laboratoryjne wykazały makrotrombocytopenię, białkomocz, aminokwasomocz i zmniejszone ilości czynników krzepnięcia. Zmarła w wieku 22 lat z powodu powikłań pooperacyjnych. Badania genetyczne wspomnianej kobiety ujawniły homozygotyczną mutację zmiany sensu w genie SLC35A1, kiedy przeprowadzono badania genetyczne u jej rodziców, okazało się, że byli heterozygotycznymi nosicielami mutacji. Badania funkcjonalnej ekspresji in vitro wykazały, że ta mutacja (nazwana Q101H) prowadzi do zmniejszenia aktywności transportowej CMP-Sia o 50% w porównaniu ze zdrowymi osobami kontrolnymi. Komórki ssaków z niedoborem SLC35A1 (z powodu mutacji Q101H) wykazały przywrócenie ekspresji kwasu polisialowego, które zostało zmniejszone o 15% w porównaniu z wersją genu typu dzikiego.
- 2017: Ng i in. opisuje 12-letnią dziewczynkę pochodzenia niemieckiego, która urodziła się z hipotonią iw wieku 4 miesięcy rozwinęła napady padaczkowe wraz z tikami ustno-twarzowymi. EEG wywołanego medycznie napadu częściowego ujawniło ogniskowe kolce obok polikolców. Miała ciężką encefalopatię , poważne opóźnienia psychomotoryczne i umiarkowana niepełnosprawność intelektualna (miała IQ poniżej 55), trudności z mówieniem, ruchy ataksyczno-dyskinetyczne. Inne cechy obejmowały oczopląs i objawy autystyczne. Badania laboratoryjne wykazały wzór transferyny CDG typu II w surowicy i połączony defekt w N- i O-glikozylacji. Po zastosowaniu sekwencjonowania całego egzomu stwierdzono, że ma złożone heterozygotyczne mutacje zmiany sensu (które później nazwano T156R i E196K) w genie SLC35A1, wspomniane mutacje potwierdzono wykonując sekwencjonowanie Sangera. Badania przeprowadzone na komórkach dziecka wykazały obniżone ilości N- i O-glikanów, które skończyły jako kwas sialowy wraz z poważną utratą funkcji transportowej SLC35A1.