Termometr RNA
Termometr RNA (lub termoczujnik RNA ) to wrażliwa na temperaturę niekodująca cząsteczka RNA, która reguluje ekspresję genów . Termometry RNA często regulują geny wymagane podczas szoku cieplnego lub reakcji szoku zimnego , ale powiązano je z innymi rolami regulacyjnymi, takimi jak patogenność i głód .
Ogólnie rzecz biorąc, termometry RNA działają na zasadzie zmiany swojej struktury drugorzędowej w odpowiedzi na wahania temperatury. To przejście strukturalne może następnie odsłonić lub zasłonić ważne regiony RNA, takie jak miejsce wiązania rybosomu , co z kolei wpływa na szybkość translacji pobliskiego genu kodującego białko .
Termometry RNA wraz z ryboprzełącznikami służą jako przykłady potwierdzające hipotezę świata RNA . Teoria ta sugeruje, że RNA był kiedyś jedynym kwasem nukleinowym obecnym w komórkach i został zastąpiony obecnym układem DNA → RNA → białko .
Przykłady termometrów RNA obejmują FourU , element cis -regulacyjny Hsp90 , element ROSE , termometr Lig RNA i termometr Hsp17 .
Odkrycie
Pierwszy wrażliwy na temperaturę element RNA opisano w 1989 r. Przed tymi badaniami stwierdzono, że mutacje powyżej miejsca startu transkrypcji w mRNA cIII faga lambda (λ) wpływają na poziom translacji białka cIII. Białko to bierze udział w selekcji litycznego lub lizogennego cyklu życiowego faga λ, przy wysokich stężeniach cIII promujących lizogenię. Dalsze badania tego górnego regionu RNA pozwoliły zidentyfikować dwie alternatywne struktury drugorzędowe ; badanie eksperymentalne wykazało, że struktury są wymienne i zależą zarówno od jonów magnezu , jak i temperatury. Obecnie uważa się, że ten termometr RNA zachęca do wejścia w cykl lityczny pod wpływem stresu cieplnego, aby bakteriofag mógł szybko replikować i uciec z komórki gospodarza.
Termin „termometr RNA” powstał dopiero w 1999 r., kiedy to zastosowano go do określenia elementu rpoH RNA zidentyfikowanego w Escherichia coli . Niedawno przeprowadzono poszukiwania bioinformatyczne w celu odkrycia kilku nowatorskich termometrów RNA. Tradycyjne wyszukiwania oparte na sekwencji są jednak nieefektywne, ponieważ drugorzędowa struktura elementu jest znacznie bardziej konserwatywna niż sekwencja kwasu nukleinowego .
Dystrybucja
Najbardziej znane termometry RNA znajdują się w nieulegającym translacji regionie 5′ (UTR) informacyjnego RNA kodującego białka szoku cieplnego — choć sugeruje się, że fakt ten może częściowo wynikać z błędu próbkowania i nieodłącznych trudności w wykrywaniu krótkich, niekonserwowanych sekwencji RNA w danych genomowych .
Chociaż spotykany jest głównie u prokariotów , potencjalny termometr RNA odkryto u ssaków , w tym u ludzi . Kandydat na termosensorowy szok cieplny RNA-1 (HSR1) aktywuje czynnik transkrypcyjny szoku cieplnego 1 (HSF1) i indukuje białka ochronne, gdy temperatura komórki przekracza 37 °C ( temperatura ciała ), zapobiegając w ten sposób przegrzaniu komórek.
Struktura

Termometry RNA są strukturalnie proste i można je wykonać z krótkich sekwencji RNA; najmniejszy ma zaledwie 44 nukleotydy i występuje w mRNA białka szoku cieplnego, hsp17, u gatunku Synechocystis PCC 6803 . Ogólnie te elementy RNA mają długość od 60 do 110 nukleotydów i zazwyczaj zawierają spinkę do włosów z małą liczbą niedopasowanych par zasad, co zmniejsza stabilność struktury, umożliwiając w ten sposób łatwiejsze rozwijanie w odpowiedzi na wzrost temperatury.
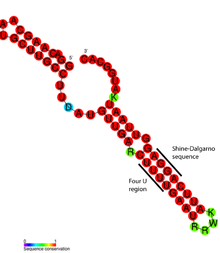
Szczegółowa analiza strukturalna termometru ROSE RNA ujawniła, że niedopasowane zasady w rzeczywistości biorą udział w niestandardowym parowaniu zasad, które zachowuje helikalną strukturę RNA (patrz rysunek). Niezwykłe pary zasad składają się z par GG, UU i UC-U. Ponieważ te niekanoniczne pary zasad są stosunkowo niestabilne, podwyższona temperatura powoduje lokalne topienie struktury RNA w tym regionie, odsłaniając sekwencję Shine-Dalgarno.
Niektóre termometry RNA są znacznie bardziej złożone niż pojedyncza spinka do włosów, jak w przypadku regionu występującego w mRNA CspA , który, jak się uważa, zawiera pseudowęzeł , a także wiele spinek do włosów.
syntetycznego RNA zostały zaprojektowane z prostą strukturą o pojedynczej spince do włosów. Jednakże struktura drugorzędowa takich termometrów z krótkim RNA może być wrażliwa na mutacje, ponieważ pojedyncza zmiana zasady może spowodować, że spinka do włosów stanie się nieaktywna in vivo .
Mechanizm

Termometry RNA znajdują się w 5' UTR informacyjnego RNA, powyżej genu kodującego białko. Tutaj są w stanie zamknąć miejsce wiązania rybosomu (RBS) i zapobiec translacji mRNA na białko. Wraz ze wzrostem temperatury struktura spinki do włosów może „stopić się” i odsłonić sekwencję RBS lub Shine-Dalgarno, umożliwiając związanie małej podjednostki rybosomu ( 30S ), która następnie składa inną maszynerię translacyjną. Kodon start , zwykle znajdujący się 8 nukleotydów poniżej sekwencji Shine-Dalgarno, sygnalizuje początek genu kodującego białko, który następnie ulega translacji do produktu peptydowego przez rybosom . Oprócz tego działającego w trybie cis , w mRNA RpoS znaleziono samotny przykład termometru RNA działającego w trybie trans , gdzie uważa się, że bierze on udział w reakcji głodowej.
Konkretnym przykładem motywu termometru RNA jest termometr FourU występujący w Salmonella enterica . Pod wpływem temperatur powyżej 45 °C pętla łodygi , w której pary zasad są przeciwne do sekwencji Shine-Dalgarno, staje się niesparowana i umożliwia mRNA przedostanie się do rybosomu w celu zajścia translacji. Wykazano również, że stężenie jonów Mg 2+ wpływa na stabilność FourU. Najlepiej zbadany termometr RNA znajduje się w genie rpoH u Escherichia coli . Ten termoczujnik reguluje w górę białka szoku cieplnego w wysokich temperaturach poprzez σ32 , wyspecjalizowany współczynnik sigma szoku cieplnego .
Termometry RNA, choć zazwyczaj kojarzone z ekspresją białek indukowaną ciepłem, mogą również regulować białka szoku zimnego. Na przykład ekspresja dwóch białek o masie 7 kDa jest regulowana za pomocą termometru RNA w termofilnej bakterii Thermus thermophilus , a podobny mechanizm zidentyfikowano u Enterobacterium .
Termometry RNA wrażliwe na temperaturę 37 °C mogą być wykorzystywane przez patogeny do aktywacji genów specyficznych dla infekcji. Na przykład, regulację w górę prfA , kodującego kluczowy regulator transkrypcji genów zjadliwości u Listeria monocytogenes , wykazano poprzez fuzję 5' DNA prfA z genem białka zielonej fluorescencji ; fuzję genów następnie transkrybowano z promotora T7 w E. coli i obserwowano fluorescencję w temperaturze 37°C, ale nie w 30°C.
Implikacje dla hipotezy świata RNA
Hipoteza świata RNA stwierdza, że RNA był kiedyś zarówno nośnikiem informacji dziedzicznej, jak i aktywnym enzymatycznie , a różne sekwencje działały jako biokatalizatory, regulatory i czujniki. Hipoteza sugeruje następnie, że współczesne życie oparte na DNA, RNA i białkach ewoluowało, a selekcja zastąpiła większość ról RNA innymi biomolekułami .
Uważa się, że termometry RNA i ryboprzełączniki są starożytne ewolucyjnie ze względu na ich szerokie rozmieszczenie w odlegle spokrewnionych organizmach. Zaproponowano, że w świecie RNA termoczujniki RNA byłyby odpowiedzialne za zależną od temperatury regulację innych cząsteczek RNA. Termometry RNA we współczesnych organizmach mogą być skamieniałościami molekularnymi , co może wskazywać na wcześniej bardziej powszechne znaczenie tych termometrów w świecie RNA.
Inne przykłady
- Element cis-regulacyjny Hsp90 reguluje hsp90 u Drosophila , zwiększając szybkość translacji białka szoku cieplnego w wysokich temperaturach.
- operon ibpAB E. coli będzie zawierał dwa współpracujące termometry RNA: element ROSE i termometr IbpB .
- ROSE 1 i ROSE AT2 występują odpowiednio w Hyphomicrobiales Bradyrhizobium japonicum i Agrobacterium tumefaciens . Występują w 5' UTR HspA i tłumią translację białek szoku cieplnego w temperaturach fizjologicznych.
- Termometry cyjanobakteryjne RNA
- Termometr międzygenowy RNA
- Termometry RNA Neisseria
- Termometr Lig RNA