Rozwinięcie szeregowe równania stanu dla układu wielocząstkowego
Klasyczna ekspansja wirialna wyraża ciśnienie P układu wielocząstkowego w równowadze jako szereg potęgowy w gęstości :

gdzie nazywa
się 
. Jest to wirialne równanie stanu, najbardziej ogólna funkcja związana z ciśnieniem
P , gęstością
ρ i temperaturą
T płynów. Po raz pierwszy został zaproponowany przez
Kamerlingha Onnesa . Współczynnik ściśliwości jest wielkością bezwymiarową, wskazującą, jak bardzo rzeczywisty płyn odbiega od gazu doskonałego.
A jest pierwszym współczynnikiem wirialnym, który ma stałą wartość 1. Stwierdza on, że przy małej gęstości wszystkie płyny zachowują się jak gazy doskonałe. Współczynniki wirialne
B ,
C ,
D itd. są zależne od temperatury i są ogólnie przedstawiane jako szeregi Taylora wyrażone jako
1/ T .
Drugi i trzeci współczynnik wirialny
Drugi, B i trzeci, C , współczynniki wirialne były szeroko badane i zestawione w tabelach dla wielu płynów przez ponad sto lat. Dwie najbardziej obszerne kompilacje znajdują się w książkach Dymonda. oraz NIST Thermo Data Engine Database i jej Web Thermo Tables. W zestawieniach tych zawarte są tablice drugiego i trzeciego współczynnika wirialnego wielu płynów.
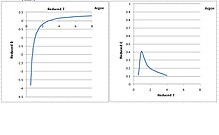
Drugi i trzeci współczynnik wirialny argonu
Drugi i trzeci współczynnik wirialny w funkcji temperatury przedstawiono na poniższym rysunku dla argonu. Zredukowana temperatura i zmniejszone współczynniki wirialne, skalowane według odpowiednich właściwości krytycznych, są bezwymiarowe. Zauważ na rysunku, że drugi współczynnik wirialny maleje monotonicznie wraz ze spadkiem temperatury. Jednak trzeci współczynnik wirialny ma kształt dzwonu. Zwiększa się, gdy temperatura spada do temperatury krytycznej, następnie przechodzi przez szczyt i gwałtownie spada do zera, gdy temperatura obniża się od punktu krytycznego do punktu potrójnego. Spadek poniżej temperatury krytycznej jest fizycznie nieuzasadniony. Dzieje się tak, ponieważ trzeci współczynnik wirialny teoretycznie reprezentuje siłę odpychania między cząsteczkami, która ma wzrosnąć w niższej temperaturze, gdy cząsteczki są dociskane do siebie. Opisane właśnie zachowania są podobne do wielu innych gazów, jak pokazano na poniższym rysunku.
Powód, dla którego trzeci współczynnik wirialny spada poniżej temperatury krytycznej, jest następujący. [ potrzebne źródło ] Zasadniczo izotermy PρT są mierzone w fazie gazowej. Poniżej temperatury krytycznej faza gazowa skrapla się i współistnieje z fazą ciekłą, a izoterma PρT staje się płaska. Ciśnienie nasycenia nie zmienia się, dopóki gaz nie skrapla się całkowicie do stanu ciekłego, a następnie ciśnienie wzrasta wraz ze wzrostem gęstości. Istnieje duża luka między czystą fazą gazową a czystą fazą ciekłą, w przypadku której nie są dostępne żadne użyteczne dane dotyczące ciśnienia, z wyjątkiem ciśnienia nasycenia. Gdyby analizować tylko dane w fazie gazowej, trzeci współczynnik wirialny staje się bardzo mały, ponieważ izoterma PρT jest prawie liniowa w fazie gazowej. Jeśli jednak zostaną uwzględnione punkty danych w czystej fazie ciekłej, regresja drugiego rzędu dałaby duży trzeci współczynnik wirialny. Wyprowadzony w ten sposób trzeci współczynnik wirialny wzrastałby monotonicznie w miarę obniżania temperatury od punktu krytycznego do punktu potrójnego.
Oczekiwanie, że trzeci współczynnik wirialny jest monotonicznie rosnącą funkcją 1/ T , można zweryfikować za pomocą równań stanu, które dokładnie przewidywały izotermy PρT w obszarze nasycenia, w którym współistnieją fazy gazowa i ciekła.
Przekształcanie równań stanu w postać wirialną
Większość równań stanu można przeformułować i ująć w równania wirialne w celu oceny i porównania ich niejawnych drugich i trzecich współczynników wirialnych. Przełomowe stanu Van der Waalsa zostało zaproponowane w 1873 roku:

gdzie
v = 1/ ρ jest objętością molową. Można go uporządkować, rozszerzając
1/( v - b ) do szeregu Taylora:

W równaniu Van der Waalsa drugi współczynnik wirialny ma z grubsza prawidłowe zachowanie, ponieważ maleje monotonicznie, gdy temperatura jest obniżana. Trzeci i wyższe współczynniki wirialne są niezależne od temperatury i nie są poprawne, zwłaszcza w niskich temperaturach.
Niemal wszystkie kolejne równania stanu wyprowadzone z równania Van der Waalsa, takie jak równania Dietericiego, Berthelota, Redlicha-Kwonga, Peng-Robinsona itp., cierpią z powodu osobliwości wprowadzonej przez 1/( v - b ) . Dlatego nie mogą dokładnie reprezentować izoterm PρT w temperaturach poniżej temperatury krytycznej. Wiele z nich daje odpowiednie drugie współczynniki wirialne, ale większość daje nieprawidłowe trzecie współczynniki wirialne [ potrzebne źródło ] .
Inne równania stanu, zapoczątkowane przez Beattiego-Bridgemana, są jednak bliżej spokrewnione z równaniami wirialnymi i okazują się dokładniejsze w przedstawianiu zachowania płynów zarówno w fazie gazowej, jak i ciekłej. [ potrzebne źródło ] Można je przeformułować w wirialne równania stanu i porównać ze sobą. Równanie stanu Beattiego-Bridgemana, zaproponowane w 1928 r.,

Gdzie


można przeorganizować:

To równanie stanu dobrze reprezentuje drugi współczynnik wirialny. Jednak trzeci współczynnik wirialny ma zły znak. W związku z tym nie reprezentuje izoterm bliskich i niższych od temperatury krytycznej.
Równanie Benedicta-Webba-Rubina stanu z 1940 roku przedstawia lepsze izotermy poniżej temperatury krytycznej:

Więcej ulepszeń osiąga Starling w 1972 roku:

Poniżej przedstawiono wykresy zredukowanych drugich i trzecich współczynników wirialnych w funkcji obniżonej temperatury według Starlinga:

Drugi i trzeci współczynnik wirialny dla 12 płynów
Wykładnicze wyrażenia w dwóch ostatnich równaniach korygują trzeci współczynnik wirialny, tak że izotermy w fazie ciekłej mogą być reprezentowane poprawnie. Składnik wykładniczy  pierwsze wyrazy z szeregu rozwinięć Taylora i pomnożyli to
pierwsze wyrazy z szeregu rozwinięć Taylora i pomnożyli to  , wynik to
, wynik to  . W ten sposób wnosi
. W ten sposób wnosi  ósmego współczynnika wirialnego, który można
ósmego współczynnika wirialnego, który można
Po rozwinięciu wyrazów wykładniczych równania stanu Benedicta-Webba-Rubina i Starlinga mają następującą postać:

Czwarty i piąty współczynnik wirialny wynosi zero. Po trzecim członie wirialnym kolejnym znaczącym członem jest szósty współczynnik wirialny. Wydaje się, że pierwsze trzy człony wirialne dominują we współczynniku ściśliwości płynów, aż do i


ρ do .
[ potrzebne źródło ]
Ponowna analiza danych przez Starling
Po ponownej analizie danych zgłoszonych przez Starling, współczynniki wirialne są najlepiej reprezentowane przez



b i
c można określić za pomocą prostej analizy regresji drugiego rzędu z eksperymentalnych izoterm PρT.

i

można następnie określić za pomocą analizy regresji trzeciego rzędu na
b i
c .

można następnie określić, analizując pozostałości we współczynniku ściśliwości po usunięciu pierwszych trzech terminów wirialnych z równania wirialnego. Dane Starling są ponownie analizowane, a wyniki przedstawiono w poniższej tabeli. Wszystkie te współczynniki są bezwymiarowe, wszystkie są skalowane z krytycznymi objętościami molowymi i krytyczną temperaturą.
| Płyn |
 |
 |
 |
 |
 |
 |
 |
 |
 |

|
| Metan |
0,440 |
−1,171 |
−0,236 |
−0,210 |
0,364 |
−0,275 |
−0,014 |
0,396 |
0,0319 |
1,71 × 10-03 _
|
| Etan |
0,330 |
−0,806 |
−0,363 |
−0,378 |
0,553 |
−0,675 |
−0,038 |
0,680 |
0,0461 |
2,63 × 10-03 _
|
| propan |
0,288 |
−0,706 |
−0,245 |
−0,575 |
0,532 |
−0,546 |
−0,308 |
0,843 |
0,0334 |
1,89 × 10-02 _
|
| n-butan |
0,377 |
−0,916 |
−0,115 |
−0,610 |
0,547 |
−0,519 |
−0,347 |
0,871 |
0,0305 |
2,04 × 10-02 _
|
| i-butan |
0,438 |
−1,051 |
−0,172 |
−0,401 |
0,483 |
−0,342 |
−0,021 |
0,538 |
0,0194 |
1,19 × 10-03 _
|
| n-pentan |
0,481 |
−1,056 |
−0,166 |
−0,560 |
0,668 |
−0,720 |
−0,204 |
0,841 |
0,0411 |
1,17 × 10-02 _
|
| i-pentan |
0,242 |
−0,674 |
−0,306 |
−0,520 |
0,815 |
−0,943 |
−0,194 |
0,868 |
0,0484 |
9,99 × 10-03 _
|
| n-Heksan |
0,435 |
−0,636 |
−0,358 |
−0,759 |
0,848 |
−1,275 |
−0,105 |
1.120 |
0,0604 |
4,98 × 10-03 _
|
| n-heptan |
0,493 |
−0,798 |
−0,636 |
−0,428 |
0,589 |
−0,738 |
−0,017 |
0,814 |
0,0508 |
1,21 × 10-03 _
|
| n-oktan |
0,600 |
−0,744 |
−0,456 |
−0,763 |
0,174 |
−0,197 |
−0,272 |
0,919 |
0,0144 |
1,99 × 10-02 _
|
| Azot |
0,502 |
−1,380 |
0,092 |
−0,333 |
0,400 |
−0,276 |
−0,027 |
0,322 |
0,0279 |
2,72 × 10-03 _
|
| CO2 _
|
0,178 |
−0,044 |
−1,517 |
0,039 |
0,428 |
−0,422 |
−0,008 |
0,687 |
0,0490 |
9,52 × 10-04 _
|
| H2S _ _ |
0,191 |
−0,927 |
−0,078 |
−0,366 |
1.093 |
−1,227 |
−0,001 |
0,577 |
0,0578 |
8,37 × 10-05 _
|
Sześcienne wirialne równanie stanu
Trójczłonowe równanie wirialne lub sześcienne wirialne równanie stanu

ma prostotę równania stanu Van der Waalsa bez osobliwości w
v = b . Teoretycznie drugi współczynnik wirialny reprezentuje siły przyciągania dwucząsteczkowego, a trzeci człon wirialny reprezentuje siły odpychające między trzema cząsteczkami w bliskim kontakcie.
[ Potrzebne źródło ] Intuicyjnie powinniśmy oczekiwać, że
B stanie się ujemny w niskiej temperaturze, podczas gdy
C pozostanie dodatnie, aby zrównoważyć efekt
B i popycha
Z , a tym samym ciśnienie do wysokich wartości, jak
ρ wzrasta.
Za pomocą tego sześciennego równania wirialnego współczynniki B i C można rozwiązać w postaci zamkniętej. Nałożenie warunków krytycznych:

sześcienne równanie wirialne można rozwiązać, otrzymując:


I


wynosi zatem 0,333, w porównaniu do 0,375 z równania stanu Van der Waalsa.
Pomiędzy punktem krytycznym a punktem potrójnym znajduje się obszar nasycenia płynów. W tym obszarze faza gazowa współistnieje z fazą ciekłą pod ciśnieniem nasycenia  temperaturą nasycenia
temperaturą nasycenia  . Pod ciśnieniem nasycenia faza
. Pod ciśnieniem nasycenia faza 
 objętość molową , a faza gazowa ma objętość molową . Odpowiednie gęstości molowe to
objętość molową , a faza gazowa ma objętość molową . Odpowiednie gęstości molowe to  i
i  . Są to właściwości nasycenia potrzebne do obliczenia drugiego i trzeciego współczynnika wirialnego.
. Są to właściwości nasycenia potrzebne do obliczenia drugiego i trzeciego współczynnika wirialnego.
Prawidłowe równanie stanu musi dawać izotermę, która przecina poziomą linię  w
w  i
i  , na
, na  . [ potrzebne źródło ] Pod
. [ potrzebne źródło ] Pod  i
i  , gaz jest w równowadze z cieczą. Oznacza to, że izoterma PρT ma trzy pierwiastki w
, gaz jest w równowadze z cieczą. Oznacza to, że izoterma PρT ma trzy pierwiastki w  . Sześcienne wirialne równanie stanu w
. Sześcienne wirialne równanie stanu w  to:
to:

Można to przeorganizować jako:

Współczynnik

to objętość gazu nasyconego zgodnie z prawem gazu doskonałego i można mu nadać unikalną nazwę

:

W obszarze nasycenia równanie sześcienne ma trzy pierwiastki i można je zapisać alternatywnie jako:

co można rozwinąć jako:


to objętość w stanie niestabilnym między

a

. Równania sześcienne są identyczne. Dlatego z terminów liniowych w tych równaniach można rozwiązać:


Z wyrażeń kwadratowych
B można rozwiązać:

A z wyrażeń sześciennych
C można rozwiązać:

Ponieważ

,

i

zostały zestawione w tabeli dla wielu płyny z

jako parametrem,
B i
C można obliczyć w obszarze nasycenia tych płynów. Wyniki są zasadniczo zgodne z wynikami obliczonymi z równań stanu Benedicta-Webba-Rubina i Starlinga.
[ potrzebne źródło ] Jednak dokładność w
B i
C jest w dużym stopniu zależna od pomiarów i


, które są bardzo trudne do wykonania dokładnie mierzyć w niskich temperaturach. Wprowadzone w ten sposób błędy pomiarowe do
B i
C należy wziąć pod uwagę, porównując otrzymane w ten sposób wartości z wartościami uzyskanymi z analizy regresji drugiego rzędu izoterm PρT.
Równowaga gaz-ciecz-ciało stałe
Sześcienne wirialne równanie stanu dokładnie przedstawia równowagę gaz-ciecz większości substancji od punktu krytycznego do punktu potrójnego, w którym zaczyna pojawiać się faza stała. Można go rozszerzyć, aby uwzględnić równowagę gaz-ciecz-ciało stałe:


pierwszy wyraz ciśnienie generowane przez energię kinetyczną Drugi

. Trzeci termin

reprezentuje odpychanie trójcząsteczkowe krótkiego zasięgu. Drugi człon obniża izotermę PVT w miarę zmniejszania objętości, podczas gdy trzeci człon podnosi izotermę. Gdy temperatura jest poniżej punktu krytycznego, izoterma PVT ma zatem wygięcie w kształcie litery S, co umożliwia współistnienie fazy ciekłej z przeważającą fazą gazową.
 , gdybyśmy mieli obniżający izotermę PVT w fazie ciekłej i
, gdybyśmy mieli obniżający izotermę PVT w fazie ciekłej i  pod względem wypchnięcia go z powrotem w górę, mogłaby powstać faza stała, ponieważ te dwa składniki tworzą kolejne zagięcie w kształcie litery S między cieczą a ciałem stałym. Wykazano, że takie zagięcie w kształcie litery S można zsyntetyzować za pomocą
pod względem wypchnięcia go z powrotem w górę, mogłaby powstać faza stała, ponieważ te dwa składniki tworzą kolejne zagięcie w kształcie litery S między cieczą a ciałem stałym. Wykazano, że takie zagięcie w kształcie litery S można zsyntetyzować za pomocą  -funkcja taka jak funkcja Lorentza nad równaniem stanu van der Waalsa. Takim równaniem stanu trudno manipulować matematycznie. Natomiast równanie wirialne jest łatwiejsze w obsłudze.
-funkcja taka jak funkcja Lorentza nad równaniem stanu van der Waalsa. Takim równaniem stanu trudno manipulować matematycznie. Natomiast równanie wirialne jest łatwiejsze w obsłudze.
Argon jest używany do realistycznej oceny tego rozszerzonego równania wirialnego dla równowagi gaz-ciecz-ciało stałe. Dane będą analizowane w postaci zredukowanej. Wszystkie zmienne PVT są skalowane według ich odpowiednich wartości krytycznych. Na podstawie zasady odpowiednich stanów oczekuje się, że wyniki będą miały zastosowanie do innych dobrze zachowujących się płynów. Odpowiednie dane dotyczące argonu podsumowano w poniższej tabeli:
| Własność Argonu |
Wartość |
Zmniejszona wartość |
| Objętość punktu krytycznego (dm 3 /mol) |
0,07459 |
1 |
| Temperatura punktu krytycznego (K) |
150.687 |
1 |
| Ciśnienie w punkcie krytycznym (MPa) |
4.863 |
1 |
| Krytyczna ściśliwość |
0,291 |
0,291 |
| Objętość molowa pary punktu potrójnego (dm 3 /mol) |
9.853 |
132.1 |
| Objętość molowa cieczy punktu potrójnego (dm 3 /mol) |
0,0282 |
0,378 |
| Potrójna objętość molowa ciał stałych (dm 3 /mol) |
0,246 |
0,330 |
| Temperatura punktu potrójnego (K) |
83.8058 |
0,553 |
| Ciśnienie punktu potrójnego (MPa) |
0,06889 |
0,0142 |
Gdy zmienne P , V i T zostaną zastąpione ich zredukowanymi odpowiednikami,  ,
,  i
i  , równanie wirialne przyjmuje następującą postać:
, równanie wirialne przyjmuje następującą postać:

gdzie

,

,

,

i

. Zajmiemy się głównie warunkami w punkcie potrójnym argonu, gdzie
b = 3,424 i
c = 1,152 z wcześniejszego badania.
[ potrzebne źródło ]

 większa niż objętość stałego argonu, 0,33, i znajdować się między objętościami ciekłego i stałego argonu. Początkowo ustawia się objętość ciała stałego, aby wytworzyć ostatnią ostro wznoszącą się krawędź izotermy, w której faza stała pojawia się przy bardzo
większa niż objętość stałego argonu, 0,33, i znajdować się między objętościami ciekłego i stałego argonu. Początkowo ustawia się objętość ciała stałego, aby wytworzyć ostatnią ostro wznoszącą się krawędź izotermy, w której faza stała pojawia się przy bardzo  Wykładniczy n musi być wtedy określony tak, aby dolina w n -2 n potencjał musi mieścić się między objętościami ciała stałego (0,33) i cieczy (0,378). Po określeniu wykładniczego n wartość
Wykładniczy n musi być wtedy określony tak, aby dolina w n -2 n potencjał musi mieścić się między objętościami ciała stałego (0,33) i cieczy (0,378). Po określeniu wykładniczego n wartość  , aby spełnić regułę Gibbsa, która wymaga, aby energia swobodna Gibbsa fazy ciekłej i fazy stałej była równa pod potrójną liczbą punktowa temperatura i ciśnienie.
, aby spełnić regułę Gibbsa, która wymaga, aby energia swobodna Gibbsa fazy ciekłej i fazy stałej była równa pod potrójną liczbą punktowa temperatura i ciśnienie.
Aby wytworzyć fazę stałą w argonie, wykładnicza wartość n musi być bardzo duża, większa niż 20; w przeciwnym razie izoterma PVT nie wygięłaby się do kształtu litery S między cieczą a ciałem stałym. Najlepsze oszacowanie jest takie, że n = 30,  ,
,  i
i  . Izoterma jest pokazana na prawym rysunku, na którym trzy terminy wirialne są wykreślone osobno dla przejrzystości:
. Izoterma jest pokazana na prawym rysunku, na którym trzy terminy wirialne są wykreślone osobno dla przejrzystości:




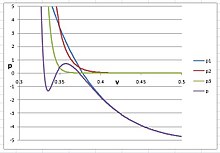
Izoterma PVT argonu przy
n = 30 .
Na tym rysunku  sumę pierwszych trzech terminów wirialnych sześciennego równania wirialnego i pokazuje zachowanie argonu w jego fazie gazowej i
sumę pierwszych trzech terminów wirialnych sześciennego równania wirialnego i pokazuje zachowanie argonu w jego fazie gazowej i  reprezentuje potencjał wniesiony z terminu
reprezentuje potencjał wniesiony z terminu  p
p  reprezentuje wkład
reprezentuje wkład  termin. Kiedy n
termin. Kiedy n  30, kolidowałoby to z
30, kolidowałoby to z  znacznie zmniejszałoby objętość cieczy
znacznie zmniejszałoby objętość cieczy
Zaskakujące jest to, że n musi być większe niż 20, aby wytworzyć fazę stałą. Powszechnie wiadomo, że potencjał Lenarda-Jonesa 6-12 można wykorzystać do obliczenia drugiego współczynnika wirialnego z zasad mechaniki kwantowej. Rozumowanie mechaniki kwantowej wiąże drugi współczynnik wirialny z przyciąganiem dwucząsteczkowym, a trzeci współczynnik z odpychaniem trójcząsteczkowym itp. W ciekłej fazie argonu jeden atom jest otoczony 12 najbliższymi sąsiadami i do 32 najbliższymi sąsiadami. W fazie stałej wszystkie atomy są zablokowane, a liczba oddziałujących na siebie sąsiadów jest nieskończona. Dlatego n = 30 lub nawet więcej jest rozsądne.
W rezultacie mamy wirialne równanie stanu opisujące ilościowo równowagę gaz-ciecz-ciało stałe dla argonu i wszystkich płynów, które przestrzegają zasady odpowiednich stanów, w punkcie potrójnym:

Wirialne równania stanu
Na podstawie równań stanu Benedicta-Webba-Rubina i Starlinga ustalono, że najlepsze wirialne równanie stanu powinno mieć postać [ potrzebne źródło ]

Drugi i trzeci współczynnik wirialny w tym równaniu można obliczyć z eksperymentalnych danych PρT przy użyciu
regresji liniowej . Po usunięciu pierwszych trzech terminów wirialnych, pozostałość we współczynniku ściśliwości
Z można następnie wykorzystać do uzyskania szóstego współczynnika wirialnego.
Zobacz też





























































































