eos (białko)
EosFP jest fotoaktywowanym białkiem fluorescencyjnym o barwie zielonej do czerwonej . Jego zielona fluorescencja (516 nm) zmienia się na czerwoną (581 nm) po napromieniowaniu UV ~ 390 nm (światło fioletowe / niebieskie) z powodu fotoindukowanej modyfikacji wynikającej z pęknięcia szkieletu peptydowego w pobliżu chromoforu . Eos został po raz pierwszy odkryty jako białko tetrameryczne w kamienistym koralowcu Lobophyllia hemprichii . Podobnie jak inne białka fluorescencyjne, Eos umożliwia takie zastosowania, jak śledzenie białek fuzyjnych, wielokolorowe znakowanie i śledzenie ruchu komórek. Kilka wariantów Eos zostało zaprojektowanych do użytku w określonych systemach badawczych, w tym mEos2, mEos4 i CaMPARI.
Historia

EosFP został po raz pierwszy odkryty w 2005 roku podczas badań przesiewowych na dużą skalę w poszukiwaniu PAFP (fotoaktywowanych białek fluorescencyjnych) w kamienistym koralowcu Lobophyllia hemprichii . Od tego czasu z powodzeniem sklonowano go w Escherichia coli i opracowano konstrukty fuzyjne do stosowania w komórkach ludzkich. Eos został nazwany na cześć greckiej bogini świtu .
W przeciwieństwie do tetramerycznych białek fluorescencyjnych pochodzących z koralowca antozoańskiego , które mogą zakłócać normalne funkcje komórkowe z powodu interakcji między podjednostkami białkowymi, EosFP został podzielony na warianty dimeryczne i monomeryczne poprzez wprowadzenie pojedynczych mutacji punktowych . Warianty te z powodzeniem śledzą składniki komórkowe bez zakłócania funkcji w komórce gospodarza i zachowują te same właściwości fotofizyczne, co Eos typu dzikiego.
Od czasu ich odkrycia wykazano, że monomeryczne sondy Eos (mEos) lokalizują się w cytozolu , błonie komórkowej , endosomach , pęcherzykach przedwodnikowych , wakuolach , retikulum endoplazmatycznym , ciałach Golgiego , peroksysomach , mitochondriach , wgłobieniach, aktynie nitkowatej i mikrotubulach korowych. Białka fuzyjne mEos umożliwiają różnicowe znakowanie kolorami w pojedynczych komórkach lub grupach komórek w rozwijających się narządach. Można je również wykorzystać do zrozumienia przestrzennych/czasowych interakcji między organellami a pęcherzykami. Dwie fluorescencyjne formy mEosFP (zielona i czerwona) są kompatybilne z CFP, GFP, YFP i RFP w przypadku etykiet wielokolorowych.
Funkcjonować
EosFP emituje silną zieloną fluorescencję (516 nm), która zmienia się nieodwracalnie w czerwień (581 nm) po naświetleniu światłem UV o długości fali 390 nm. Ta modyfikacja zachodzi z powodu pęknięcia szkieletu peptydowego obok chromoforu. Mechanizm ten pozwala na zlokalizowane znakowanie białka i sprawia, że EosFP jest odpowiednim narzędziem do śledzenia ruchu białek w żywych komórkach. Tworzenie czerwonego chromoforu obejmuje rozszczepienie szkieletu peptydowego, ale prawie nie obejmuje innych zmian w strukturze białka.
Według spektroskopii fluorescencyjnej pojedynczej cząsteczki , EosFP jest tetramerem i wykazuje silne sprzężenie rezonansowe Forstera w poszczególnych fluoroforach. Podobnie jak inne białka fluorescencyjne, Eos może być używany do zgłaszania różnych sygnałów w komórkach , tkankach i narządach bez zakłócania złożonej maszynerii biologicznej. Podczas gdy użycie białek fluorescencyjnych było kiedyś ograniczone do zielonego białka fluorescencyjnego ( GFP ), w ostatnich latach sklonowano wiele innych białek fluorescencyjnych. W przeciwieństwie do GFP, które pochodzą z luminescencyjnej meduzy Aequorea victoria, białka fluorescencyjne pochodzące z anthozoa , w tym Eos, emitują fluorescencję w czerwonym zakresie widmowym. Nowatorska właściwość fotoindukowanej konwersji z zielonego na czerwony w Eos jest przydatna, ponieważ pozwala na zlokalizowane śledzenie białek w żywych komórkach. EosFP jest wyjątkowy, ponieważ ma dużą separację długości fal, które może emitować, co pozwala na łatwą identyfikację kolorów szczytowych. Wszystkie fotoindukowalne białka fluorescencyjne od zielonego do czerwonego, w tym Eos, zawierają jednostkę chromoforową pochodzącą z tripeptydu his-tyr-gly. Ta konwersja z zielonego na czerwony jest zakończona raczej światłem niż utlenianiem chemicznym, jak w innych FP.
Właściwości struktury i absorbancji
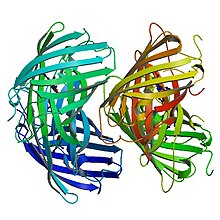
Struktura pierwotna
EosFP składa się z 226 aminokwasów . Ma masę cząsteczkową 25,8 kDa, a jego pI wynosi 6,9. Eos ma 84% identycznych reszt do Kaede , fluorescencyjnego białka, które pochodzi z innego skleraktynijskiego koralowca Trachyphyllia geoffroyi , ale może być również nieodwracalnie przekształcone z zielonej na czerwoną formę emitującą za pomocą światła UV. Z wyjątkiem reszt Phe-61 i His-62, środowisko chromoforu i sam chromofor nie podlegają modyfikacji fotochemicznej. EosFP typu dzikiego ma tetrameryczny układ podjednostek, w którym każda podjednostka ma taką samą strukturę puszki jak GFP. Ta struktura obejmuje 11-niciową beczkę i wzdłuż osi środkowej helisę zawierającą fluorofor.
Struktura zielonego EosFP
W swojej postaci anionowej zielony chromofor ma maksima absorpcji przy 506 nm i maksima emisji przy 516 nm. Powstaje autokatalitycznie z aminokwasów His-62, Tyr-63 i Gly-64. Bezpośrednio wokół chromoforu znajduje się skupisko naładowanych lub polarnych aminokwasów, jak również cząsteczki wody strukturalnej. Powyżej płaszczyzny chromoforu znajduje się sieć oddziaływań wiązań wodorowych między Glu-144, His-194, Glu-212 i Gln-38. Arg-66 i Arg-91 uczestniczą w wiązaniu wodorowym z tlenem karbonylowym ugrupowania imidazolinonu zielonego Eosu. Łańcuch boczny His-62 leży w niepolarnym środowisku. Konwersja z formy zielonej do czerwonej zależy od obecności histydyny w pierwszej pozycji tripeptydu HYG tworzącego chromofor. Kiedy ta reszta histydyny zostanie zastąpiona przez M, S, T lub L, Eos emituje tylko jasnozielone światło i nie działa już jako białko fluorescencyjne ulegające fotokonwersji.

Struktura czerwonego EosFP
Czerwony chromofor, który jest generowany przez rozszczepienie szkieletu peptydowego, ma maksima absorpcji przy 571 nm i maksima emisji przy 581 nm, w postaci anionowej. Przerwa w szkielecie peptydowym, która prowadzi do tego chromoforu, znajduje się między His-62 Nα i Cα. Obserwowana czerwona fluorescencja występuje z powodu przedłużenia koniugacji π chromoforu, w której pierścień imidazolu His-62 łączy się z imidazolinonem. Wzory wiązań wodorowych chromoforów czerwonego i zielonego są prawie identyczne.
| Nieruchomości | |
|---|---|
| Długość fali fotokonwersji | 390 nm |
| Zielony pik absorbancji | 506 nm |
| Zielony szczyt emisji | 516 nm |
| Czerwony pik absorbancji | 571 nm |
| Czerwony szczyt emisji | 581 nm |
| Jasność zielona* | 1,3X |
| Czerwona jasność* | 0,7X |
| * Wartości jasności odnoszą się do EGFP . | |
Konwersja fotochemiczna
Konwersja fotochemiczna zachodzi w wyniku interakcji między jednostką chromoforową a pozostałościami w jej pobliżu. Glu-212 działa jako zasada, która usuwa proton z His-62, pomagając w rozszczepianiu wiązania His-62-Nα-Cα. Zastąpienie Glu-212 glutaminą zapobiega fotokonwersji. Przy niskim pH wydajność Eos zaangażowanego w fotokonwersję znacznie wzrasta wraz ze wzrostem frakcji cząsteczek w postaci protonowanej. Spektrum działania fotokonwersji jest ściśle związane ze spektrum działania protonowanej formy Eosa. Obserwacje te sugerują, że neutralna forma zielonego chromoforu, w tym protonowany łańcuch boczny Tyr-63, jest strukturą bramkową dla fotokonwersji. Wyrzut protonu z łańcucha bocznego fenylu Tyr-63 jest ważnym wydarzeniem w mechanizmie konwersji, w którym proton jest przenoszony z imidazolu His-62, który jest związany wiązaniem wodorowym z karbonylem Phe-61. Dodatkowy proton powoduje, że His-62 przekazuje proton karbonylowi Phe-61, tworząc grupę opuszczającą z wiązania peptydowego między His i Phe w reakcji eliminacji. Łańcuch boczny His-62 jest protonowany podczas fotowzbudzenia i wspomaga reakcję, oddając proton karbonylowi Phe-61 w grupie opuszczającej. Po rozszczepieniu szkieletu wiązanie wodorowe między His-62 i Phe-61 zostaje zreformowane. Kiedy His-62 zostaje zastąpiony innymi aminokwasami, EosFP traci zdolność do fotokonwersji, dostarczając dowodów na to, że His-62 jest niezbędnym elementem mechanizmu fotokonwersji. Wewnętrzny rozkład ładunku zielonego chromoforu zmienia się podczas fotowzbudzania, aby wspomóc reakcję eliminacji.
Spektroskopia
wzbudzenia fluorescencji , jak i emisji EosFP typu dzikiego są przesunięte o ~ 65 nm w prawo po wzbudzeniu w kierunku czerwonego końca widma. Ta zmiana widmowa jest spowodowana rozszerzeniem chromoforu, któremu towarzyszy przerwa w szkielecie peptydowym między Phe-61 i His-62 w nieodwracalnym mechanizmie. Obecność wyraźnego punktu izobestycznego przy 432 nm również sugeruje wzajemną konwersję między dwoma gatunkami. Pik absorpcji przy 280 nm jest widoczny dzięki aromatycznym aminokwasom , które przekazują swoją energię wzbudzenia zielonemu chromoforowi. Wydajność kwantowa emitującej zieleń formy Eos wynosi 0,7. W formach przesuniętych ku czerwieni występują wyraźne wibroniczne pasma boczne oddzielone od głównego piku przy 533 nm i 629 nm odpowiednio w widmie wzbudzenia i widmie emisji. Istnieje inny pik w czerwonym widmie wzbudzenia przy 502 nm, prawdopodobnie z powodu wzbudzenia FRET czerwonego fluoroforu. Wydajność kwantowa formy emitującej czerwień wynosi 0,55.
Warianty EosFPs nie wykazują prawie żadnej różnicy we właściwościach spektroskopowych, dlatego jest prawdopodobne, że modyfikacje strukturalne wynikające z rozdzielenia interfejsów mają niewielki lub żaden wpływ na strukturę miejsca wiązania fluoroforu.
Aplikacje
Śledzenie białek fuzyjnych
Stworzono wiele różnych białek fuzyjnych przy użyciu EosFP i jego zmodyfikowanych wariantów. Te białka fuzyjne umożliwiają śledzenie białek w żywych komórkach przy jednoczesnym zachowaniu złożonych funkcji biologicznych, takich jak interakcje białko-białko i interakcje białko-DNA. Konstrukty fuzyjne Eos obejmują te z rekombinowanym białkiem wiążącym sygnał (RBP) i cytokeratyną . Badania wykazały, że korzystne jest przyłączenie białka będącego przedmiotem zainteresowania do N-końcowej strony znacznika EosFP. Te konstrukty fuzyjne zostały wykorzystane do wizualizacji translokacji jądrowej za pomocą receptorów androgenowych , dynamiki cytoszkieletu za pomocą aktyny i winkuliny oraz ruchu białek wewnątrzjądrowych za pomocą RBP.
Etykietowanie wielokolorowe
Ponieważ EosFP może być stosowany w konstruktach fuzyjnych przy zachowaniu funkcjonalności białka będącego przedmiotem zainteresowania, jest popularnym wyborem do badań znakowania wielokolorowego. W dwukolorowym eksperymencie znakowania w celu mapowania etapów mitozy komórki HEK293 najpierw stabilnie transfekowano cDNA białka wiążącego tubulinę połączonym z EGFP w celu wizualizacji aparatu wrzeciona . Następnie przejściową transfekcję białka wiążącego sygnał rekombinacji (RBP) połączonego z d2EosFP zastosowano do wizualizacji początku mitozy. Fotokonwersja została zakończona za pomocą mikroskopii fluorescencyjnej i uwidoczniła rozdział między dwoma zestawami chromosomów podczas anafazy , telofazy i cytokinezy .
Śledzenie ruchu komórek w biologii rozwojowej
EosFP został wykorzystany do śledzenia ruchów komórek podczas rozwoju embrionalnego Xenopus laevis. Na etapie dwukomórkowym / wczesnej gastruli mRNA z czapeczką kodujący dimeryczny EosFP (d2EosFP) wstrzyknięto do komórek i lokalnie poddano fotokonwersji przy użyciu mikroskopii fluorescencyjnej. Te fluorescencyjne zarodki wykazały dynamikę ruchu komórek podczas neurulacji. EosFP znaleziono w części struny grzbietowej , co pokazuje możliwość wykorzystania EosFP w eksperymentach związanych z mapowaniem losu .
Warianty inżynierskie
mEos4
Opracowano wiele nowych monomerycznych wersji EosFP, które oferują przewagę nad EosFP typu dzikiego. Opracowany przez zespół z Janelia Farm Research Campus w Howard Hughes Medical Institute, mEos4 ma wyższą fotostabilność i dłuższe możliwości obrazowania niż EosFP. Jest również wysoce odporny na chemiczne utrwalacze, takie jak PFA, aldehyd glutarowy i OsO4 , które są używane do konserwacji próbek. mEos4 jest skuteczny w wyższych temperaturach niż EosFP, fotokonwertuje ze zwiększoną szybkością i ma wyższą amplitudę emisji zarówno w stanach zielonej, jak i czerwonej fluorescencji. Zastosowania białka mEos4 obejmują mikroskopię lokalizacji fotoaktywacji (PALM), korelacyjną mikroskopię świetlno-elektronową (CLEM), oznaczanie aktywności białka i integrację aktywności (obrazowanie post-hoc dla aktywności białka w czasie).
mEos2
mEosFP to kolejny monomeryczny wariant Eosa, który skutecznie składa się w temperaturze 37 stopni Celsjusza. Tam, gdzie tdEos (dimer tandemowy) nie może łączyć się z celami, takimi jak histony , tubulina , włókna pośrednie i połączenia szczelinowe oraz mEos (monomeryczny), którego można z powodzeniem używać tylko w 30 stopniach Celsjusza, mEos2 jest zmodyfikowanym wariantem, który może skutecznie zwijać się w 37 stopniach Celsjusza i skutecznie oznaczają cele nietolerujące fuzji z innymi dimerami białek fluorescencyjnych. mEos2 wykazuje prawie identyczne właściwości widmowe, jasność, pKa, fotokonwersję, kontrast i właściwości dojrzewania jak WT Eos. Precyzja lokalizacji mEos2 jest dwukrotnie większa niż innych monomerycznych białek fluorescencyjnych.
CAMPARI
Również w kampusie badawczym Janelia opracowano nowe cząsteczki fluorescencyjne znane jako CaMPARI (modulowany wapniem fotoaktywowany integrator ratiometryczny) przy użyciu EosFP. Trwały sygnał konwersji z zielonego na czerwony był sprzężony z białkiem wrażliwym na wapń, kalmoduliną , tak że zmiana koloru w konstrukcie fuzyjnym zależała od uwalniania wapnia, któremu towarzyszyła aktywność neuronów . CaMPARI jest w stanie trwale oznaczyć neurony , które są aktywne w dowolnym momencie, a także może być nakierowane na synapsy . Ta wizualizacja jest możliwa na dużej ilości tkanki mózgowej, w przeciwieństwie do ograniczonego widoku dostępnego przy użyciu mikroskopu. Pozwala również na wizualizację aktywności neuronów podczas skomplikowanych zachowań, ponieważ badany organizm może poruszać się swobodnie, a nie pod mikroskopem. Pozwala także na obserwację neuronów w określonych okresach zachowania. Do tej pory CaMPARI był używany do oznaczania aktywnych obwodów neuronalnych u myszy , danio pręgowanego i muszek owocowych .