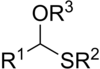
tioacetal
W chemii siarkoorganicznej tioacetale są siarkowymi ( tio- ) analogami acetali ( R-CH(-OR) . 2 ) Istnieją dwie klasy: mniej powszechne monotioacetale o wzorze R-CH(-OR')-SR" i ditioacetale o wzorze R-CH(-SR') 2 (symetryczne ditioacetale) lub R-CH (-SR')-SR” (asymetryczne ditioacetale).
Symetryczne ditioacetale są stosunkowo powszechne. Otrzymuje się je przez kondensację tioli ( −SH ) lub ditioli (dwie grupy −SH ) z aldehydami ( −CH=O ) . Reakcje te przebiegają za pośrednictwem hemitioacetali ( R -CH(-OH)-SR' ) :
- Dodanie tiolu w celu uzyskania hemitioacetalu:
- Dodatek tiolu z utratą wody z wytworzeniem ditioacetalu:
W takich reakcjach zazwyczaj jako katalizator stosuje się kwas Lewisa lub kwas Brønsteda .
Ditioacetale wytworzone z aldehydów i 1,2-etanoditiolu lub 1,3-propanoditiolu są szczególnie powszechne w tej klasie cząsteczek do stosowania w syntezie organicznej .
Węgiel karbonylowy aldehydu jest elektrofilowy i dlatego jest podatny na atak nukleofilów , podczas gdy analogiczny centralny węgiel ditioacetalu nie jest elektrofilowy. W rezultacie ditioacetale mogą służyć jako grupy ochronne dla aldehydów.
Daleki od bycia niereaktywnym iw reakcji innej niż aldehydy, węgiel ten można zdeprotonować , aby uczynić go nukleofilowym:
Odwrócenie biegunowości między R'(H)C δ+ =O δ− i R'CLi(SR) 2 jest określane jako umpolung . Reakcję zwykle przeprowadza się przy użyciu 1,3-ditianu . Litowany związek pośredni można wykorzystać do różnych reakcji tworzenia wiązań nukleofilowych, a następnie ditioketal hydrolizuje z powrotem do postaci karbonylowej. Ten ogólny proces, reakcja Coreya-Seebacha , daje syntetyczny odpowiednik anionu acylowego.
Zobacz też
- ^ IUPAC , Kompendium terminologii chemicznej , wyd. („Złota księga”) (1997). Wersja poprawiona online: (2006–) „ tioacetale ”. doi : 10.1351/goldbook.T06348
- ^ P. Stütz i PA Stadler „3-alkilowane i 3-acylowane indole ze wspólnego prekursora: 3-benzylindol i 3-benzoiloindol” Org. Syntezator. 1977, 56, 8. doi : 10.15227/orgsyn.056.0008