utlenianie Jonesa
| utlenianie Jonesa | |
|---|---|
| Nazwany po | Ewarta Jonesa |
| Typ reakcji | Organiczna reakcja redoks |
| Identyfikatory | |
| Portal Chemii Organicznej | |
| Identyfikator ontologii RSC | |
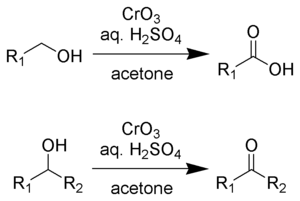
Utlenianie Jonesa to organiczna reakcja utleniania pierwszorzędowych i drugorzędowych alkoholi odpowiednio do kwasów karboksylowych i ketonów . Jej nazwa pochodzi od nazwiska jej odkrywcy, Sir Ewarta Jonesa . Reakcja była wczesną metodą utleniania alkoholi. Jego stosowanie opadło, ponieważ opracowano łagodniejsze, bardziej selektywne odczynniki, np. odczynnik Collinsa .
Odczynnik Jonesa jest roztworem przygotowanym przez rozpuszczenie trójtlenku chromu w wodnym roztworze kwasu siarkowego . Aby przeprowadzić utlenianie Jonesa, tę kwaśną mieszaninę dodaje się następnie do acetonowego roztworu substratu. Alternatywnie zamiast trójtlenku chromu można zastosować dwuchromian potasu . Utlenianie jest bardzo szybkie i dość egzotermiczne . Wydajność jest zwykle wysoka. Odczynnik jest wygodny i tani. Jednak związki Cr(VI) są rakotwórcze, co zniechęca do stosowania tej metodologii.
Stechiometria i mechanizm
Odczynnik Jonesa przekształci alkohole pierwszorzędowe i drugorzędowe odpowiednio w aldehydy i ketony. W zależności od warunków reakcji aldehydy można następnie przekształcić w kwasy karboksylowe. W przypadku utleniania do aldehydów i ketonów dwa równoważniki kwasu chromowego utleniają trzy równoważniki alkoholu:
- 2 HCrO 4 − + 3 RR'C(OH)H + 8 H + + 4 H 2O → 2 [Cr(H 2O ) 6 ] 3+ + 3 RR'CO
W celu utlenienia pierwszorzędowych alkoholi do kwasów karboksylowych 4 równoważniki kwasu chromowego utleniają 3 równoważniki alkoholu. Aldehyd jest związkiem pośrednim.
- 4 HCrO 4 − + 3 RCH 2 OH + 16 H + + 11 H 2 O → 4 [Cr(H 2 O) 6 ] 3+ + 3 RCOOH
Produkty nieorganiczne są zielone, charakterystyczne dla wodnych kompleksów chromu (III) .
Podobnie jak wiele innych reakcji utleniania alkoholi przez tlenki metali, reakcja przebiega poprzez tworzenie mieszanych estrów chromianowych : Estry te mają wzór CrO 3 (OCH 2 R) −
- CrO 3 (OH) − + RCH 2 OH → CrO 3 (OCH 2 R) − + H 2 O
Podobnie jak w przypadku konwencjonalnych estrów, tworzenie tego estru chromianowego jest przyspieszane przez kwas. Te estry można wydzielić, gdy alkohol jest trzeciorzędowy, ponieważ brakuje im α , który zostałby utracony, tworząc karbonyl. Na przykład za pomocą alkoholu tert -butylowego można wyizolować chromian tert -butylowy ((CH 3 ) 3 CO) 2 CrO 2 , który sam w sobie jest dobrym utleniaczem.
W przypadku struktur z wodorem alfa względem tlenu estry chromianowe ulegają degradacji, uwalniając produkt karbonylowy i źle zdefiniowany produkt Cr (IV):
- CrO 3 (OCH 2 R) − → CrO 2 OH − + O=CHR
Deuterowane alkohole HOCD 2 R utleniają się około sześć razy wolniej niż pochodne niedeuterowane. Ten duży kinetyczny efekt izotopowy pokazuje, że wiązanie C – H (lub C – D) pęka w etapie determinującym szybkość .
Stechiometria reakcji implikuje formy Cr(IV) „CrO 2 OH - ”, które proporcjonalnie do kwasu chromowego dają tlenek Cr(V), który działa również jako utleniacz alkoholu.
Proponuje się, że utlenianie aldehydów przebiega poprzez tworzenie półacetalopodobnych związków pośrednich, które powstają w wyniku dodania wiązania O 3 CrO-H − w poprzek wiązania C=O.
Odczynnik rzadko utlenia wiązania nienasycone.
Przykładowe reakcje i zastosowania
Pozostaje przydatny w syntezie organicznej . Do monitorowania postępu reakcji utleniania Jonesa można zastosować różnorodne techniki spektroskopowe, w tym spektroskopię w podczerwieni . Kiedyś w alkomatach stosowano utlenianie Jonesa .
Powiązane procesy
Głównymi odczynnikami są odczynnik Collinsa, PDC i PCC. Odczynniki te stanowią ulepszenia w porównaniu z nieorganicznymi odczynnikami zawierającymi chrom (VI), takimi jak odczynnik Jonesa .
odniesienia historyczne
- Bowden, K.; Heilbron, IM; Jones, ER H (1946). "13. Badania związków acetylenowych. Część I. Otrzymywanie ketonów acetylenowych przez utlenianie karbinoli i glikoli acetylenowych". J. Chem. soc. : 39. doi : 10.1039/jr9460000039 .
- Heilbron, IM; Jones, ERH; Sondheimer, F (1949). „129. Badania związków acetylenowych. Część XV. Utlenianie pierwszorzędowych karbinoli i glikoli acetylenowych”. J. Chem. soc. : 604. doi : 10.1039/jr9490000604 .
- Bladen, P; Fabian, Joyce M.; Henbest, HB; Kocha, HP; Drewno, Geoffrey W. (1951). „532. Badania w grupie steroli. Część LII. Absorpcja w podczerwieni jądrowych trój- i tetra-podstawionych centrów etylenowych”. J. Chem. soc. : 2402. doi : 10.1039/jr9510002402 .
- Jones, ER H (1953). „92. Chemia triterpenów. Część XIII. Dalsza charakterystyka kwasu poliporenowego A”. J. Chem. soc. : 457. doi : 10.1039/jr9530000457 .
- Jones, ER H (1953). „520. Chemia triterpenów i związków pokrewnych. Część XVIII. Wyjaśnienie struktury kwasu poliporenowego C”. J. Chem. soc. : 2548. doi : 10.1039/jr9530002548 .
- Jones, ER H (1953). „599. Chemia triterpenów i związków pokrewnych. Część XIX. Dalsze dowody dotyczące struktury kwasu poliporenowego A”. J. Chem. soc. : 3019. doi : 10.1039/jr9530003019 .
- C. Djerassi , R. Engle i A. Bowers (1956). „Uwagi - bezpośrednia konwersja steroidowych Δ5-3β-alkoholi do Δ5- i Δ4-3-ketonów”. J.Org. chemia . 21 (12): 1547–1549. doi : 10.1021/jo01118a627 .