Dwuchromian potasu

|
|

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
Dwuchromian(VI) potasu
|
|
| Inne nazwy dwuchromian potasu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA | 100.029.005 |
| Numer WE |
|
|
Identyfikator klienta PubChem
|
|
| Numer RTECS |
|
| UNII | |
| Numer ONZ | 3288 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| K 2 Kr 2 O 7 | |
| Masa cząsteczkowa | 294,185 g/mol |
| Wygląd | czerwono-pomarańczowe krystaliczne ciało stałe |
| Zapach | bezwonny |
| Gęstość | 2,676 g/cm3 , ciało stałe |
| Temperatura topnienia | 398 ° C (748 ° F; 671 K) |
| Temperatura wrzenia | 500 ° C (932 ° F; 773 K) rozkłada się |
|
4,9 g/100 ml (0°C) 13 g/100 ml (20°C) 102 g/100 ml (100°C) |
|
| Rozpuszczalność | nierozpuszczalny w alkoholu , acetonie . |
|
Współczynnik załamania światła ( n D )
|
1.738 |
| Struktura | |
| Trójkliniczny (forma α, <241,6 ° C) | |
| Czworościenny (dla Cr) | |
| Termochemia | |
|
Pojemność cieplna ( C )
|
219 J/mol |
|
Standardowa entropia molowa ( S ⦵ 298 ) |
291,2 J/(K·mol) |
|
Standardowa entalpia formowania (Δ f H ⦵ 298 ) |
−2033 kJ/mol |
| Zagrożenia | |
| Bezpieczeństwo i higiena pracy (BHP): | |
|
Główne zagrożenia
|
rakotwórcze, żrące |
| Oznakowanie GHS : | |
    
|
|
| NFPA 704 (ognisty diament) | |
| Punkt zapłonu | Nie palne |
| Śmiertelna dawka lub stężenie (LD, LC): | |
|
LD 50 ( mediana dawki )
|
25 mg/kg (doustnie, szczur) |
| Karta charakterystyki (SDS) | ICSC 1371 |
| Związki pokrewne | |
|
Inne aniony
|
Chromian potasu Molibdenian potasu Wolframian potasu |
|
Inne kationy
|
Dwuchromian amonu Dwuchromian sodu |
|
Związki pokrewne
|
Nadmanganian potasu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Dwuchromian potasu , K 2 Cr 2 O 7 , jest powszechnym nieorganicznym odczynnikiem chemicznym, najczęściej używanym jako środek utleniający w różnych zastosowaniach laboratoryjnych i przemysłowych. Podobnie jak w przypadku wszystkich chromu sześciowartościowego , jest on ostro i przewlekle szkodliwy dla zdrowia. Jest to krystaliczne jonowe ciało stałe o bardzo jasnym, czerwono-pomarańczowym kolorze. Sól jest popularna w laboratoriach, ponieważ nie rozpływa się , w przeciwieństwie do soli dwuchromianu sodu, która ma większe znaczenie w przemyśle .
Chemia
Produkcja
Dwuchromian potasu jest zwykle wytwarzany w reakcji chlorku potasu z dwuchromianem sodu . Alternatywnie można go również otrzymać z chromianu potasu przez prażenie rudy chromitu z wodorotlenkiem potasu . Jest rozpuszczalny w wodzie i w procesie rozpuszczania jonizuje:
- K 2 Cr 2 O 7 → 2 K + + Cr
2 O
2− 7 -
Cr
2 O
2− 7 + H 2 O ⇌ 2 CrO
2− 4 + 2 H +
Reakcja
Dwuchromian potasu jest środkiem utleniającym w chemii organicznej i jest łagodniejszy niż nadmanganian potasu . Służy do utleniania alkoholi . Przekształca pierwszorzędowe alkohole w aldehydy, aw bardziej wymuszających warunkach w kwasy karboksylowe. Natomiast nadmanganian potasu ma tendencję do wytwarzania kwasów karboksylowych jako jedynych produktów. Alkohole drugorzędowe są przekształcane w ketony . Na przykład, menton można wytworzyć przez utlenianie mentolu zakwaszonym dichromianem. Alkohole trzeciorzędowe nie ulegają utlenieniu.
W roztworze wodnym wykazana zmiana koloru może być wykorzystana do testu na odróżnienie aldehydów od ketonów. Aldehydy redukują dichromiany ze stopnia utlenienia +6 do +3 , zmieniając kolor z pomarańczowego na zielony. Ta zmiana koloru powstaje, ponieważ aldehyd może zostać utleniony do odpowiedniego kwasu karboksylowego. Keton nie wykaże takiej zmiany, ponieważ nie można go dalej utleniać, więc roztwór pozostanie pomarańczowy.
Po silnym podgrzaniu rozkłada się wraz z wydzielaniem tlenu.
Gdy do pomarańczowo-czerwonego roztworu zawierającego jony dwuchromianowe dodaje się zasadę , otrzymuje się żółty roztwór w wyniku tworzenia jonów chromianowych ( CrO 2− 4 ). Na przykład chromian potasu jest produkowany przemysłowo przy użyciu potażu :
- K 2 Cr 2 O 7 + K 2 CO 3 → 2 K 2 CrO 4 + CO 2
Reakcja jest odwracalna.
Traktowanie zimnym kwasem siarkowym daje czerwone kryształy bezwodnika chromowego (trójtlenek chromu, CrO 3 ):
- K 2 Cr 2 O 7 + 2 H 2 SO 4 → 2 CrO 3 + 2 KHSO 4 + H 2 O
Podczas ogrzewania stężonym kwasem wydziela się tlen:
- 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 → 2 K 2 SO 4 + 2 Cr 2 (SO 4 ) 3 + 8 H 2 O + 3 O 2
Używa
Dwuchromian potasu ma kilka głównych zastosowań, ponieważ w przemyśle dominuje sól sodowa. Główne zastosowanie to prekursor ałunu potasowo-chromowego , stosowanego w garbarstwie skór .
Czyszczenie
Podobnie jak inne związki chromu (VI) ( trójtlenek chromu , dichromian sodu ), dichromian potasu był używany do przygotowania „ kwasu chromowego ” do czyszczenia szkła i materiałów do trawienia. Ze względów bezpieczeństwa związanych z sześciowartościowym chromem praktyka ta została w dużej mierze zaniechana.
Budowa
Stosowany jest jako składnik cementu , w którym opóźnia wiązanie mieszanki oraz poprawia jej gęstość i teksturę. To użycie często powoduje kontaktowe zapalenie skóry u pracowników budowlanych .
Fotografia i druk
W 1839 roku Mungo Ponton odkrył, że papier potraktowany roztworem dichromianu potasu był wyraźnie garbowany pod wpływem światła słonecznego, a przebarwienia pozostały po wypłukaniu dichromianu potasu. W 1852 roku Henry Fox Talbot odkrył, że ekspozycja na światło ultrafioletowe w obecności dichromianu potasu utwardza koloidy organiczne , takie jak żelatyna i guma arabska , czyniąc je mniej rozpuszczalnymi.
Odkrycia te wkrótce doprowadziły do druku węglowego , dwuchromianu gumy i innych procesów drukowania fotograficznego opartych na utwardzaniu różnicowym. Zazwyczaj po ekspozycji nieutwardzona część była spłukiwana ciepłą wodą, pozostawiając cienki relief, który albo zawierał pigment zawarty podczas produkcji, albo był następnie zabarwiony barwnikiem. Niektóre procesy zależały tylko od utwardzania w połączeniu z różnym wchłanianiem niektórych barwników przez obszary utwardzone lub nieutwardzone. Ponieważ niektóre z tych procesów pozwoliły na zastosowanie wysoce stabilnych barwników i pigmentów, takich jak sadza , można by wyprodukować odbitki o wyjątkowo wysokim stopniu trwałości archiwalnej i odporności na blaknięcie w wyniku długotrwałej ekspozycji na światło.
Koloidy dichromowane były również wykorzystywane jako fotomaski w różnych zastosowaniach przemysłowych, najczęściej do tworzenia metalowych płyt drukarskich do stosowania w fotomechanicznych procesach drukowania.
Intensyfikacja chromu lub Photochromos wykorzystuje dichromian potasu wraz z równymi częściami stężonego kwasu chlorowodorowego rozcieńczonego do około 10% v/v do obróbki słabych i cienkich negatywów czarno-białej rolki fotograficznej. To rozwiązanie ponownie przekształca cząsteczki pierwiastkowego srebra w filmie w chlorek srebra . Po dokładnym umyciu i wystawieniu na działanie aktynicznego film można ponownie wywołać do punktu końcowego, uzyskując mocniejszy negatyw, który jest w stanie uzyskać bardziej zadowalający wydruk.
Roztwór dichromianu potasu w kwasie siarkowym może być użyty do wytworzenia odwróconego negatywu (to znaczy dodatniej przezroczystości z filmu negatywowego). Odbywa się to poprzez wywołanie czarno-białego filmu, ale pozwolenie na wywołanie przebiega mniej więcej do punktu końcowego. Rozwój jest następnie zatrzymywany przez obfite przemywanie, a następnie powłoka jest traktowana kwaśnym roztworem dichromianu. To przekształca srebrny metal w siarczan srebra , związek niewrażliwy na światło. Po dokładnym umyciu i wystawieniu na działanie światła aktynicznego film jest ponownie wywoływany, co pozwala na zredukowanie wcześniej nienaświetlonego halogenku srebra do srebrnego metalu. Uzyskane wyniki mogą być nieprzewidywalne, ale czasami uzyskuje się doskonałe wyniki, tworząc obrazy, które w przeciwnym razie byłyby nieosiągalne. Proces ten można połączyć z solaryzacją , aby produkt końcowy przypominał negatyw i nadawał się do druku w zwykły sposób.
Cr(VI) mają właściwość garbowania białek zwierzęcych pod wpływem silnego światła. Ta jakość jest używana w sitodruku fotograficznym .
W sitodruku cienki ekran ze skręcanego jedwabiu lub podobnego materiału jest napinany na ramie, podobnie jak płótno jest przygotowywane przed malowaniem. Koloid dichromianem nakłada się równomiernie na naprężony ekran. Gdy mieszanina dichromianów wyschnie, pełnowymiarowy pozytyw fotograficzny jest bezpiecznie przymocowany do powierzchni ekranu, a cały zespół wystawiony na działanie silnego światła - czas waha się od 3 minut do pół godziny w jasnym świetle słonecznym - utwardzanie odsłoniętego koloidu . Po usunięciu pozytywu nienaświetloną mieszaninę na ekranie można zmyć ciepłą wodą, pozostawiając utwardzoną mieszaninę w stanie nienaruszonym, działając jak precyzyjna maska pożądanego wzoru, który można następnie wydrukować zwykłą sitodruku .
Odczynnik analityczny
Ponieważ nie jest higroskopijny, dichromian potasu jest powszechnym odczynnikiem w klasycznych „testach na mokro” w chemii analitycznej.
Oznaczanie etanolu
Stężenie etanolu w próbce można określić przez miareczkowanie wsteczne zakwaszonym dichromianem potasu. Reakcja próbki z nadmiarem dichromianu potasu, cały etanol jest utleniany do kwasu octowego :
- CH3CH2OH + 2 [O ] → CH3COOH + H2O
Pełna reakcja konwersji etanolu do kwasu octowego:
- 3 C 2 H 5 OH + 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 → 3 CH 3 COOH + 2 Cr 2 (SO 4 ) 3 + 2 K 2 SO 4 + 11 H 2 O
Nadmiar dichromianu określa się przez miareczkowanie tiosiarczanem sodu . Dodanie ilości nadmiaru dichromianu z początkowej ilości daje ilość obecnego etanolu. Dokładność można poprawić, kalibrując dichromianu względem ślepej próby.
Jednym z głównych zastosowań tej reakcji są stare policyjne testy alkomatem . Kiedy opary alkoholu stykają się z kryształami pokrytymi pomarańczowym dichromianem, kolor zmienia się z pomarańczowego Cr(VI) na zielony Cr(III). Stopień zmiany koloru jest bezpośrednio związany z poziomem alkoholu w oddechu podejrzanego.
Próba srebra
Rozpuszczony w około 35% roztworze kwasu azotowego nazywany jest roztworem Schwertera i służy do testowania obecności różnych metali, zwłaszcza do oznaczania czystości srebra. Czyste srebro sprawi, że roztwór stanie się jaskrawoczerwony, srebro próby 925 zmieni jego kolor na ciemnoczerwony, słabe srebro monetarne (0,800) zmieni kolor na brązowy (głównie z powodu obecności miedzi, która zabarwia roztwór na brązowo), a nawet na zielono za 0,500 srebra. Mosiądz staje się ciemnobrązowy, miedź brązowieje, ołów i cyna żółkną, podczas gdy złoto i pallad nie zmieniają koloru.
Test dwutlenku siarki
Papier dichromianu potasu może być używany do testowania dwutlenku siarki , ponieważ wyraźnie zmienia kolor z pomarańczowego na zielony. Jest to typowe dla wszystkich reakcji redoks, w których sześciowartościowy chrom jest redukowany do trójwartościowego chromu. Dlatego nie jest to rozstrzygający test na obecność dwutlenku siarki. Końcowym utworzonym produktem jest Cr 2 (SO 4 ) 3 .
Obróbka drewna
Dwuchromian potasu służy do barwienia niektórych rodzajów drewna poprzez przyciemnianie garbników w drewnie. Daje głębokie, bogate brązy, których nie można uzyskać za pomocą nowoczesnych barwników. Jest to szczególnie skuteczny zabieg na mahoniu .
Występowanie naturalne
Dwuchromian potasu występuje naturalnie jako rzadki mineralny lopezyt . Donoszono o nim jedynie jako vug w złożach azotanów na pustyni Atakama w Chile oraz w kompleksie magmowym Bushveld w Afryce Południowej .
Bezpieczeństwo
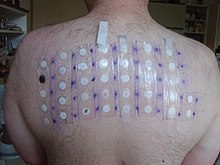
W latach 2005–2006 dichromian potasu był 11. najczęściej występującym alergenem w testach płatkowych (4,8%).
Dwuchromian potasu jest jedną z najczęstszych przyczyn chromowego zapalenia skóry ; chrom z dużym prawdopodobieństwem wywoła uczulenie prowadzące do zapalenia skóry, zwłaszcza dłoni i przedramion, które jest przewlekłe i trudne do wyleczenia. Badania toksykologiczne dodatkowo zilustrowały jego wysoce toksyczny charakter. W przypadku królików i gryzoni stężenia tak niskie, jak 14 mg/kg, wykazały 50% śmiertelność wśród grup testowych. Organizmy wodne są szczególnie wrażliwe w przypadku narażenia, dlatego zaleca się odpowiedzialną utylizację zgodnie z lokalnymi przepisami dotyczącymi ochrony środowiska.
Podobnie jak inne związki Cr(VI) , dwuchromian potasu jest rakotwórczy . Związek jest również żrący , a narażenie może spowodować poważne uszkodzenie oczu lub ślepotę. Narażenie ludzi obejmuje ponadto zaburzenia płodności, dziedziczne
Linki zewnętrzne
- Dichromian potasu w układzie okresowym filmów (University of Nottingham)
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 1371
- National Pollutant Inventory – Arkusz informacyjny dotyczący chromu VI i związków
- Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych
- Monografia IARC „Chrom i związki chromu”
- Artykuł dotyczący rafinacji złota wymieniający zmianę koloru podczas testowania metali roztworem Schwertera