Nadtlenek chromu(VI).
|
|
| Nazwy | |
|---|---|
| Inne nazwy nadtlenek chromu(VI), nadtlenek chromu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
|
Identyfikator klienta PubChem
|
|
|
|
|
|
| Nieruchomości | |
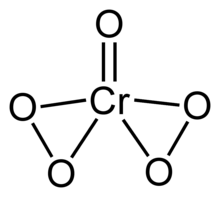
| Cr O 5 | |
| Masa cząsteczkowa | 131,991 g · mol -1 |
| rozpuszczalny (rozkłada się bez stabilizatorów) | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Nadtlenek chromu(VI) lub nadtlenek tlenku chromu jest niestabilnym związkiem o wzorze CrO 5 . Związek ten zawiera jeden ligand okso i dwa ligandy nadtlenowe, co daje w sumie pięć atomów tlenu na atom chromu.
Przygotowanie i właściwości
Nadtlenek chromu(VI) powstaje przez dodanie zakwaszonych roztworów nadtlenku wodoru do roztworów chromianów lub dichromianów metali , takich jak chromian sodu lub dichromian potasu . Ogólnie żółte chromiany lub pomarańczowe dichromiany zmieniają kolor na ciemnoniebieski w miarę tworzenia się nadtlenku chromu (VI). Chromian lub dichromian reaguje z nadtlenkiem wodoru i kwasem, dając nadtlenek chromu i wodę.
- CrO 4 2− + 2 H 2 O 2 + 2 H + → CrO 5 + 3 H 2 O
Dzięki tej metodzie nadtlenek chromu (VI) rozkłada się po kilku sekundach, zmieniając kolor na zielony, gdy tworzą się związki chromu (III).
- 2 CrO 5 + 7 H 2 O 2 + 6 H + → 2 Cr 3+ + 10 H 2 O + 7 O 2
Aby uniknąć tego rozkładu, możliwe jest stabilizowanie nadtlenku chromu (VI) w niemieszających się z wodą rozpuszczalnikach organicznych, takich jak eter dietylowy , butan-1-ol lub octan amylu , poprzez dodanie warstwy rozpuszczalnika organicznego nad roztworem chromianu/dichromianu i wstrząsając podczas dodawania nadtlenku wodoru. W ten sposób nadtlenek chromu(VI) (niestabilny w fazie wodnej, w której się nowo tworzy) rozpuszcza się w niemieszającym się rozpuszczalniku organicznym. W tym stanie można go obserwować przez znacznie dłuższy okres.
CrO 5 jest niestabilny i rozkłada się, gdy stoi, tworząc CrO 3 . Jest niekompatybilny z ketonami i pierwszorzędowymi alkoholami, ponieważ utlenia je do aldehydów i kwasów karboksylowych , sam ulegając redukcji do Cr 3+ . Dlatego CrO 5 jest dobrym utleniaczem, nawet lepszym od chromianów i dichromianów ze względu na obecność dwóch reaktywnych ligandów perokso, ale ze względu na małą stabilność nie jest stosowany w syntezach organicznych. [ potrzebne źródło ]
Pochodne

Stwierdzono, że kompleksy eteranowe, bipirydylowe i pirydylowe tego związku są skutecznymi utleniaczami w chemii organicznej. Strukturę kompleksu pirydylowego określono krystalograficznie.
Galeria
Zobacz też
- Tetraperoxochromate - podobnie zsyntetyzowany analogiczny kompleks nadtlenku chromu (V).
Linki zewnętrzne
- Szczegóły eksperymentu i zdjęcie (w języku niemieckim)
- na YouTube (8 listopada 2012). Profesor Martyn Poliakoff z University of Nottingham demonstruje syntezę na okresowych filmach wideo .


