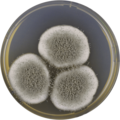
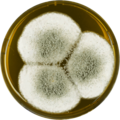
Aspergillus giganteus
| Aspergillus giganteus | |
|---|---|
| Klasyfikacja naukowa | |
| Królestwo: | Grzyby |
| Dział: | Ascomycota |
| Klasa: | Eurotiomycetes |
| Zamówienie: | Eurotiales |
| Rodzina: | Trichocomaceae |
| Rodzaj: | kropidlak |
| Gatunek: |
A. olbrzymi
|
| Nazwa dwumianowa | |
|
Aspergillus giganteus Wehmera (1901)
|
|
Aspergillus giganteus to gatunek grzyba z rodzaju Aspergillus (od łacińskiego „aspergillum”, co oznacza „zraszacz wody święconej”), który rośnie jako pleśń . Po raz pierwszy został opisany w 1901 roku przez Wehmera i jest jednym z sześciu Aspergillus z sekcji Clavati podrodzaju Fumigati . Jego najbliższymi krewnymi taksonomicznymi są Aspergillus rhizopodus (Rai i in., 1975) oraz Aspergillus longivescia (Huang i Raper, 1971).
Morfologia
Podobnie jak większość gatunków Aspergillus , A. giganteus rozmnaża się bezpłciowo i nie zaobserwowano go w stanie płciowym. Podobnie jak inne gatunki Clavati , A. giganteus wytwarza liczne konidiofory, które charakteryzują się szklistymi i półprzezroczystymi strukturami przypominającymi łodygi, zwanymi trzonami i maczugowatymi aspergillami, które zwężają się w kierunku wierzchołków. Na tych końcówkach tworzą się niebiesko-zielone bezpłciowe zarodniki zwane konidiami .
Na poziomie makroskopowym kolonie A. giganteus charakteryzują się aksamitną teksturą. Kolonie są często początkowo białe, a pod wpływem światła zmieniają kolor na bladoniebiesko-zielony.
Na poziomie mikroskopowym A. giganteus wytwarza dwa rodzaje konidioforów, które mają różne trzonki i pęcherzyki. Pierwszy z tych konidioforów ma typowo 2-3 mm wysokości, wliczając w to długość trzonu. Te krótsze konidiofory wytwarzają pęcherzyki maczugowate o długości 100-250 μm i szerokości 30-50 μm. Drugi typ konidioforów jest znacznie większy, ma około 1-5 cm długości. Większość tej długości wynika z wydłużonych trzonów. Te bardziej wydłużone konidiofory są fototropowe , co oznacza, że są w stanie rozwijać się i rosnąć tylko w obecności światła. Pęcherzyki wytwarzane przez długie konidiofory mają długość 400-600 μm i szerokość 120-180 μm, czyli ponad dwukrotnie więcej niż pęcherzyki wytwarzane przez ich krótsze odpowiedniki.
Pęcherzyk i fialidy razem tworzą główkę konidialną. U A. giganteus główki te mają kolor niebiesko-zielony i dzielą się na dwie lub więcej kolumn w miarę dojrzewania pleśni. Z tych głów konidialnych tworzą się konidia. Konidia A. giganteus są stosunkowo grubościenne i wyróżniają się gładkim, eliptycznym wyglądem oraz rozmiarem (3,5-4,5 x 2,4-3,0 μm). Cechy te są charakterystyczne dla obu rodzajów konidioforów. A. giganteus można odróżnić od innych gatunków Aspergillus umieszczonych w sekcji Clavati po mikroskopowej morfologii i unikalnej kombinacji ekstralitów, które są związkami syntetyzowanymi przez komórki, a następnie wydalanymi przez komórki w obronie przed bakteriami i innymi grzybami. Pod względem morfologicznym A. giganteus nie ma komórek stopy ryzoidalnej obecnych u A. rhizopodus i ma pęcherzyki maczugowate, które kontrastują z wydłużonymi pęcherzykami A. longivesica . Jeśli chodzi o syntezę ekstralitów, chociaż A. giganteus wytwarza mykotoksyny i antybiotyki , które są charakterystyczne dla wszystkich gatunków sekcji Clavati (takie jak patulina , tryptokwiwaliny i tryptokwiwalony oraz alfa-sarcyny), produkuje również ekstrality, których nie syntetyzują jego najbliżsi krewni. Należą do nich kilka różnych karotenoidów i klawinformina podobna do penicyliny .
Ekologia
A. giganteus występuje na całym świecie i został oficjalnie udokumentowany w Nigerii, Stanach Zjednoczonych, Egipcie, Meksyku, Panamie, Niemczech, Surinamie, Holandii i Polsce. Najczęściej jest przenoszony przez łajno , ale będzie rosnąć w glebie zasadowej i podłożach drewnianych. Jako pleśń saprotroficzna A. giganteus czerpie energię z wchłaniania składników odżywczych z podłoża, w którym rośnie. Chociaż wiele innych gatunków z sekcji Aspergillus i Clavati jest znanymi patogenami człowieka, A. giganteus nie ma żadnych doniesień o skutkach patogennych.
W laboratorium A. giganteus hodowano zarówno na płytkach z agarem z ekstraktem drożdżowym Czapek (CYA), jak iz agarem z ekstraktem słodowym Oxoid® (MEAOX), jak pokazano poniżej.
Znaczenie gospodarcze
Białko przeciwgrzybicze (AFP)
A. giganteus wytwarza białko przeciwgrzybicze (AFP), które ma potencjalne zastosowanie w zapobieganiu infekcjom grzybiczym zarówno w środowisku farmaceutycznym, jak i rolniczym. Wykazano, że AFP ogranicza wzrost wielu ważnych gospodarczo grzybów nitkowatych. Należą do nich Aspergillus fumigatus , główna przyczyna aspergilozy u ludzi, oraz inne gatunki Aspergillus ; Fusarium oxysporum i pokrewne gatunki Fusarium , powszechne patogeny roślin pomidora, fasoli, banana, melona, bawełny i ciecierzycy; Magnaporthe grisea , patogen upraw ryżu i zbóż; i Botrytis cineara , chorobotwórcze dla pelargonii i innych ważnych gospodarczo roślin ozdobnych. Dodatkowo AFP może ograniczać wzrost lęgniowca Phytopthera infestans , patogenu niesławnego powodującego zarazę ziemniaka (główną przyczynę Wielkiego Głodu w Irlandii ) i pomidorów.
Poza wysokim potencjałem powodzenia w zwalczaniu infekcji wymienionych powyżej, AFP nie hamuje żywotności komórek drożdży , bakterii , ssaków ani roślin. Ponieważ istnieje wiele gatunków grzybów nitkowatych, które nie reagują na AFP, prawdopodobne jest, że szkodliwe działanie białka jest specyficzne dla gatunku. Jako taki, AFP może być stosowany do leczenia i zapobiegania infekcjom przez bardzo specyficzne patogeny bez szkody dla pacjentów lub roślin żywicielskich. Ponadto białko można łatwo zsyntetyzować poprzez fermentację A. giganteus i jest ono odporne na słuch. W porównaniu z innymi lekami przeciwgrzybiczymi, potrzebne są niewielkie ilości białka, aby zapobiec rozwojowi szkodliwych patogenów. W połączeniu z faktem, że AFP prawie całkowicie blokuje wzrost wrażliwych, chorobotwórczych grzybów (w przeciwieństwie do stosowanych obecnie w systemach rolniczych środków przeciwgrzybiczych ozonem, nadtlenkiem wodoru i dwutlenkiem chloru), czynniki te podkreślają potencjał AFP jako taniego, masowo produkowanego i niezwykle skuteczne rozwiązanie infekcji patogenami.
Tryb działania AFP
Bogate w cysteinę amfipatyczne białko hamuje wzrost patogenów wrażliwych na AFP poprzez wiele szlaków. Po pierwsze, AFP może hamować wzrost komórek poprzez hamowanie chityny . U wrażliwych grzybów AFP aktywuje szlak integralności ściany komórkowej, zwiększając w ten sposób ekspresję genu syntazy A α-1,3-glukanu odpowiedzialnego za przebudowę ścian komórkowych i hamowanie tworzenia chityny. AFP może również zmieniać przepuszczalność błony komórkowej wrażliwych grzybów, zwłaszcza Aspergillus niger, lub powodować natychmiastowy, trwały wzrost potencjału spoczynkowego kationów wapnia w komórce, co często prowadzi do zaprogramowanej śmierci komórki. Każdy z tych szlaków ostatecznie prowadzi do śmierci patogenu wrażliwego na AFP. Chociaż potrzebne są dalsze badania, aby określić, jak te szlaki działają razem, szeroka gama trybów działania AFP podkreśla, że białko może wchodzić w interakcje z wrażliwymi patogenami na różne sposoby, że te patogeny różnią się pod względem podatności na AFP.
Wstępne badania nad zastosowaniami AFP
We wstępnych badaniach nad farmaceutycznymi i rolniczymi zastosowaniami AFP naukowcy wykorzystali AFP do powstrzymania wzrostu gatunków Phytopthera infestans i Aspergillus w kulturach. Dzięki aplikacji roztworów AFP na liście i korzenie roślin wyeliminowano infekcje Botrytis cineara u roślin pelargonii i Magnaporthe grisea u roślin ryżu. W każdym z tych przypadków AFP powodował deformacje w strzępkach wrażliwych grzybów, powodując zmniejszenie wydłużenia strzępek i niezdolność patogenu do wzrostu. Oprócz bezpośredniego zastosowania w strukturach roślin, gen kodujący AFP można edytować w genomach roślin dotkniętych grzybami wrażliwymi na AFP, tak aby rośliny były w stanie samodzielnie syntetyzować białko. Technika ta została z powodzeniem zastosowana w celu zmniejszenia infekcji przez Puccinia substriata , główną przyczynę choroby rdzy, i Sclerospora graminicola , czynnik sprawczy mączniaka rzekomego, w roślinach prosa perłowego, jak również infekcji przez Magnaporthe grisea w roślinach ryżu. Chociaż ulepszenia genetyczne zatrzymały infekcję w warunkach laboratoryjnych i szklarniowych, naukowcy nadal debatują na temat skalowalności edycji genomu roślin i zdolności samych roślin do syntezy wystarczającej ilości AFP do zwalczania infekcji patogenami w terenie.