Białka Notch
| Domena Notch (LNR) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura prototypowego modułu LNR z ludzkich Notch 1
| |||||||||
| identyfikatorów | |||||||||
| Symbol | Karb | ||||||||
| Pfam | PF00066 | ||||||||
| InterPro | IPR000800 | ||||||||
| MĄDRY | SM00004 | ||||||||
| PROZYTA | PS50258 | ||||||||
| Nadrodzina OPM | 462 | ||||||||
| Białko OPM | 5kzo | ||||||||
| Błona | 19 | ||||||||
| |||||||||
Białka Notch to rodzina białek transbłonowych typu 1 , które tworzą główny składnik szlaku sygnałowego Notch , który jest wysoce konserwatywny u metazoanów . Domena zewnątrzkomórkowa Notch pośredniczy w interakcjach z ligandami z rodziny DSL , umożliwiając jej udział w sygnalizacji obok takkryny . Domena wewnątrzkomórkowa Notch działa jako aktywator transkrypcji , gdy jest w kompleksie z czynnikami transkrypcyjnymi rodziny CSL . Członkowie tej rodziny białek transbłonowych typu 1 mają kilka wspólnych struktur rdzeniowych, w tym domenę zewnątrzkomórkową składającą się z wielu naskórkowego czynnika wzrostu (EGF) i domenę aktywacji transkrypcji domeny wewnątrzkomórkowej (TAD). Członkowie rodziny Notch działają w wielu różnych tkankach i odgrywają rolę w różnych procesach rozwojowych poprzez kontrolowanie dotyczących losu komórki . Wiele z tego, co wiadomo na temat funkcji Notch, pochodzi z badań przeprowadzonych na Caenorhabditis elegans ( C.elegans ) i Drosophila melanogaster . Zidentyfikowano również ludzkie homologi, ale szczegóły funkcji Notch i interakcji z jego ligandami nie są dobrze znane w tym kontekście.
Odkrycie
Notch został odkryty w mutancie Drosophila w marcu 1913 roku w laboratorium Thomasa Hunta Morgana . Ten mutant pojawił się po kilku pokoleniach krzyżowania skrzydlatych much z paciorkami z muchami typu dzikiego i został po raz pierwszy scharakteryzowany przez Johna S. Dextera. Najczęściej obserwowanym fenotypem mutantów Notch jest pojawienie się wklęsłego ząbkowania na najbardziej dystalnym końcu skrzydeł, od którego pochodzi nazwa genu, któremu towarzyszy brak włosia brzeżnego. Stwierdzono, że ten mutant jest sprzężony z płcią dominujący na chromosomie X można to było zaobserwować tylko u heterozygotycznych samic, ponieważ było śmiertelne u samców i homozygotycznych samic. Pierwszy allel Notch został ustanowiony w 1917 roku przez CW Metza i CB Bridgesa. Pod koniec lat trzydziestych XX wieku badania embriogenezy much przeprowadzone przez Donalda F. Poulsona dostarczyły pierwszej wskazówki na temat roli Notcha w rozwoju. Samce z mutacją Notch-8 wykazywały brak wewnętrznych listków zarodkowych , endodermy i mezodermy , co skutkowało niepowodzeniem późniejszej morfogenezy , śmiertelności embrionów. Późniejsze badania nad wczesną Drosophila neurogeneza dostarczyła niektórych z pierwszych oznak roli Notcha w sygnalizacji komórka-komórka, ponieważ układ nerwowy mutantów Notch został opracowany przez poświęcenie komórek podskórnych.
Począwszy od lat 80. XX wieku naukowcy zaczęli zdobywać dalsze informacje na temat funkcji Notch poprzez eksperymenty genetyczne i molekularne. Badania genetyczne przeprowadzone na Drosophila doprowadziły do identyfikacji kilku białek, które odgrywają kluczową rolę w sygnalizacji Notch, w tym Enhancer of split, Master mind, Delta, Suppressor of Hairless (CSL) i Serrate. W tym samym czasie gen Notch został pomyślnie zsekwencjonowany i sklonowany, co dało wgląd w architekturę molekularną białek Notch i doprowadziło do identyfikacji homologów Notch w Caenorhabditis elegans ( C. elegans ) i ostatecznie u ssaków .
Na początku lat 90. XX wieku Notch był coraz częściej postrzegany jako receptor nieznanego wcześniej szlaku sygnałowego międzykomórkowego, w którym domena międzykomórkowa Notch (NICD) jest transportowana do jądra, gdzie działa jako czynnik transkrypcyjny bezpośrednio regulujący geny docelowe. Stwierdzono, że uwalnianie NICD następuje w wyniku proteolitycznego rozszczepienia białka transbłonowego w wyniku działania podjednostki katalitycznej kompleksu γ-sekretazy, preseniliny . Była to znacząca interakcja, ponieważ presenilina bierze udział w rozwoju choroby Alzheimera. Te i dalsze badania nad mechanizmem sygnalizacji Notch doprowadziły do badań, które dodatkowo połączyły Notch z szeroką gamą ludzkich chorób.
Struktura
Drosophila zawierają pojedyncze białko Notch , C. elegans zawiera dwa zbędne paralogi wycięcia, Lin-12 i GLP-1, a ludzie mają cztery warianty wycięcia, wycięcie 1-4. Chociaż istnieją różnice między homologami, istnieje zestaw wysoce konserwatywnych struktur występujących we wszystkich białkach rodziny Notch. Białko można zasadniczo podzielić na domenę zewnątrzkomórkową Notch (NECD) i domenę wewnątrzkomórkową Notch (NICD) połączone ze sobą jednoprzebiegową domeną transbłonową (TM).
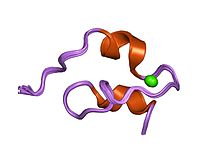
NECD zawiera 36 powtórzeń EGF u Drosophila , 28-36 u ludzi oraz odpowiednio 13 i 10 u C. elegans Lin-12 i GLP-1. Te powtórzenia są silnie modyfikowane przez O-glikozylację i wykazano, że dodanie określonych O-glikanów jest niezbędne do prawidłowego funkcjonowania. Po powtórzeniach EGF następują trzy cysteinę powtórzenia Lin-12/Notch (LNR) i domena heterodimeryzacji (HD). Razem LNR i HD tworzą negatywny region regulatorowy przylegający do błony komórkowej i pomagają zapobiegać sygnalizacji przy braku wiązania ligandu.
NICD działa jako czynnik transkrypcyjny, który jest uwalniany po tym, jak wiązanie liganda powoduje jego rozszczepienie. Zawiera sekwencję lokalizacji jądrowej (NLS), która pośredniczy w jej translokacji do jądra , gdzie tworzy kompleks transkrypcyjny wraz z kilkoma innymi czynnikami transkrypcyjnymi. W jądrze kilka powtórzeń ankiryny i interakcje domeny RAM między białkami NICD i CSL tworzą transkrypcyjny kompleks aktywacyjny. U ludzi dodatkowa domena PEST odgrywa rolę w degradacji NICD.
Funkcjonować
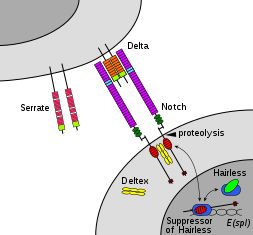
Członkowie rodziny Notch odgrywają rolę w różnych procesach rozwojowych, kontrolując decyzje dotyczące losu komórki. Sieć sygnalizacyjna Notch jest zachowaną ewolucyjnie międzykomórkową ścieżką sygnalizacyjną , która reguluje interakcje między fizycznie sąsiadującymi komórkami. U Drosophila interakcja karbów z ligandami związanymi z komórkami (delta, serrate) ustanawia międzykomórkowy szlak sygnałowy, który odgrywa kluczową rolę w rozwoju. Białko to działa jako receptor dla ligandów związanych z błoną i może odgrywać wiele ról podczas rozwoju. Niedobór może być związany z dwupłatkową zastawką aortalną .
Istnieją dowody na to, że aktywowane Notch 1 i Notch 3 promują różnicowanie komórek progenitorowych w astroglej . Wycięcie 1, następnie aktywowane przed urodzeniem, indukuje gleju promienistego , ale po urodzeniu indukuje różnicowanie w astrocyty . Jedno z badań pokazuje, że kaskada Notch-1 jest aktywowana przez Reelin w niezidentyfikowany sposób. Według innego Reelin i Notch1 współpracują w rozwoju zakrętu zębatego .
Oddziaływania ligandów
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| białek postrzępionych / ząbkowanych | |||||||||
| Symbol | DSL | ||||||||
| Pfam | PF01414 | ||||||||
| InterPro | IPR026219 | ||||||||
| Błona | 76 | ||||||||
| |||||||||
Sygnalizacja Notch jest wyzwalana przez bezpośredni kontakt między komórkami, w którym pośredniczą interakcje między białkiem receptora Notch w komórce odbierającej sygnał a ligandem w sąsiedniej komórce przekazującej sygnał. Te jednoprzebiegowe białka transbłonowe typu 1 należą do rodziny białek Delta/Serrate/Lag-2 (DSL), której nazwa pochodzi od trzech kanonicznych ligandów Notch. Delta i Serrate występują u Drosophila , podczas gdy Lag-2 występuje u C. elegans . Ludzie zawierają 3 homologi Delta, podobne do Delta 1, 3 i 4, a także dwa homologi Serrate, Jagged 1 i 2 . Białka Notch składają się ze stosunkowo krótkiej domeny wewnątrzkomórkowej i dużej domeny zewnątrzkomórkowej z jednym lub więcej motywami EGF i N-końcowym motywem wiążącym DSL. Wykazano, że powtórzenia EGF 11-12 w zewnątrzkomórkowej domenie Notch są konieczne i wystarczające do transsygnalizacyjnych między Notch i jego ligandami. Dodatkowo, powtórzenia EGF 24-29 biorą udział w hamowaniu cis między Notch i ligandami koeksprymowanymi w tej samej komórce.
Proteoliza
Aby nastąpiło zdarzenie sygnalizacyjne, białko Notch musi zostać przecięte w kilku miejscach. U ludzi Notch jest najpierw cięty w domenie NRR przez furynę podczas przetwarzania w sieci trans-Golgiego, zanim zostanie zaprezentowany na powierzchni komórki jako heterodimer. Drosophila Notch nie wymaga tego rozszczepienia do wystąpienia sygnalizacji i istnieją pewne dowody sugerujące, że LIN-12 i GLP-1 są rozszczepiane w tym miejscu w C. elegans .
Uwolnienie NICD osiąga się po dodatkowych dwóch zdarzeniach cięcia do Notch. Wiązanie Notch z ligandem DSL powoduje zmianę konformacyjną, która odsłania miejsce cięcia w NECD. Enzymatyczna proteoliza w tym miejscu jest przeprowadzana przez proteazę rodziny domeny A dezintegryny i metaloproteazy (ADAM). Białko to nazywa się Kuzbanian u Drosopihla , sup-17 u C. elegans i ADAM10 u ludzi. Po rozszczepieniu proteolitycznym, uwolniony NECD jest poddawany endocytozie do komórki przenoszącej sygnał, pozostawiając jedynie niewielką pozakomórkową część Notch. To skrócone białko Notch może być następnie rozpoznane przez γ-sekretazę, która rozszczepia trzecie miejsce znalezione w domenie TM.
Ludzkie homologi
Wycięcie-1
Wycięcie-2
Notch-2 ( Neurogenic locus notch homolog protein 2 ) jest białkiem , które u ludzi jest kodowane przez gen NOTCH2 .
NOTCH2 jest związany z zespołem Alagille'a i zespołem Hajdu-Cheneya .
Wycięcie-3
Wycięcie-4
Zobacz też
Notatki
- Podatek FE, Yeargers JJ, Thomas JH (marzec 1994). „Sekwencja C. elegans lag-2 ujawnia domenę sygnalizacji komórkowej współdzieloną z Delta i Serrate of Drosophila”. Natura . 368 (6467): 150–4. Bibcode : 1994Natur.368..150T . doi : 10.1038/368150a0 . PMID 8139658 . S2CID 4345508 .
- Lindsell CE, Shawber CJ, Boulter J, Weinmaster G (marzec 1995). „Poszarpany: ligand ssaków, który aktywuje Notch1” . komórka . 80 (6): 909–17. doi : 10.1016/0092-8674(95)90294-5 . PMID 7697721 . S2CID 11720367 .
- Kelley MR, Kidd S, Deutsch WA, Young MW (listopad 1987). „Mutacje zmieniające strukturę sekwencji kodujących podobny do naskórkowego czynnika wzrostu w locus Drosophila Notch”. komórka . 51 (4): 539–48. doi : 10.1016/0092-8674(87)90123-1 . PMID 3119223 . S2CID 34338340 .