Anhydraza węglanowa 12
| CA12 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , CAXII, HsT18816, CA-XII, T18816, anhydraza węglanowa 12 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Anhydraza węglanowa 12 jest enzymem , który u ludzi jest kodowany przez gen CA12 .
Funkcjonować
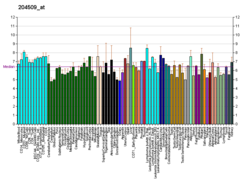
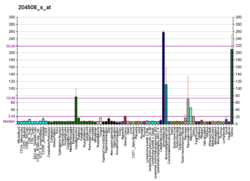
Anhydrazy węglanowe (CA) to duża rodzina metaloenzymów cynku, które katalizują odwracalną hydratację dwutlenku węgla. Uczestniczą w różnych procesach biologicznych, w tym w oddychaniu, zwapnieniu , równowadze kwasowo-zasadowej, resorpcji kości oraz tworzeniu cieczy wodnistej, płynu mózgowo-rdzeniowego , śliny i kwasu żołądkowego. Ten produkt genu jest białkiem błonowym typu I, które ulega silnej ekspresji w normalnych tkankach, takich jak nerki, okrężnica i trzustka, i stwierdzono, że jest nadeksprymowane w 10% raków jasnokomórkowych nerki . Dla tego genu zidentyfikowano dwa warianty transkryptu kodujące różne izoformy.
Patologia
Utrata funkcji mutacji w genie CAXII skutkuje defektami wydzielin płynowych i węglanowych w następujących chorobach:
1) Zespół podobny do mukowiscydozy z normalnymi poziomami białek regulatora przewodnictwa przezbłonowego mukowiscydozy ( CFTR )
4) Kserostomia lub zespół suchości w jamie ustnej
Molekularne podłoże zespołu podobnego do mukowiscydozy
CAXII, z mutacją His121Gln lub Glu143Lys, lokalizuje się w błonach podstawno-bocznych spolaryzowanych komórek MDCK, podobnie jak enzym typu dzikiego, co wskazuje na brak szkodliwego wpływu na lokalizację subkomórkową.
utraty funkcji Glu143Lys (E143K) genu CAXII jest związany z rzadkim stanem autosomalnym recesywnym zwanym izolowaną hiperchlorhidrozą (niedobór anhydrazy węglanowej XII). Zazwyczaj wariant ten powoduje nadmierną utratę chlorku sodu, zwykle w wyniku pocenia się , i patologicznie objawia się epizodycznym odwodnieniem hiponatremicznym z napadami wymiotów i/lub biegunki.
Ogólnie zmutowane enzymy CAXII wykazują zmniejszoną aktywność. Obserwacje te utrudniają wyjaśnienie mechanizmu autosomalnego recesywnego zaburzenia hiponatremii , powodującego marnowanie soli w pocie z powodu mutanta CAXII.
W oddzielnym badaniu naukowcy zaobserwowali, że aktywność zmutowanego enzymu jest całkowicie zmniejszona przy fizjologicznych stężeniach chlorku sodu. Zatem utrata funkcji CAXII w gruczołach potowych i płucach jest molekularną podstawą dla pacjentów z mukowiscydozą z prawidłowym CFTR .
Informacje o dużym wpływie na CAXII
Zróżnicowana modulacja środowiska miejsca aktywnego CAXII przez kationowe kropki kwantowe i polilizynę pomaga zaprojektować specyficzne dla CAXII aktywatory i inhibitory enzymu. Specyficzne hamowanie CAXII zapewnia narzędzie do zakłócania proliferacji komórek, powodując apoptozę komórek w chłoniakach z komórek T.
Analityczny, diagnostyczny i terapeutyczny kontekst CAXII
Poziomy CAXII w surowicy powinny mieć zastosowanie jako serodiagnostyczny marker raka płuc.
Notatki
Linki zewnętrzne
- Lokalizacja ludzkiego genomu CA12 i strona szczegółów genu CA12 w przeglądarce genomu UCSC .
Dalsza lektura
- Sahin U, Türeci O, Schmitt H, Cochlovius B, Johannes T, Schmits R, Stenner F, Luo G, Schobert I, Pfreundschuh M (1996). „Nowotwory ludzkie wywołują wiele swoistych odpowiedzi immunologicznych u gospodarza autologicznego” . proc. Natl. Acad. nauka USA . 92 (25): 11810–11813. Bibcode : 1995PNAS...9211810S . doi : 10.1073/pnas.92.25.11810 . PMC40492 . _ PMID 8524854 .
- Ivanov SV, Kuzmin I, Wei MH, Pack S, Geil L, Johnson BE, Stanbridge EJ, Lerman MI (1998). „Regulacja w dół transbłonowych anhydraz węglanowych w liniach komórkowych raka nerki przez transgeny von Hippel-Lindau typu dzikiego” . proc. Natl. Acad. nauka USA . 95 (21): 12596–12601. Bibcode : 1998PNAS...9512596I . doi : 10.1073/pnas.95.21.12596 . PMC22876 . _ PMID 9770531 .
- Fujikawa-Adachi K, Nishimori I, Taguchi T, Onishi S (1999). „Ludzka anhydraza węglanowa XIV (CA14): klonowanie cDNA, ekspresja mRNA i mapowanie do chromosomu 1”. Genomika . 61 (1): 74–81. doi : 10.1006/geno.1999.5938 . PMID 10512682 .
- Karhumaa P, Parkkila S, Türeci O, Waheed A, Grubb JH, Shah G, Parkkila A, Kaunisto K, Tapanainen J, Sly WS, Rajaniemi H (2000). „Identyfikacja anhydrazy węglanowej XII jako izozymu błonowego wyrażanego w normalnym ludzkim nabłonku endometrium” . Mol. Szum. Reprodukcja _ 6 (1): 68–74. doi : 10.1093/molehr/6.1.68 . PMID 10611263 .
- Kivelä A, Parkkila S, Saarnio J, Karttunen TJ, Kivelä J, Parkkila AK, Waheed A, Sly WS, Grubb JH, Shah G, Türeci O, Rajaniemi H (2000). „Ekspresja nowego przezbłonowego izozymu anhydrazy węglanowej XII w prawidłowych ludzkich jelitach i nowotworach jelita grubego” . Jestem. J. Patol . 156 (2): 577–84. doi : 10.1016/S0002-9440(10)64762-1 . PMC 1850052 . PMID 10666387 .
- Kivelä AJ, Parkkila S, Saarnio J, Karttunen TJ, Kivelä J, Parkkila AK, Pastoreková S, Pastorek J, Waheed A, Sly WS, Rajaniemi H (2001). „Ekspresja transbłonowych izoenzymów anhydrazy węglanowej IX i XII w prawidłowej ludzkiej trzustce i guzach trzustki”. Histochem. Biol komórkowy . 114 (3): 197–204. doi : 10.1007/s004180000181 . PMID 11083462 . S2CID 22170460 .
- Parkkila S, Parkkila AK, Saarnio J, Kivelä J, Karttunen TJ, Kaunisto K, Waheed A, Sly WS, Türeci O, Virtanen I, Rajaniemi H (2001). „Ekspresja związanego z błoną izozymu anhydrazy węglanowej XII w nerkach ludzkich i guzach nerek” . J. Histochem. Cytochem . 48 (12): 1601–8. doi : 10.1177/002215540004801203 . PMID 11101628 .
- Wykoff CC, Beasley N, Watson PH, Campo L, Chia SK, English R, Pastorek J, Sly WS, Ratcliffe P, Harris AL (2001). „Ekspresja indukowanej niedotlenieniem i związanej z nowotworem anhydrazy węglanowej w raku przewodowym piersi in situ” . Jestem. J. Patol . 158 (3): 1011-9. doi : 10.1016/S0002-9440(10)64048-5 . PMC 1850356 . PMID 11238049 .
- Karhumaa P, Kaunisto K, Parkkila S, Waheed A, Pastoreková S, Pastorek J, Sly WS, Rajaniemi H (2001). „Ekspresja przezbłonowych anhydraz węglanowych, CA IX i CA XII, w męskich przewodach wyjściowych człowieka”. Mol. Szum. Reprodukcja _ 7 (7): 611–616. doi : 10.1093/molehr/7.7.611 . PMID 11420383 .
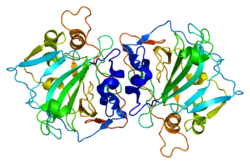
- Whittington DA, Waheed A, Ulmasov B, Shah GN, Grubb JH, Sly WS, Christianson DW (2001). „Struktura krystaliczna dimerycznej domeny zewnątrzkomórkowej ludzkiej anhydrazy węglanowej XII, bitopowego białka błonowego nadeksprymowanego w niektórych komórkach nowotworowych” . proc. Natl. Acad. nauka USA . 98 (17): 9545–9550. Bibcode : 2001PNAS...98.9545W . doi : 10.1073/pnas.161301298 . PMC 55489 . PMID 11493685 .
- Kivela AJ, Saarnio J, Karttunen TJ, Kivelä J, Parkkila AK, Pastorekova S, Pastorek J, Waheed A, Sly WS, Parkkila TS, Rajaniemi H (2001). „Różnicowa ekspresja cytoplazmatycznych anhydraz węglanowych CA I i II oraz izozymów związanych z błoną CA IX i XII w normalnej błonie śluzowej jelita grubego iw guzach jelita grubego”. Kopać. Dis. nauka . 46 (10): 2179–2186. doi : 10.1023/A:1011910931210 . PMID 11680594 . S2CID 40928937 .
- Liao SY, Ivanov S, Ivanova A, Ghosh S, Cote MA, Keefe K, Coca-Prados M, Stanbridge EJ, Lerman MI (2003). „Ekspresja genów anhydrazy węglanowej przezbłonowej powierzchni komórki CA9 i CA12 w ludzkim oku: nadekspresja CA12 (CAXII) w jaskrze” . J. Med. Genet . 40 (4): 257–261. doi : 10.1136/jmg.40.4.257 . PMC 1735430 . PMID 12676895 .
- Leppilampi M, Saarnio J, Karttunen TJ, Kivelä J, Pastoreková S, Pastorek J, Waheed A, Sly WS, Parkkila S (2003). „Izozymy anhydrazy węglanowej IX i XII w guzach żołądka” . Świat J. Gastroenterol . 9 (7): 1398–403. doi : 10.3748/wjg.v9.i7.1398 . PMC 4615471 . PMID 12854129 .
- Kyllönen MS, Parkkila S, Rajaniemi H, Waheed A, Grubb JH, Shah GN, Sly WS, Kaunisto K (2003). „Lokalizacja anhydrazy węglanowej XII w błonie podstawno-bocznej komórek wydzielających H + nerki myszy i szczura” . J. Histochem. Cytochem . 51 (9): 1217–24. doi : 10.1177/002215540305100912 . PMID 12923247 .
- Tarun AS, Bryant B, Zhai W, Solomon C, Shusterman D (2004). „Ekspresja genów dla izoenzymów anhydrazy węglanowej w ludzkiej błonie śluzowej nosa” . chemia Zmysły . 28 (7): 621–629. doi : 10.1093/chemse/bjg054 . PMID 14578124 .
- Kivela AJ, Parkkila S, Saarnio J, Karttunen TJ, Kivela J, Parkkila AK, Bartosova M, Mucha V, Novak M, Waheed A, Sly WS, Rajaniemi H, Pastorekova S, Pastorek J (2005). „Ekspresja supresora guza von Hippla-Lindaua i związanych z nowotworem anhydraz węglanowych IX i XII w normalnej i nowotworowej błonie śluzowej jelita grubego” . Świat J. Gastroenterol . 11 (17): 2616–25. doi : 10.3748/wjg.v11.i17.2616 . PMC 4305753 . PMID 15849821 .