Deskryptor (chemia)
Deskryptor to w nomenklaturze chemicznej przedrostek umieszczony przed systematyczną nazwą substancji , który opisuje konfigurację lub stereochemię cząsteczki . Niektóre wymienione deskryptory mają jedynie znaczenie historyczne i nie powinny być już używane w publikacjach , ponieważ nie odpowiadają współczesnym zaleceniom IUPAC . Stereodeskryptory są często używane w połączeniu z lokantami , aby jednoznacznie zidentyfikować strukturę chemiczną .
Deskryptory, zwykle umieszczane na początku nazwy systematycznej, nie są brane pod uwagę przy sortowaniu alfabetycznym.
Deskryptory konfiguracji
cis , trans
Zobacz: izomeria cis – trans
Deskryptory cis ( łac . po tej stronie ) i trans (łac. ponad, poza ) są używane w różnych kontekstach do opisu konfiguracji chemicznych:
W organicznej chemii strukturalnej konfigurację wiązania podwójnego można opisać za pomocą cis i trans , w przypadku gdy ma prosty wzór podstawienia z tylko dwiema resztami. Położenie dwóch reszt względem siebie w różnych punktach układu pierścieniowego lub większej cząsteczki można również opisać za pomocą cis i trans , jeśli konfiguracja struktury jest sztywna i nie pozwala na prostą inwersję.
W chemii związków nieorganicznych deskryptory cis i trans są używane do charakteryzowania izomerów pozycyjnych w kompleksach oktaedrycznych o konfiguracji A2B4X lub kompleksach planarnych o konfiguracji A2B2X .
Kompleks kwadratowo-płaski: cisplatyna
Typograficzne przedstawienie cis i trans jest pisane kursywą i małymi literami.
cis / trans nie jest jednoznaczna dla bardziej podstawionych wiązań podwójnych i jest obecnie w dużej mierze zastępowana przez nomenklaturę ( E ) /( Z ).
( E ), ( Z )
Zobacz: notacja E - Z
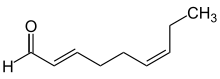
Deskryptory ( E ) (od niemieckiego entgegen, przeciwne) i ( Z ) (razem od niemieckiego zusammen) są używane do zapewnienia wyraźnego opisu wzorca podstawienia dla alkenów, kumulenów lub innych układów wiązań podwójnych, takich jak oksymy.
Ponieważ przypisanie ( E ) lub ( Z ) opiera się na względnej pozycji dwóch podstawników o najwyższym priorytecie po każdej stronie wiązania podwójnego, podczas gdy pierwszeństwo jest oparte na nomenklaturze CIP. Nazewnictwo ( E )/( Z ) można zastosować do dowolnych układów wiązań podwójnych (w tym heteroatomów), ale nie do układów pierścieni podstawionych. Deskryptory ( E ) i ( Z ) są zawsze pisane wielką literą, kursywą i otoczone nawiasami, które są ustawione jako normalne, tak jak dodatkowe lokanty lub przecinki.
o- , m- , p- _
Zobacz: wzór podstawienia Arene
 |
 |

|
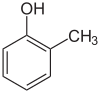
| o -krezol | m -krezol | p -krezol |
Skrót o - (skrót od orto , z greckiego orthós oznaczający prosty, prosty), m - ( meta , z greckiego (z grubsza) pomiędzy) i p - ( para , z greckiego pará oznacza przylegający, z boku) opisują trzy możliwe izomery pozycyjne dwóch podstawników w pierścieniu benzenowym . Zwykle są to dwa niezależne pojedyncze podstawniki, ale w przypadku skondensowanych układów pierścieniowych orto -fuzji, chyba że w nazwie uwzględniono wzór podstawienia jak w [2.2]paracyclophane . W obecnym nomenklaturze systematycznej o -, m - i p - są często zastępowane lokantami ( 1,2-dimetylobenzen zamiast o -ksylenu).
o -, m - i p - (pisane orto -, meta - i para -) pisane są małymi literami i kursywą.
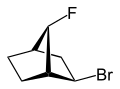
egzo , endo
Zobacz: Endo - izomeria egzo
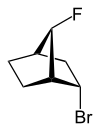
exo (z greckiego = na zewnątrz) lub endo (z greckiego endon = wewnątrz) oznacza względną konfigurację zmostkowanych związków bicyklicznych. O przyporządkowaniu egzo lub endo decyduje położenie podstawnika w pierścieniu głównym względem najkrótszego mostka (wg IUPAC: mostek z najwyższymi cyframi lokantowymi w zmostkowanym układzie pierścieni). Podstawnik, który ma być sklasyfikowany, jest przypisywany deskryptorowi egzo , gdy jest skierowany w stronę mostka. Jest endo , gdy jest odwrócony od mostka. Jeśli dwa różne podstawniki znajdują się na tym samym atomie C, egzo / endo jest oparte na podstawniku o wyższym priorytecie zgodnie z zasadami CIP.
syn , anty
Jeśli zmostkowany układ bicykliczny zawiera podstawnik przy najkrótszym mostku, deskryptor egzo lub endo nie może być użyty do jego przypisania. Takie izomery są klasyfikowane według syn / anty . Jeśli podstawnik, który ma zostać przypisany, jest skierowany w stronę pierścienia o największej liczbie segmentów, jest to skonfigurowany syn (z gr. syn = razem). W przeciwnym razie jest przypisywany anty deskryptorowi (gr. anti = przeciw). Jeśli oba pierścienie mają taką samą liczbę segmentów, wybierany jest pierścień z najbardziej znaczącym podstawnikiem zgodnie z regułami CIP.
Stosowanie syn i anti do oznaczania konfiguracji wiązań podwójnych jest obecnie przestarzałe, zwłaszcza w przypadku aldoksymów i aldehydów pochodzących od hydrazonów . Tutaj związki oznaczono jako syn , gdy aldehyd H i O (z oksymu) lub N (z hydrazonu) były ułożone cis . Związki te są obecnie opisane za pomocą nomenklatury ( E )/( Z ). Aldoksymy i hydrazony sklasyfikowane jako syn są zatem obecnie opisywane jako skonfigurowane ( E ).
Mówiąc o diastereoizomerach, syn i anty są używane do opisania grup w tych samych lub przeciwnych miejscach w prijection zygzakowatym, patrz Diastereomer#Syn / anti
syn i anti są zawsze pisane małymi literami i kursywą, lokanty (jeśli są używane) są umieszczane przed słowem i oddzielone myślnikami.
fak , mer
Terminy fac (od łacińskiego facja) i mer (od meridonal) mogą określać rozmieszczenie trzech identycznych ligandów wokół centralnego atomu w oktaedrycznych kompleksach. Dziś ta nomenklatura jest uważana za przestarzałą, ale nadal jest dopuszczalna. Przedrostek fac opisuje sytuację, w której trzy identyczne ligandy zajmują trzy wierzchołki trójkątnej powierzchni ośmiościanu. W merowej trzy ligandy rozciągają się na płaszczyźnie, w której znajduje się centralny atom.
fac i mer są poprzedzone małą czcionką i kursywą przed nazwą złożoną.
n , izo , neo , cyklo
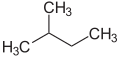
Przedrostki n (normalny), iso (z greckiego ísos = równy), neo (z greckiego néos = młody, nowy) i cyclo (z greckiego kyklos = koło) są używane głównie do opisania rozmieszczenia atomów, zwykle atomów węgla w szkielecie węglowym . n , iso i neo nie są już używane w nomenklaturze systematycznej, ale nadal często w nazwach trywialnych iw żargonie laboratoryjnym.
Przedrostek n opisuje szkielet węglowy o prostym łańcuchu bez rozgałęzień, podczas gdy iso opisuje szkielet rozgałęziony, bez podawania dalszych szczegółów. Mówiąc bardziej ogólnie, izo jest związkiem, który jest izomeryczny w stosunku do związku n (związek, w którym poszczególne atomy lub grupy atomowe są przegrupowane)
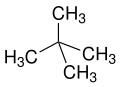
neo to niespecyficzne określenie dla „nowych”, zazwyczaj syntetycznie wytwarzanych substancji lub izomerów znanych od dawna n związków lub substancji naturalnych (np. neomentol pochodzący z mentolu lub kwas neoabietynowy z kwasu abietynowego ). Według IUPAC neo jest zalecany tylko w neopentanie lub reszcie neopentylowej.
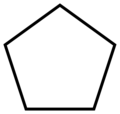
cyklo jest często używanym przedrostkiem dla wszystkich związków cyklicznych i heterocyklicznych. W wielu nazwach własnych substancji chemicznych cyklo nie jest używane jako przedrostek, ale bezpośrednio jako część nazwy, na przykład w cykloheksanie lub cyklooktatetraenie.
Podczas gdy n , iso i neo są pisane małymi literami i kursywą, cyklo dotyczy to tylko związków nieorganicznych. W związkach organicznych „cyklo” jest często używane jako składnik nazwy, nieoddzielone łącznikiem, a także uwzględniane w sortowaniu alfabetycznym.
sek -, tert -
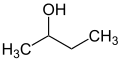
Przedrostki sec i tert są używane do wskazania środowiska podstawników w cząsteczce. Zatem nie jest opisana dokładna pozycja podstawnika, a jedynie wzór podstawienia sąsiedniego atomu (zwykle atomu węgla). W n -butanolu grupa OH jest przyłączona do pierwszorzędowego atomu węgla, w sec -butanolu do drugorzędowego atomu węgla, aw tert -butanolu do trzeciorzędowego atomu węgla.
Terminy sec i tert są uważane za przestarzałe i powinny być używane tylko dla niepodstawionych grup sec-butoksy, sec-butyl lub tert-butyl. Istnieją różne pisownie, takie jak „sec-butyl”, „s-butyl”, „sBu” lub „bus”, które również są uważane za przestarzałe.
spiro
Przedrostek „spiro”, po którym następuje deskryptor Von-Baeyera, opisuje w nomenklaturze związków organicznych układy pierścieni połączone tylko jednym wspólnym atomem, atomem spiro. Jeśli w cząsteczce występuje kilka atomów spiro, przedrostek „spiro” jest opatrzony przedrostkiem („dispiro”, „trispiro” itp.) odpowiadającym liczbie atomów spiro. Zazwyczaj „spiro” jest ustawione jako normalne.
łańcuch
Termin catena jest używany w nomenklaturze nieorganicznej do opisania liniowych, podobnych do łańcuchów polimerów z identycznych jednostek wieloatomowych. Jednym z przykładów są katenatrifosfazeny. Związkami pokrewnymi w chemii organicznej są katenany .
Stereodeskryptory konfiguracji absolutnych
( R ), ( P )
Zobacz: Reguły pierwszeństwa Cahna – Ingolda – Preloga
Deskryptory stereochemiczne ( R ) (od łac. rectus = prawy) i ( S ) (od łac. sinister = lewy) są używane do opisania absolutnej konfiguracji stereocentrum (zwykle chiralnego atomu węgla). W tym celu wszystkie podstawniki w stereocentrum mają priorytet zgodnie z zasadami CIP, a podstawnik o najniższym priorytecie („D”) jest skierowany do tyłu (z dala od kierunku patrzenia). Stereocentrum jest ( S ) skonfigurowane, jeśli pozostałe podstawniki opisują okrąg malejący w kolejności („A” → „B” → „C”) w lewo. Konfiguracja ( R ) jest przypisana do stereocentrum, jeżeli kierunek obrotu jest skierowany w prawo.
Jeśli jedna cząsteczka zawiera kilka stereocentrów, przed deskryptorem należy umieścić lokant (na przykład w (1 R , 2 S )-2-amino-1-fenylopropan-1-olu, systematyczne oznaczenie norefedryny ) . Jeśli wszystkie stereocentra są skonfigurowane tak samo, nazewnictwo lokantów można pominąć na korzyść pisowni „all- R ” lub „(all- S )”.
Typograficznie, ( R ) i ( S ) są pisane wielkimi literami i kursywą; często poprzedzające lokanty, otaczające nawiasy okrągłe i przecinki, z drugiej strony, jak zwykle.
( r ), ( s )
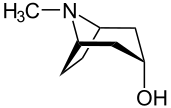
Deskryptory ( r ) i ( s ) są używane do opisania absolutnej konfiguracji centrów pseudoasymetrycznych (pseudochiralnych). Pseudoasymetria występuje, gdy cztery różne podstawniki są przyłączone do jednego atomu węgla, z których dwa różnią się jedynie absolutną konfiguracją stereochemiczną. Przykładami takich związków są związki mezo, takie jak alkaloidy tropanowe; związkiem macierzystym jest tropina , której nazwa systematyczna to (1R , 3r , 5S ) -8-metylo-8-azabicyklo[3.2.1]oktano-3-ol. W tej strukturze atom C3 — węgiel, do którego grupa hydroksylowa — jest pseudoasymetryczny; dlatego deskryptor stereochemiczny w nazwie systematycznej jest zapisywany małymi literami kursywą, a nie wielką kursywą, jak w przypadku regularnych atomów chiralnych.
D- , L- _
Zobacz: projekcja Fischera
D - glukoza w projekcji Fischera. Czerwony: Grupa o najwyższym priorytecie, Niebieski: Do określenia D -/ L - odpowiednia grupa, Fioletowy: Grupa z achiralnym atomem węgla
Stereoskryptory D - (od łacińskiego dexter, po prawej) i L - (łac. laevus, po lewej) są używane do opisania konfiguracji α-aminokwasów i cukrów. Najpierw trójwymiarową cząsteczkę należy przekształcić w określony zapis jako dwuwymiarowy obraz („projekcja Fischera”). W tym celu atom C o najwyższym priorytecie zgodnie z normalnymi regułami nomenklatury jest umieszczony na górze, a dalszy łańcuch węglowy jest umieszczony pionowo pod spodem. Chiralny atom C najbardziej oddalony od grupy o najwyższym priorytecie jest używany do przypisania D- lub L- . Jeśli reszta znajdująca się na tym atomie węgla (zwykle grupa OH) jest skierowana w lewo, cząsteczka pochodzi z serii L. Jeśli reszta jest skierowana w prawo, używany jest deskryptor D -.
Deskryptory D - i L - są pisane małymi literami i oddzielone łącznikiem od reszty nazwy.
d- , l- _
D - i L - z małej dużej litery są błędnie mylone z przestarzałymi stereodeskryptorami d - i l - pisanymi kursywą, które są odpowiednikami prawoskrętnej i lewoskrętnej rotacji optycznej , tj. odpowiednio stereodeskryptory (+)- i (-)-.








![fac-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/6/69/Fac-trichlorotriamminecobalt%28III%29.png/109px-Fac-trichlorotriamminecobalt%28III%29.png)
![mer-[CoCl3(NH3)3]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/54/Mer-trichlorotriamminecobalt%28III%29.png/120px-Mer-trichlorotriamminecobalt%28III%29.png)