związek spiro


W chemii organicznej związki spiro to związki , które mają co najmniej dwa pierścienie molekularne z tylko jednym wspólnym atomem. Najprostsze związki spiro są bicykliczne (mają tylko dwa pierścienie) lub mają część bicykliczną jako część większego układu pierścieniowego, w obu przypadkach z dwoma pierścieniami połączonymi przez definiujący pojedynczy wspólny atom. Jeden wspólny atom łączący uczestniczące pierścienie odróżnia związki spiro od innych związków bicyklicznych: od izolowanych związków pierścieniowych, takich jak bifenyl , które nie mają atomów łączących, od związki ze skondensowanymi pierścieniami, takie jak dekalina , mające dwa pierścienie połączone dwoma sąsiednimi atomami, oraz związki z pierścieniami mostkowymi, takie jak norbornan , z dwoma pierścieniami połączonymi dwoma niesąsiadującymi atomami.

Związki spiro mogą być w pełni karbocykliczne (cały węgiel) lub heterocykliczne (zawierające jeden lub więcej atomów innych niż węgiel). Jednym z powszechnych rodzajów związków spiro spotykanych w placówkach oświatowych jest związek heterocykliczny — acetal powstały w wyniku reakcji diolu z cyklicznym ketonem . Wspólny atom, który łączy dwa (lub czasami trzy) pierścienie, nazywany jest atomem spiro ; w karbocyklicznych związkach spiro, takich jak spiro [5.5] undekan (patrz rysunek po prawej), spiro-atom jest czwartorzędowym węglem , a jako -an zakończenie sugeruje, że są to typy cząsteczek, do których po raz pierwszy zastosowano nazwę spiran (chociaż obecnie jest używana ogólnie dla wszystkich związków spiro). Podobnie czterowartościowy obojętny krzem lub dodatnio naładowany czwartorzędowy atom azotu ( kation amoniowy ) może być centrum spiro w tych związkach, a wiele z nich zostało przygotowanych i opisanych. [ potrzebne źródło ] Łączone 2-3 pierścienie mają najczęściej różną naturę, chociaż czasami są identyczne [np. spiro[5.5]undekan, właśnie pokazany, i spiropentadien , po prawej]. Chociaż szkice struktur organicznych sprawiają, że związki spiro wydają się płaskie, tak nie jest; na przykład związek spiro z parą trójczłonowych cyklopropenowych połączonych spiro (zdjęcie poniżej) otrzymał popularną błędną nazwę struktury muszki , gdy nie jest płaski ani płaski jak muszka. Można to wyrazić w inny sposób, mówiąc, że najlepiej dopasowane płaszczyzny do każdego pierścienia są często prostopadłe lub w inny sposób nie są współpłaszczyznowe względem siebie.
Związki spiro są obecne w całym świecie przyrody, a niektóre z nich zostały wykorzystane jako związki narzędziowe do badań biomedycznych i służą jako rusztowania do projektowania środków terapeutycznych o nowych kształtach. [ Potrzebne źródło ] Również motyw spiro jest obecny w różnych praktycznych typach związków (takich jak barwniki), a także w szerokiej gamie projektów materiałów oligo- i polimerowych, ze względu na unikalne kształty i właściwości, jakie nadaje centrum spiro, np. , w szczególności w projektowaniu materiałów elektronicznie aktywnych. [ potrzebne źródło ] W obu przypadkach obecność centrum spiro, często z dołączonymi czterema odrębnymi grupami, oraz z jego unikalnymi aspektami chiralności, stanowi wyjątkowe wyzwanie dla syntezy chemicznej każdego typu związku. [ potrzebne źródło ]
Karbocykliczne związki spiro

Bicykliczne struktury pierścieniowe w chemii organicznej , które mają dwa w pełni karbocykliczne (całkowicie węglowe) pierścienie połączone tylko jednym atomem, są obecne zarówno w produktach naturalnych , jak iw ezoterycznych celach syntezy chemicznej . [ Potrzebne źródło ] Te dwa karbocykle mogą mieć różny charakter lub być identyczne. W przypadku wspólnych celów pochodzących z produktów naturalnych zasadniczo zawsze są one różne. W celach ezoterycznych, takich jak wysoko obciążone węglowodory, takie jak spiropentadien , pokazany tutaj, pierścienie mogą być identyczne. Atom łączący dwa pierścienie nazywany jest spiroatomem ; w karbocyklicznych związkach spiro atomem spiro jest czwartorzędowy węgiel . Przedstawiona powyżej 11-węglowa bicykliczna struktura, spiro [5,5] undekan, jest również w pełni karbocyklicznym związkiem spiro. Chociaż prezentacja tej struktury sprawia, że wydaje się ona w pełni płaska, tak nie jest. Płaszczyzny najlepiej dopasowane do każdego sześcioatomowego pierścienia powyżej są prawie prostopadłe, a płaszczyzny najlepiej dopasowane do pierścieni związków spiro są również generalnie niewspółpłaszczyznowe. Na przykład struktura sztucznej muszki spiropentadienu , pokazany powyżej, wyjaśnia, że płaszczyzny , które są określone przez atomy każdego pierścienia - tj. najlepiej dopasowana płaszczyzna każdego cyklopropenu - są do siebie ortogonalne (prostopadłe).
Heterocykliczne związki spiro

Związki spiro są uważane za heterocykliczne, jeśli atom spiro lub dowolny atom w pierścieniu nie jest atomem węgla. Przypadki obejmują obecność heteroatomu spiro, takiego jak krzem i azot (ale także inne grupy IVA [14] i inne typy atomów) łączące pierścienie, które zostały zaobserwowane lub są przedmiotem badań teoretycznych; [ Potrzebne źródło ] ponadto istnieje wiele przypadków, w których jeden lub więcej heteroatomów pojawia się w jednym lub więcej pierścieni, które są połączone na atomie spiro węgla (np. wspólny). [ potrzebne źródło ] [ wymagana weryfikacja ]
Częstym przypadkiem jest obecność dwóch atomów, które nie są węglem, w jednym z pierścieni, przy czym oba te pierścienie są przyłączone do atomu spiro; w rzeczywistości często najwcześniejsza ekspozycja szkolącego się chemika na związek spiro dotyczy formy heterocyklicznej, ketalu (acetalu) utworzonego w celu ochrony ketonów przez diole i ditiole . Przykład tego pokazano powyżej, w syntezie acetalu 1,4-dioksaspiro[4.5]dekanu z cykloheksanonu i etanodiolu . W tym przypadku, ponieważ nie wszystkie cztery atomy przyłączone do atomu spiro to atomy węgla, atom spiro nie jest czwartorzędowym węglem. Kolejny przykład an acetal utworzony z cyklicznego ketonu , z wyjątkiem ditiolu , to spiro-związek spirapril , który ma pięcioczłonowy pierścień utworzony z 1,2-etanoditiolu . Ponownie, chociaż pierścienie mogą być identyczne, w przypadku heterocyklicznym są one prawie zawsze nieidentyczne. Ponownie, płaszczyzny najlepiej dopasowane do każdego pierścienia są na ogół niewspółpłaszczyznowe względem siebie (tj. pierścienie nie są współpłaszczyznowe, pomimo tego, że pojawiają się na obrazach).
Związki polispirowe
Związek polispiro jest połączony przez dwa lub więcej spiroatomów tworzących trzy lub więcej pierścieni . [ potrzebne źródło ]
Nomenklatura
Nazewnictwo związków spiro zostało po raz pierwszy omówione przez Adolfa von Baeyera w 1900 r. Przedrostek spiro oznacza dwa pierścienie ze złączem spiro. Główną metodą nomenklatury systematycznej jest stosowanie nawiasów kwadratowych zawierających liczbę atomów w mniejszym pierścieniu, a następnie liczbę atomów w większym pierścieniu, oddzielonych kropką, w każdym przypadku z wyłączeniem spiroatomu (atom, przez który dwa pierścienie są związane) sam. Numeracja pozycji rozpoczyna się od atomu mniejszego pierścienia przylegającego do spiroatomu wokół atomów tego pierścienia, następnie samego spiroatomu, a następnie wokół atomów większego pierścienia. Na przykład złożony A na obrazku to 1-bromo-3-chlorospiro[4.5]dekan-7-ol , a związek B to 1-bromo-3-chlorospiro[3.6]dekan-7-ol .
Chiralność
Spirany mogą być chiralne na trzy różne sposoby. Po pierwsze, mimo że wydają się być skręcone, mogą jednak mieć centrum chiralne, co czyni je analogicznymi do dowolnego prostego związku chiralnego , a po drugie, chociaż ponownie wydają się skręcone, specyficzne położenie podstawników, jak w przypadku alkilidenocykloalkanów, może sprawić, że związek spiro będzie miał centrum chiralność (zamiast chiralności osiowej wynikającej ze skręcenia); po trzecie, podstawniki pierścieni związku spiro mogą być takie, że jedyny powód, dla którego są chiralne, wynika wyłącznie ze skręcenia ich pierścieni, np. w najprostszym przypadku bicyklicznym, gdzie dwa strukturalnie identyczne pierścienie są przyłączone poprzez ich atom spiro, co skutkuje przekręconą prezentacją dwóch pierścieni. Stąd w trzecim przypadku opisany powyżej brak płaskości powoduje powstanie tego, co nazywamy osiowa chiralność w skądinąd identycznej parze izomerycznej związków spiro, ponieważ różnią się one jedynie prawoskrętnym i lewoskrętnym „skręceniem” strukturalnie identycznych pierścieni (co widać również w allenach , biarylach z zawadą przestrzenną i alkilidenocykloalkanach). Przypisanie absolutnej konfiguracji związków spiro było trudne, ale jednoznacznie przypisano liczbę każdego typu.
Niektóre związki spiro wykazują chiralność osiową . Spiroatomy mogą być źródłem chiralności , nawet jeśli brakuje im wymaganych czterech różnych podstawników normalnie obserwowanych w chiralności. Gdy dwa pierścienie są identyczne, priorytet jest określany przez niewielką modyfikację systemu CIP , przypisując wyższy priorytet jednemu rozszerzeniu pierścienia i niższy priorytet rozszerzeniu w drugim pierścieniu. Gdy pierścienie są różne, obowiązują zwykłe zasady. [ wymagane wyjaśnienie ]
Przygotowanie
Związki spiro stanowią wyjątkowe wyzwania preparatywne , niezależnie od tego, czy każdy pierścień składający się na jego strukturę jest unikalny czy identyczny, czy też są karbocykliczne lub heterocykliczne - ze względu na praktyczne implikacje tetra-funkcjonalizacji centralnego atomu spiro (często z czterema różnymi grupami) i unikalne aspekty chiralności , które mają zastosowanie do tych związków. [ wymagana weryfikacja ]
Konkretne metody
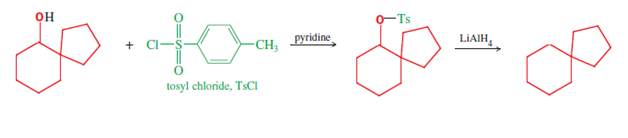
Niektóre związki spiro można zsyntetyzować za pomocą przegrupowania pinakol-pinakolon ; na przykład spiro[4.5]dekan (końcowy związek na poniższym dwuliniowym schemacie) można zsyntetyzować z symetrycznych 1,2-dioli rodzaju pokazanego poniżej [np. materiał wyjściowy tej drogi, (1,1′-bicyklopentyl) -1 ,1′-diol]. Początkowo jedno z ugrupowań karbinolu jest protonowane, co pozwala wodzie opuścić się i uzyskać odpowiednią karbokację (druga struktura, pierwszy rząd); ten związek pośredni następnie przechodzi migrację wiązania, co powoduje ekspansję pierścienia sąsiedniego pierścienia, z deprotionacją demaskującą ketonową grupę funkcyjną , aby zakończyć pierwszą linię mechanizmu. Ten pierwszy produkt, spirocykliczny keton, sam w sobie jest związkiem spiro i po dwóch dalszych reakcjach redukcji daje dalszy spirokarbinol i alicykliczny spirowęglowodór . Po pierwsze, redukcja karbonylu, który kończy pierwszą linię mechanizmu, dostarcza spirokarbinolowy materiał wyjściowy drugiej linii, który jest potrzebny do redukcji do alkanu (pokazano). Ta ostatnia redukcja jest przeprowadzana przy użyciu wodorku litowo-glinowego (LiAlH4 ) , poprzez tosylan alkoholu (utworzony przy użyciu chlorku tosylu ). Stąd ta sekwencja trzech reakcji dostarcza trzy związki spiro (keton, alkohol i alkan), o możliwych badaniach lub praktycznym zastosowaniu. [ wymagana weryfikacja ]
Używa
Formy spiro laktonów i oksazyn są często używane jako barwniki leuko , często wykazując chromizm - odwracalną zmianę strukturalną między formami, powodującą pojawienie się bezbarwnych i kolorowych, zwłaszcza w roztworze. [ potrzebne źródło ]
Spiroaromatyczność
Spiroaromatyczność w chemii organicznej odnosi się do szczególnego przypadku aromatyczności , w którym koniugacja jest przerywana przez pojedynczy spiroatom. Chociaż to centrum spiro zakłóca ciągłe nakładanie się orbitali p , tradycyjnie uważanych za wymóg aromatyczności, dla takich związków nadal obserwuje się znaczną stabilność termodynamiczną i wiele właściwości spektroskopowych, magnetycznych i chemicznych związanych ze związkami aromatycznymi.
Etymologia
Związek spiro lub spirane , z łacińskiego spīra , oznaczający skręt lub cewkę, jest związkiem chemicznym , zazwyczaj związkiem organicznym , który przedstawia skręconą strukturę dwóch lub więcej pierścieni (układ pierścieni), w którym 2 lub 3 pierścienie są połączone ze sobą jednym wspólnym atomem, którego przykłady pokazano po prawej stronie.
Dalsza lektura
-
Clayden, Jonathan; Greeves, Nick & Warren, Stuart (2012). Chemia organiczna (wyd. 2). Oksford, Wielka Brytania: Oxford University Press. s. 319f, 432, 604np, 653, 746int, 803ketals, 839, 846f. ISBN 978-0199270293 . Źródło 2 lutego 2016 r .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) -
Eliel, Ernest Ludwig; Wilen, Samuel H. i Mander, Lewis N. (1994). „Chiralność w cząsteczkach pozbawionych centrów chiralnych (rozdział 14)” . Stereochemia związków organicznych (wyd. 1). Nowy Jork, NY, USA: Wiley & Sons. s. 1119–1190, zwł. 1119ff, 1138ff i passim . ISBN 978-0471016700 . Źródło 2 lutego 2016 r .
{{ cite book }}: CS1 maint: używa parametru autorów ( link ) Dalsze, ale mniej stabilne źródło tego samego tekstu, które zapewnia dostęp do odpowiednich materiałów, można znaleźć w [4] , ta sama data dostępu. - Przykłady naturalnych produktów spiro i ich syntezy: Smith, Laura K. & Baxendale, Ian R. (2015). „Całkowita synteza produktów naturalnych zawierających spirokarbocykle” . Org. Biomol. chemia . 13 (39): 9907–9933. doi : 10.1039/C5OB01524C . PMID 26356301 .
-
Rios, Ramon (2012). „Enancjoselektywne metodologie syntezy związków spiro”. chemia soc. Rev. (druk, online) . 41 (3): 1060–1074. doi : 10.1039/C1CS15156H . PMID 21975423 .
{{ cytuj czasopismo }}:|format=wymaga|url=( pomoc ) -
Dokumenty IUPAC dotyczące nazewnictwa związków spiro:
Moss, GP i Grupa Robocza Międzynarodowej Unii Chemii Czystej i Stosowanej [IUPAC], Organic Chemistry Division, Commission on Nomenclature of Organic Chemistry (III.1) (1999). „Rozszerzenie i rewizja nomenklatury związków spiro (zalecenia IUPAC 1999)” (PDF) . czysta aplikacja chemia 71 (3): 531–558. doi : 10.1351/pac199971030531 . ISSN 1365-3075 . S2CID 20131819 . Źródło 3 lutego 2016 .
{{ cite journal }}: CS1 maint: używa parametru autorów ( link ) Pełna lista autorów (Grupy Roboczej) oraz link do niemieckiego tłumaczenia znajdują się w odpowiednim przypisie. Dostępne również w Internecie pod adresem „Rozszerzenie i rewizja nomenklatury dla związków Spiro” . Londyn, GBR: Queen Mary University of London. , ta sama data dostępu.