Fikoerytryna
| Fikoerytryna, | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identyfikatory łańcuchów alfa/beta | |||||||||
| Symbol | Phycoerythr_ab | ||||||||
| Pfam | PF02972 | ||||||||
| InterPro | IPR004228 | ||||||||
| SCOP2 | 1qgw / ZAKRES / SUPFAM | ||||||||
| |||||||||
Fikoerytryna ( PE ) to czerwony kompleks białkowo- pigmentowy z rodziny fikobiliprotein zbierających światło , obecny w sinicach, czerwonych algach i kryptofitach , akcesorium do głównych pigmentów chlorofilowych odpowiedzialnych za fotosyntezę . Czerwony pigment pochodzi z grupy prostetycznej, fikoerytrobiliny, która nadaje fikoerytrynie czerwony kolor.
Podobnie jak wszystkie fikobiliproteiny, składa się z części białkowej kowalencyjnie wiążącej chromofory zwane fikobilinami . W rodzinie fikoerytryny najbardziej znane fikobiliny to: fikoerytrobilina , typowy chromofor akceptorowy fikoerytryny. Fikoerytrobilina to liniowa cząsteczka tetrapirolu występująca w sinicach, czerwonych algach i kryptomonadach. Wraz z innymi bilinami, takimi jak fikocyjanobilina, służy jako pigment zbierający światło w fotosyntetycznych strukturach zbierających światło cyjanobakterii zwanych fikobilisomami. Fikoerytryny składają się z monomerów (αβ), zwykle ułożonych w kształcie dysku trimer (αβ) 3 lub heksamer (αβ) 6 (drugi to jednostka funkcjonalna prętów antenowych ). Te typowe kompleksy zawierają również trzeci typ podjednostki, łańcuch γ.
Fikobilisomy

Fikobiliproteiny są częścią ogromnych kompleksów białkowych anten zbierających światło, zwanych fikobilisomami . U krasnorostów są one zakotwiczone po stronie zrębu błon tylakoidów chloroplastów , podczas gdy u kryptofitów fikobilisomy są zredukowane i (tutaj cząsteczki fikobiliproteiny 545 PE545) są gęsto upakowane w świetle tylakoidów.
Fikobiliproteiny mają wiele praktycznych zastosowań, w tym właściwości nadrzędne, takie jak hepatoochronne, przeciwutleniające, przeciwzapalne i przeciwstarzeniowe działanie PBP, umożliwiają ich zastosowanie w przemyśle spożywczym, kosmetycznym, farmaceutycznym i biomedycznym. Zauważono również, że PBP wykazują korzystny wpływ w leczeniu niektórych chorób, takich jak choroba Alzheimera i rak.
Fikoerytryna jest pigmentem pomocniczym do głównych barwników chlorofilowych odpowiedzialnych za fotosyntezę . Energia świetlna jest wychwytywana przez fikoerytrynę, a następnie przekazywana do centrum reakcji pary chlorofilu, przez większość czasu przez fikobiliproteiny, fikocyjaninę i allofikocyjaninę .
Charakterystyka strukturalna
Fikoerytryny, z wyjątkiem fikoerytryny 545 (PE545), składają się z monomerów (αβ) połączonych w heksamery (αβ) 6 lub (αβ) 3 w kształcie dysku o symetrii 32 lub 3 i obejmujące centralny kanał. W fikobilisomach (PBS) każdy trimer lub heksamer zawiera co najmniej jedno białko łącznikowe zlokalizowane w kanale centralnym. B-fikoerytryna (B-PE) i R-fikoerytryna (R-PE) z czerwonych alg oprócz łańcuchów α i β mają trzecią podjednostkę γ, która pełni funkcje zarówno łącznika, jak i zbierania światła, ponieważ zawiera chromofory.

2− 4 .
R-fikoerytryna jest produkowana głównie przez czerwone algi. Białko składa się z co najmniej trzech różnych podjednostek i różni się w zależności od gatunku glonów, które je wytwarzają. Struktura podjednostki najpowszechniejszego R-PE to (αβ) 6 γ. Podjednostka α ma dwie fikoerytrobiliny (PEB), podjednostka β ma 2 lub 3 PEB i jedną fikurobilinę (PUB), podczas gdy różne podjednostki gamma mają 3 PEB i 2 PUB (γ1) lub 1 lub 2 PEB i 1 PUB ( γ2 ) . Masa cząsteczkowa R-PE wynosi 250 000 Daltonów.
Struktury krystaliczne dostępne w Protein Data Bank zawierają w jednej (αβ) 2 lub (αβγ) 2 asymetrycznej jednostce różne fikoerytryny:

|
Chromofor lub inna cząsteczka niebiałkowa |
Fikoerytryna | Łańcuch | |||
|---|---|---|---|---|---|
| PE545 | B-PE | R-PE | inne rodzaje | ||
| biliny | 8 | 10 | 10 | 10 | α i β |
| - Fikoerytrobilina (PEB) | 6 | 10 | 0 lub 8 | 8 |
β (PE545) lub α i β |
| - 15,16-dihydrobiliwerdyna ( DBV) | 2 | — | — | — | α (-3 i -2) |
| - Fikocyjanobilina (CYC) | — | — | 8 lub 7 lub 0 | — | α i β |
| - Biliwerdyna IX alfa (BLA) | — | — | 0 lub 1 | — | α |
| - fikurobilina (PUB) | — | — | 2 | 2 | β |
| 5-hydroksylizyna (LYZ) | 1 lub 2 | — | — | — |
α (-3 lub -3 i -2) |
| N-metyloasparagina (MEN) | 2 | 2 | 0 lub 2 | 2 | β |
| siarczanowy SO 4 2− (SO4) | — | 5 lub 1 | 0 lub 2 | — | α lub α i β |
| chlorkowy Cl - (CL) | 1 | — | — | — | β |
| magnezu Mg 2+ (MG) | 2 | — | — | — | α-3 i β |
| sprawdzone pliki PDB |
1XG0 1XF6 1QGW |
3V57 3V58 |
1EYX 1LIA 1B8D |
2VJH | |

Zakładana biologiczna cząsteczka fikoerytryny 545 (PE545) to (αβ) 2 a raczej (α 3 β)(α 2 β) . Cyfry 2 i 3 po literach α w drugim wzorze są tutaj częścią nazw łańcuchowych, a nie ich liczebnością. Synonimowa kryptofitowa nazwa łańcucha α 3 to łańcuch α 1 .
Największym zespołem B-fikoerytryny (B-PE) jest (αβ) 3 trimer. Jednak preparaty z czerwonych alg dają również (αβ) 6 heksamer . W przypadku R-fikoerytryny (R-PE) największą zakładaną cząsteczką biologiczną jest tutaj (αβγ) 6 , (αβγ) 3 (αβ) 3 lub (αβ) 6 w zależności od publikacji, dla innych rodzajów fikoerytryny (αβ) 6 . Te łańcuchy γ z Protein Data Bank są bardzo małe i składają się tylko z trzech lub sześciu rozpoznawalnych aminokwasów, podczas gdy opisany na początku tego rozdziału łącznik łańcucha γ jest duży (np. 277 aminokwasów o długości 33 kDa w przypadku γ 33 z czerwonych alg Aglaothamnion zaniedbania ) . Dzieje się tak, ponieważ gęstość elektronów polipeptydu gamma jest w większości uśredniana przez jego potrójną symetrię krystalograficzną i można modelować tylko kilka aminokwasów.
Dla (αβγ) 6 , (αβ) 6 lub (αβγ) 3 (αβ) 3 wartości z tabeli należy po prostu pomnożyć przez 3, (αβ) 3 zawiera pośrednie liczby cząsteczek niebiałkowych. (ten non sequitur musi zostać poprawiony)
W powyższej fikoerytrynie PE545 jeden łańcuch α (-2 lub -3) wiąże jedną cząsteczkę biliny, w innych przykładach wiąże dwie cząsteczki. Łańcuch β zawsze wiąże się z trzema cząsteczkami. Mały łańcuch γ nie wiąże się z żadnym.
Dwie cząsteczki N -metyloasparaginy są związane z łańcuchem β, jedna 5-hydroksylizyna z α (-3 lub -2), jedna Mg 2+ z α-3 i β, jedna Cl − z β, 1–2 cząsteczki SO
2− 4 z α lub β.
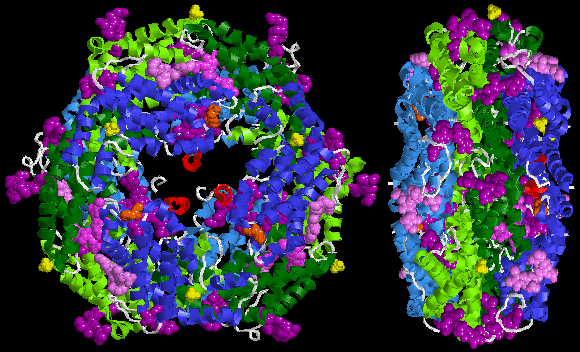
Poniżej znajduje się przykładowa struktura krystaliczna R-fikoerytryny z Protein Data Bank :

Charakterystyka widmowa
Piki absorpcji w widmie światła widzialnego są mierzone przy 495 i 545/566 nm, w zależności od związanych chromoforów i badanego organizmu. Silny pik emisji występuje przy 575 ± 10 nm. (fikoerytryna pochłania lekko niebiesko-zielone/żółtawe światło i emituje lekko pomarańczowo-żółte światło.)
| Nieruchomość | Wartość |
|---|---|
| Maksymalna absorpcja | 565 nm |
| Dodatkowy pik absorpcji | 498 nm |
| Maksymalna emisja | 573 nm |
| Współczynnik ekstynkcji ( ε ) | 1,96 × 10 6 M -1 cm -1 |
| Wydajność kwantowa (QY) | 0,84 |
| Jasność ( ε × QY) | 1,65 × 10 6 M -1 cm -1 |
Biliny PEB i DBV w PE545 również absorbują w zielonym obszarze widmowym, z maksimami odpowiednio przy 545 i 569 nm. Maksimum emisji fluorescencji występuje przy 580 nm.
Odmiany R-fikoerytryny
Jak wspomniano powyżej, fikoerytrynę można znaleźć w różnych gatunkach alg. W związku z tym mogą występować różnice w wydajności absorbancji i emisji światła wymaganego do ułatwienia fotosyntezy. Może to wynikać z głębokości w słupie wody, na której zwykle przebywają określone algi, i wynikającej z tego potrzeby większej lub mniejszej wydajności pigmentów pomocniczych.
Dzięki postępom w technologii obrazowania i wykrywania, które pozwalają uniknąć szybkiego fotowybielania, fluorofory białkowe stały się opłacalnym i potężnym narzędziem dla naukowców w takich dziedzinach, jak mikroskopia, analiza mikromacierzy i Western blotting. W świetle tego korzystne może być dla naukowców zbadanie tych zmiennych R-fikoerytryny w celu określenia, która z nich jest najbardziej odpowiednia do ich konkretnego zastosowania. Nawet niewielki wzrost wydajności fluorescencji może zmniejszyć szum tła i zmniejszyć odsetek wyników fałszywie ujemnych.
Praktyczne zastosowania
R-fikoerytryna (znana również jako PE lub R-PE) jest przydatna w laboratorium jako fluorescencyjny wskaźnik obecności sinic oraz do znakowania przeciwciał , najczęściej do cytometrii przepływowej . Jest również używany w testach mikromacierzy, testach ELISA i innych zastosowaniach wymagających wysokiej czułości, ale nie fotostabilności. Jego zastosowanie jest ograniczone w immunofluorescencyjnej ze względu na szybkie fotowybielanie cechy. Istnieją również inne rodzaje fikoerytryny, takie jak B-fikoerytryna, które mają nieco inne właściwości spektralne. B-fikoerytryna silnie absorbuje przy około 545 nm (lekko żółtawo-zielona) i zamiast tego silnie emituje przy 572 nm (żółta) i mogłaby lepiej pasować do niektórych instrumentów. B-fikoerytryna może być również mniej „lepka” niż R-fikoerytryna i w mniejszym stopniu przyczynia się do sygnału tła z powodu nieswoistego wiązania w niektórych zastosowaniach. [ Potrzebne źródło ] Jednak R-PE jest znacznie częściej dostępny jako koniugat przeciwciała. Fikoerytryna (PE, λA max = 540-570 nm; λF max = 575-590 nm)
R-fikoerytryna i B-fikoerytryna należą do najjaśniejszych barwników fluorescencyjnych, jakie kiedykolwiek zidentyfikowano.
Linki zewnętrzne
- Fikoerytryna w US National Library of Medicine Medical Subject Headings (MeSH)