Fikocyjanina
| Białko fikobilisomu | |||||||||
|---|---|---|---|---|---|---|---|---|---|
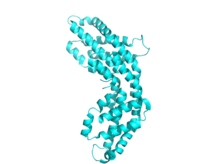
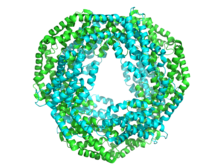
 Allofikocyjanina 12-mer PDB 1all
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Fikobilisom | ||||||||
| Pfam | PF00502 | ||||||||
| InterPro | IPR001659 | ||||||||
| SCOP2 | 1cpc / ZAKRES / SUPFAM | ||||||||
| |||||||||
Fikocyjanina to kompleks pigmentowo -białkowy z rodziny fikobiliprotein zbierających światło , wraz z allofikocyjaniną i fikoerytryną . Jest pigmentem pomocniczym do chlorofilu . Wszystkie fikobiliproteiny są rozpuszczalne w wodzie, więc nie mogą istnieć w błonie, tak jak karotenoidy . Zamiast tego fikobiliproteiny gromadzą się, tworząc skupiska przylegające do błony zwane fikobilisomami . Fikocyjanina ma charakterystyczny jasnoniebieski kolor, pochłania światło pomarańczowe i czerwone, zwłaszcza w okolicach 620 nm (w zależności od tego, jaki to konkretny typ) i emituje fluorescencję przy około 650 nm (również w zależności od tego, jaki to jest typ). Allofikocyjanina absorbuje i emituje fale o większej długości niż fikocyjanina C lub fikocyjanina R. Fikocyjaniny znajdują się w sinicach (zwanych także sinicami ). Fikobiliproteiny mają właściwości fluorescencyjne, które są używane w do testów immunologicznych . Fikocyjanina pochodzi od greckiego phyco oznaczającego „ algi ” i cyjaninę pochodzi od angielskiego słowa „ cyan ”, które umownie oznacza odcień niebiesko-zielonego (zbliżony do „aqua”) i pochodzi od greckiego „ kyanos ”, co oznacza nieco inny kolor: „ciemnoniebieski”. Produkt fikocyjanina, wytwarzany przez Aphanizomenon flos-aquae i Spirulina , jest na przykład stosowany w przemyśle spożywczym jako naturalny barwnik „Lina Blue” lub „EXBERRY Shade Blue” i znajduje się w słodyczach i lodach. Ponadto wykrywanie fluorescencji pigmentów fikocyjaniny w próbkach wody jest przydatną metodą monitorowania biomasy sinic.
Fikobiliproteiny składają się z dwóch podjednostek (alfa i beta) mających szkielet białkowy, z którym kowalencyjnie związanych jest 1-2 liniowych chromoforów tetrapirolowych.
C-fikocyjanina często występuje w sinicach, które rozwijają się wokół gorących źródeł, ponieważ może być stabilna do około 70 ° C, z identycznymi zachowaniami spektroskopowymi (pochłaniającymi światło) w 20 i 70 ° C. Termofile zawierają nieco inne sekwencje aminokwasowe, dzięki czemu są stabilne w tych wyższych warunkach. Masa cząsteczkowa wynosi około 30 000 Da. Wykazano, że stabilność tego białka in vitro w tych temperaturach jest znacznie niższa. Analiza fotospektralna białka po 1 minucie ekspozycji na warunki 65°C w stanie oczyszczonym wykazała 50% utratę struktury trzeciorzędowej.
Struktura
Fikocyjanina ma wspólny motyw strukturalny ze wszystkimi fikobiliproteinami . Struktura zaczyna się od złożenia monomerów fikobiliproteiny, które są heterodimerami złożonymi z podjednostek α i β oraz ich odpowiednich chromoforów połączonych wiązaniem tioeterowym .
Każda podjednostka składa się zazwyczaj z ośmiu α-helis . Monomery spontanicznie agregują, tworząc trimery w kształcie pierścienia (αβ) 3 , które mają symetrię obrotową i centralny kanał. Trimery łączą się w pary, tworząc heksamery (αβ) 6 , czasami wspomagane przez dodatkowe białka łącznikowe. Każdy pręcik fikobilisomu ma na ogół dwa lub więcej heksamerów fikocyjaniny. Pomimo ogólnego podobieństwa w strukturze i montażu fikobiliprotein, istnieje duża różnorodność konformacji heksamerów i pręcików, nawet jeśli bierze się pod uwagę tylko fikocyjaniny. Na większą skalę różnią się również fikocyjaniny struktura krystaliczna , chociaż biologiczne znaczenie tego jest dyskusyjne.
Na przykład struktura C-fikocyjaniny z Synechococcus vulcanus została udoskonalona do rozdzielczości 1,6 angstremów . Monomer (αβ) składa się z 332 aminokwasów i 3 cząsteczek kofaktora fikocyjanobiliny (PCB) połączonych wiązaniami tio. Obie podjednostki α i β mają PCB w aminokwasie 84, ale podjednostka β ma również dodatkową PCB w pozycji 155. Ta dodatkowa PCB jest skierowana na zewnątrz pierścienia trimerycznego i dlatego bierze udział w przenoszeniu energii między prętami w kompleksie fikobilisomu. Oprócz kofaktorów istnieje wiele przewidywalnych niekowalencyjnych interakcji z otaczającym rozpuszczalnikiem (wodą), które, jak przypuszcza się, przyczyniają się do stabilności strukturalnej.
R-fikocyjanina II (R-PC II) występuje w niektórych gatunkach Synechococcus . Uważa się, że R-PC II jest pierwszym zawierającym PEB fikocyjaniną pochodzącą z sinic. Jego oczyszczone białko składa się z podjednostek alfa i beta w równych ilościach. R-PC II ma PCB w pozycji beta-84 i fikoerytrobiliny (PEB) w pozycji alfa-84 i beta-155.
Protein Data Bank zdeponowano 44 struktury krystaliczne fikocyjaniny .
Charakterystyka widmowa
C-fikocyjanina ma pojedynczy pik absorpcji przy ~ 621 nm, zmieniający się nieznacznie w zależności od organizmu i warunków, takich jak temperatura, pH i stężenie białka in vitro . Jego maksimum emisji wynosi ~ 642 nm. Oznacza to, że pigment pochłania światło pomarańczowe, a emituje światło czerwonawe. R-fikocyjanina ma maksima absorpcji przy 533 i 544 nm. Maksimum emisji fluorescencji R-fikocyjaniny wynosi 646 nm.
| Nieruchomość | C-fikocyjanina | R-fikocyjanina |
|---|---|---|
| Maksimum absorpcji (nm) | 621 | 533, 544 |
| Maksymalna emisja (nm) | 642 | 646 |
| Współczynnik ekstynkcji (ε) | 1,54x10 6 M -1 cm -1 | - |
| Wydajność kwantowa | 0,81 | - |
Znaczenie ekologiczne
Fikocyjanina jest wytwarzana przez wiele fotoautotroficznych sinic. Nawet jeśli cyjanobakterie mają duże stężenia fikocyjaniny, produktywność w oceanie jest nadal ograniczona ze względu na warunki świetlne.
Fikocyjanina ma znaczenie ekologiczne we wskazywaniu zakwitu sinic. Zwykle chlorofil a jest używany do określania liczby sinic, jednak ponieważ występuje w wielu grupach fitoplanktonu, nie jest to miara idealna. Na przykład w badaniu w Morzu Bałtyckim wykorzystano fikocyjaninę jako marker nitkowatych cyjanobakterii podczas toksycznych letnich zakwitów. Niektóre organizmy nitkowate w Morzu Bałtyckim to Nodularia spumigena i Aphanizomenon flosaquae .
Ważną sinicą zwaną spiruliną ( Arthrospira platensis ) jest mikroalga produkująca C-PC.
Istnieje wiele różnych metod produkcji fikocyjaniny, w tym produkcja fotoautotroficzna, miksotroficzna, heterotroficzna i rekombinacyjna. Fotoautotroficzna produkcja fikocyjaniny ma miejsce, gdy kultury sinic są hodowane w otwartych stawach w regionach subtropikalnych lub tropikalnych. Miksotroficzna produkcja glonów polega na tym, że glony są hodowane na kulturach, które mają organiczne źródło węgla, takie jak glukoza . Stosowanie produkcji miksotroficznej zapewnia wyższe tempo wzrostu i wyższą biomasę w porównaniu ze zwykłym stosowaniem kultury fotoautotroficznej. W hodowli miksotroficznej suma wzrostu heterotroficznego i autotroficznego osobno była równa wzrostowi miksotroficznemu. Heterotroficzna produkcja fikocyjaniny nie jest ograniczona światłem, zgodnie z jej definicją. Galdieria sulphuraria to jednokomórkowy rodofit , który zawiera dużą ilość C-PC i niewielką ilość allofikocyjaniny . G. sulphuraria jest przykładem heterotroficznej produkcji C-PC, ponieważ jej siedliskiem są gorące, kwaśne źródła i wykorzystuje do wzrostu wiele źródeł węgla. Rekombinowana produkcja C-PC jest kolejną metodą heterotroficzną i obejmuje inżynierię genową.
Grzyby tworzące porosty i cyjanobakterie często mają związek symbiotyczny, a zatem markery fikocyjaninowe można wykorzystać do pokazania ekologicznego rozmieszczenia sinic związanych z grzybami. Jak pokazano w wysoce specyficznym związku między Lichina a szczepami Rivularia , fikocyjanina ma wystarczającą rozdzielczość filogenetyczną, aby rozwiązać ewolucyjną historię grupy na północno-zachodnim wybrzeżu Oceanu Atlantyckiego .
Biosynteza
Dwa geny cpcA i cpcB, zlokalizowane w operonie cpc i poddane translacji z tego samego transkryptu mRNA, kodują odpowiednio łańcuchy α i β C-PC. Dodatkowe elementy, takie jak białka łącznikowe i enzymy zaangażowane w syntezę fikobiliny i fikobiliproteiny, są często kodowane przez geny w sąsiednich klastrach genów, a operon cpc Arthrospira platensis koduje również białko łącznikowe pomagające w składaniu kompleksów C-PC. W czerwonych algach geny fikobiliproteiny i białka łącznika znajdują się na genomie plastydu.
Fikocyjanobilina jest syntetyzowana z hemu i wstawiana do apo-białka C-PC w trzech etapach enzymatycznych. Cykliczny hem jest utleniany do liniowej biliwerdyny IXα przez oksygenazę hemową i dalej przekształcany w 3Z-fikocyjanobilinę, dominujący izomer fikocyjanobiliny, przez oksydoreduktazę 3Z-fikocyjanobiliny:ferredoksyny. Wstawienie 3Z-fikocyjanobiliny do apo-białka C-PC poprzez tworzenie wiązania tioeterowego jest katalizowane przez liazę fikocyjanobilinową.
Promotor operonu cpc znajduje się w regionie powyżej 427 pz genu cpcB. W A. platensis zidentyfikowano 6 domniemanych sekwencji promotorowych w regionie, przy czym cztery z nich wykazują ekspresję zielonego białka fluorescencyjnego po transformacji do E. coli . Wykazano również obecność innych pozytywnych elementów, takich jak elementy reagujące na światło w tym samym regionie.
Wiele sekwencji promotora i elementu odpowiedzi w operonie cpc umożliwia sinicom i krasnorostom dostosowanie swojej ekspresji w odpowiedzi na wiele warunków środowiskowych. Ekspresja genów cpcA i cpcB jest regulowana przez światło. Niskie natężenie światła stymuluje syntezę CPC i innych pigmentów, podczas gdy synteza pigmentu jest tłumiona przy wysokim natężeniu światła. Wykazano również, że temperatura wpływa na syntezę, przy czym określone stężenia pigmentu wykazują wyraźne maksimum w temperaturze 36 ° C w przypadku Arthronema africanum, cyjanobakterii o szczególnie wysokiej zawartości C-PC i APC.
Ograniczenie azotu i żelaza powoduje degradację fikobiliproteiny. Źródła węgla organicznego stymulują syntezę C-PC u Anabaena spp., ale wydają się nie mieć prawie żadnego negatywnego wpływu na efektor u A. platensis. U rodofitów Cyanidium caldarium i Galdieria sulphuraria produkcja C-PC jest hamowana przez glukozę, ale stymulowana przez hem.
Biotechnologia
Czyste ekstrakty fikocyjaniny można izolować z alg. Podstawowa kolejność segregacji jest następująca. Rozerwanie ściany komórkowej pod wpływem sił mechanicznych (zamrażanie i rozmrażanie) lub środków chemicznych (enzymy). Następnie C-PC jest izolowany przez wirowanie i oczyszczany przez wytrącanie siarczanem amonu lub chromatografię - filtrację jonową lub żelową . Następnie próbka zostaje zamrożona i wysuszona . .
Aplikacje
Fikocyjanina może być stosowana w wielu praktykach, w szczególności znajduje zastosowanie w medycynie i żywności. Może być również stosowany w genetyce, gdzie pełni rolę znacznika ze względu na swoją naturalną fluorescencję.
Medycyna
Przeciwutleniające i przeciwzapalne
Fikocyjanina ma zarówno właściwości przeciwutleniające, jak i przeciwzapalne. Rodniki nadtlenowe, hydroksylowe i alkoksylowe są utleniaczami wychwytywanymi przez C-PC. C-PC ma jednak większy wpływ na rodniki nadtlenowe. C-PC jest przeciwutleniaczem wiążącym metale, ponieważ zapobiega występowaniu peroksydacji lipidów. Rodniki nadtlenowe są stabilizowane przez chromofor (podjednostka C-PC). Aby usunąć rodniki hydroksylowe, należy to zrobić przy słabym oświetleniu i przy wysokim poziomie C-PC. Rodniki hydroksylowe znajdują się w zapalnych częściach ciała. C-PC, będąc przeciwutleniaczem, usuwa te rodniki wywołujące uszkodzenia, dzięki czemu jest środkiem przeciwzapalnym.
Neuroprotekcja
Nadmiar tlenu w mózgu generuje reaktywne formy tlenu (ROS). ROS powoduje uszkodzenia neuronów mózgu, prowadząc do udarów. C-fikocyjanina wychwytuje nadtlenek wodoru, rodzaj ROS, z wnętrza astrocytów , zmniejszając stres oksydacyjny. Astrocyty zwiększają również produkcję czynników wzrostu, takich jak BDNF i NDF, dzięki czemu poprawiają regenerację nerwów. C-PC zapobiega również astrogliozie i zapaleniu gleju.
Hepatoprotekcja
Stwierdzono, że C-fikocyjanina ma ochronę przed hepatotoksycznością. Vadiraja i in. (1998) stwierdzili wzrost aktywności aminotransferazy glutaminowo-pirogronowej (SGPT) w surowicy , gdy C-PC jest traktowane przeciwko heptatoksynom, takim jak tetrachlorek węgla (CCl4) lub R-(+)-pulegon. C-PC chroni wątrobę za pomocą cytochromu -P450 system. Może albo zaburzać produkcję mentofuranu, albo zaburzać powstawanie α,β-nienasyconego-γ-ketoaldehydu. Oba są kluczowymi składnikami układu cytochromu P-450, który wytwarza reaktywny metabolit, który wytwarza toksyny, gdy wiąże się z tkankami wątroby. Innym możliwym mechanizmem ochronnym C-PC może być wychwytywanie reaktywnych metabolitów (lub wolnych rodników, jeśli przyczyną jest CCl4).
Przeciwnowotworowe
C-fikocyjanina (C-PC) wykazuje działanie przeciwnowotworowe. Rak pojawia się, gdy komórki nadal rosną w sposób niekontrolowany. Stwierdzono, że C-PC zapobiega wzrostowi komórek. C-PC zatrzymuje powstawanie guza przed fazą S. Synteza DNA nie jest przeprowadzana, ponieważ komórka nowotworowa wchodzi do G0, co skutkuje brakiem proliferacji guza. Ponadto C-PC indukuje apoptozę. Gdy komórki są traktowane C-PC, powstają ROS (rodnikowe formy tlenu). Cząsteczki te zmniejszają produkcję BCl-2 (regulatora apoptozy). Tutaj BCl-2 hamuje białka zwane kaspazami. Kaspazy są częścią szlaku apoptozy. Gdy BCl-2 maleje, zwiększa się ekspresja kaspaz. W rezultacie dochodzi do apoptozy. Sam C-PC nie wystarczy do leczenia raka, musi działać z innymi lekami, aby przezwyciężyć uporczywość komórek nowotworowych.
Żywność
C-fikocyjanina (C-PC) może być stosowana jako naturalny niebieski barwnik spożywczy. Ten barwnik spożywczy może być stosowany wyłącznie do produktów przygotowywanych w niskich temperaturach ze względu na niezdolność do utrzymania niebieskiego zabarwienia w wysokich temperaturach, chyba że zawiera dodatek konserwantów lub cukrów. Rodzaj cukru nie ma znaczenia, C-PC jest stabilny, gdy zawartość cukru jest wysoka. Wiedząc o tym, C-PC można stosować do wielu rodzajów żywności, z których jednym są syropy. C-PC można stosować do syropów o barwie od zielonej do niebieskiej. Może mieć różne odcienie zieleni poprzez dodanie żółtych barwników spożywczych.
Dalsza lektura
- Barsanti L. (2008). „Dziwactwa i ciekawostki w świecie glonów” . W Evangelista V, Barsanti L, Frassanito AM, Passarelli V, Gualtieri P (red.). Toksyny glonów: natura, występowanie, wpływ i wykrywanie . NATO Science for Peace and Security Series A: Chemistry and Biology. Dordrecht: Springer. s. 353–391. doi : 10.1007/978-1-4020-8480-5_17 . ISBN 978-1-4020-8479-9 .