Synechococcus
|
|
| Synechococcus | |
|---|---|
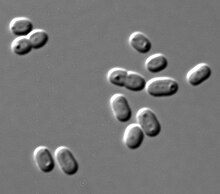
| Synechococcus PCC 7002 w mikroskopii DIC | |
| Klasyfikacja naukowa | |
| Domena: | Bakteria |
| Gromada: | Cyjanobakteria |
| Klasa: | sinice |
| Zamówienie: | Synechococcales |
| Rodzina: | Synechococcaceae |
| Rodzaj: |
Synechococcus Nägeli , 1849 |
| Gatunek | |
|
Patrz tekst |
|

Synechococcus (z greckiego synechos , kolejno i greckiego kokkos , granulka) to jednokomórkowa sinica , która jest bardzo rozpowszechniona w środowisku morskim . Jego wielkość waha się od 0,8 do 1,5 µm . Fotosyntetyczne komórki kokosowe są preferencyjnie znajdowane w dobrze oświetlonych wodach powierzchniowych , gdzie mogą być bardzo obfite (ogólnie 1000 do 200 000 komórek na ml) . Opisano również wiele słodkowodnych gatunków Synechococcus .
Genom szczepu PCC7002 S. elongatus ma rozmiar 3 008 047 pz , podczas gdy szczep oceaniczny WH8102 ma genom o wielkości 2,4 Mbp . [ potrzebne źródło ]
Wstęp
Synechococcus jest jednym z najważniejszych składników prokariotycznego autotroficznego pikoplanktonu w oceanach od umiarkowanego do tropikalnego . Rodzaj został po raz pierwszy opisany w 1979 roku i pierwotnie został zdefiniowany jako obejmujący „małe jednokomórkowe cyjanobakterie z jajowatymi lub cylindrycznymi komórkami, które rozmnażają się przez binarne rozszczepienie poprzeczne w jednej płaszczyźnie i nie mają osłonek”. Ta definicja rodzaju Synechococcus obejmowała organizmy o znacznej różnorodności genetycznej i została później podzielona na podgrupy na podstawie obecności dodatkowego pigmentu fikoerytryna . Morskie formy Synechococcus to komórki kokosowe o wielkości od 0,6 do 1,6 µm. Są to Gram-ujemne o silnie ustrukturyzowanych ścianach komórkowych, które mogą zawierać wypustki na ich powierzchni. Mikroskopia elektronowa często ujawnia obecność wtrąceń fosforanowych, glikogenu i, co ważniejsze, wysoce ustrukturyzowanych karboksysomów .
Wiadomo, że komórki są ruchliwe dzięki metodzie ślizgowej i nowatorskiej, niescharakteryzowanej, niefototaktycznej metodzie pływania, która nie obejmuje ruchu wici. Podczas gdy niektóre cyjanobakterie są zdolne do fotoheterotroficznego , a nawet chemoheterotroficznego , wszystkie morskie szczepy Synechococcus wydają się być bezwzględnymi fotoautotrofami, które są w stanie zaspokoić swoje zapotrzebowanie na azot przy użyciu azotanów, amoniaku lub w niektórych przypadkach mocznika jako jedynego źródła azotu. Tradycyjnie uważa się, że morskie Synechococcus nie wiążą azotu.
W ostatniej dekadzie wyprodukowano w laboratoriach kilka szczepów Synechococcus elongatus , w tym najszybciej rosnące dotychczas cyjanobakterie, Synechococcus elongatus UTEX 2973. S. elongatus UTEX 2973 jest zmutowaną hybrydą z UTEX 625 i jest najbliżej spokrewniony z S. elongatus PCC 7942 z 99,8% podobieństwem (Yu i in., 2015). Ma najkrótszy czas podwojenia wynoszący „1,9 godziny w ośrodku BG11 w temperaturze 41°C w ciągłym świetle białym o natężeniu 500 μmoli fotonów·m-2·s-1 z 3% CO2” (Racharaks i in., 2019).
Pigmenty
Głównym pigmentem fotosyntetycznym w Synechococcus jest chlorofil a , podczas gdy jego głównymi pigmentami pomocniczymi są fikobiliproteina . Cztery powszechnie rozpoznawane fikobiliny to fikocyjanina , allofikocyjanina , allofikocyjanina B i fikoerytryna . Ponadto Synechococcus zawiera również zeaksantynę , ale nie jest znany żaden pigment diagnostyczny dla tego organizmu. Zeaksantyna występuje również w czerwonych algach Prochlorococcus oraz jako drugorzędny pigment w niektórych chlorofitach i eustigmatofitach . Podobnie, fikoerytryna występuje również w różeńcach i niektórych kryptomonadach .
Filogeneza
Filogenetyczny opis Synechococcus jest trudny. Izolaty są morfologicznie bardzo podobne, ale wykazują zawartość G+C w zakresie od 39 do 71%, co ilustruje dużą różnorodność genetyczną tego tymczasowego taksonu. Początkowo próbowano podzielić grupę na trzy podgrupy, z których każda miała określony zakres genomowej zawartości G+C. Obserwacja, że same izolaty z otwartego oceanu prawie obejmują całe spektrum G+C, wskazuje jednak, że Synechococcus składa się z co najmniej kilku gatunków. Podręcznik Bergeya (Herdman i in. 2001) obecnie dzieli Synechococcus na pięć klastrów (odpowiadających rodzajom) w oparciu o morfologię, fizjologię i cechy genetyczne.
Klaster 1 obejmuje stosunkowo duże (1–1,5 µm) nieruchome fotoautotrofy obligatoryjne, które wykazują niską tolerancję na sól. Szczepy referencyjne dla tego klastra to PCC6301 (dawniej Anacycstis nidulans ) i PCC6312, które zostały wyizolowane odpowiednio ze słodkiej wody w Teksasie i Kalifornii . Klaster 2 charakteryzuje się również niską tolerancją na sól. Komórki są bezwzględnymi fotoautrotrofami, nie mają fikoerytryny i są termofilne. Szczep referencyjny PCC6715 wyizolowano z gorącego źródła w Parku Narodowym Yellowstone . Klaster 3 obejmuje pozbawionego fikoerytryny morskiego Synechococcus gatunki euryhalinowe , tj. zdolne do wzrostu zarówno w środowisku morskim, jak i słodkowodnym. Kilka szczepów, w tym szczep referencyjny PCC7003, jest fakultatywnymi heterotrofami i do wzrostu wymaga witaminy B12 . Klaster 4 zawiera pojedynczy izolat, PCC7335. Ten szczep jest bezwzględnie morski. Ten szczep zawiera fikoertrynę i został po raz pierwszy wyizolowany ze strefy międzypływowej w Puerto Peñasco w Meksyku . Ostatnia gromada zawiera coś, co wcześniej określano jako „morskie klastry A i B” Synechococcus . Komórki te są prawdziwie morskie i zostały odizolowane zarówno od wybrzeża, jak i od otwartego oceanu. Wszystkie szczepy są bezwzględnymi fotoautrofami i mają średnicę około 0,6–1,7 µm. Ta klaster jest jednak dalej podzielona na populację, która zawiera (klaster 5.1) lub nie zawiera (klaster 5.2) fikoerytryny. Szczepy referencyjne to WH8103 dla szczepów zawierających fikoerytrynę i WH5701 dla szczepów pozbawionych tego pigmentu.
Niedawno Badger i in. (2002) zaproponowali podział cyjanobakterii na podgrupę α- i β w oparciu o typ rbcL (duża podjednostka karboksylazy/oksygenazy rybulozo-1,5-bisfosforanu ) występujący w tych organizmach. Zdefiniowano, że α-cyjanobakterie zawierają postać IA, podczas gdy β-cyjanobakterie zdefiniowano jako zawierające postać IB tego genu. Na poparcie tego podziału Badger et al. przeanalizować filogenezę białek karboksysomalnych, które wydają się potwierdzać ten podział. Wydaje się również, że dwa szczególne systemy transportu wodorowęglanów można znaleźć tylko w α-cyjanobakteriach, które nie mają karboksysomalnych anhydraz węglanowych.
Pełne drzewo filogenetyczne sekwencji 16S rRNA Synechococcus ujawniło co najmniej 12 grup, które morfologicznie odpowiadają Synechococcus , ale nie pochodzą od wspólnego przodka. Ponadto oszacowano na podstawie datowania molekularnego, że pierwsza Synechococcus pojawiła się 3 miliardy lat temu w źródłach termalnych, a następnie napromieniowała środowiska morskie i słodkowodne.
Ekologia i dystrybucja
Zaobserwowano występowanie Synechococcus w stężeniach w zakresie od kilku komórek do 106 komórek na ml praktycznie we wszystkich regionach oceanicznej strefy eufotycznej, z wyjątkiem próbek z McMurdo Sound i Ross Ice Shelf na Antarktydzie . Komórki są na ogół znacznie liczniejsze w środowiskach bogatych w składniki odżywcze niż w oceanie oligotroficznym i preferują górną, dobrze oświetloną część strefy eufotycznej. Synechococcus zaobserwowano również występowanie w dużych ilościach w środowiskach o niskim zasoleniu i / lub niskich temperaturach. Prochlorococcus jest zwykle znacznie liczniejszy we wszystkich środowiskach, w których współwystępują. Wyjątkiem od tej reguły są obszary o stale wzbogaconych składnikach odżywczych, takie jak upwellingu i zlewiska przybrzeżne. W obszarach oceanów zubożonych w składniki odżywcze, takich jak centralne wiry, Synechococcus jest najwyraźniej zawsze obecny, chociaż tylko w niskich stężeniach, w zakresie od kilku do 4 × 103 komórek na ml. Pionowo Synechococcus jest zwykle stosunkowo równomiernie rozłożony w warstwie mieszanej i wykazuje powinowactwo do obszarów o wyższym natężeniu światła. Poniżej warstwy mieszanej stężenie komórek gwałtownie spada. Profile pionowe są silnie uzależnione od warunków hydrologicznych i mogą być bardzo zmienne zarówno sezonowo, jak i przestrzennie. Ogólnie rzecz biorąc, Synechococcus często odpowiada obfitości Prochlorococcus w słupie wody . Na Pacyfiku bogate w składniki odżywcze, o niskiej zawartości chlorofilu oraz w umiarkowanych morzach otwartych, gdzie niedawno ustalono stratyfikację, oba profile są równoległe do siebie i wykazują maksima obfitości prawie w pobliżu podpowierzchniowego maksimum chlorofilu.
Czynniki kontrolujące obfitość Synechococcus nadal pozostają słabo poznane, zwłaszcza biorąc pod uwagę, że nawet w najbardziej zubożonych w składniki odżywcze regionach centralnych wirów , gdzie obfitość komórek jest często bardzo niska, tempo wzrostu populacji jest często wysokie i nie jest drastycznie ograniczone. Czynniki takie jak wypas, śmiertelność wirusów, zmienność genetyczna, adaptacja do światła i temperatura, a także składniki odżywcze są z pewnością zaangażowane, ale pozostają do zbadania w rygorystycznej i globalnej skali. Pomimo niepewności prawdopodobnie istnieje związek między stężeniem azotu w otoczeniu a Synechococcus obfitość, z odwrotną zależnością do Prochlorococcus w górnej strefie eufotycznej , gdzie światło nie jest ograniczające. Jednym ze środowisk, w którym Synechococcus rozwija się szczególnie dobrze, są przybrzeżne pióropusze głównych rzek. Takie pióropusze są na wybrzeżu wzbogacone w składniki odżywcze, takie jak azotany i fosforany, które napędzają duże zakwity fitoplanktonu . Wysoka produktywność w przybrzeżnych smugach rzecznych jest często związana z dużymi populacjami Synechococcus i podwyższonym mRNA postaci IA (cyjanobakterii) rbcL .
Prochlorococcus występuje co najmniej 100 razy częściej niż Synechococcus w ciepłych wodach oligotroficznych. Zakładając średnie stężenia węgla w komórkach, oszacowano zatem, że Prochlorococcus stanowi co najmniej 22 razy więcej węgla w tych wodach, a zatem może mieć znacznie większe znaczenie dla globalnego obiegu węgla niż Synechococcus .
Historia ewolucyjna
Stwierdzono, że swobodnie unoszące się wirusy przenoszą geny fotosyntezy, a próbki Synechococcus zawierają białka wirusowe związane z fotosyntezą. Szacuje się, że 10% całej fotosyntezy na Ziemi odbywa się za pomocą genów wirusowych. Nie wszystkie wirusy natychmiast zabijają swoich gospodarzy, wirusy „umiarkowane” współistnieją ze swoim gospodarzem, dopóki stres lub zbliżający się koniec naturalnego okresu życia nie zmusi ich do przestawienia żywiciela na produkcję wirusów; jeśli wystąpi mutacja, która zatrzyma ten ostatni etap, gospodarz może przenosić geny wirusa bez żadnych złych skutków. A jeśli zdrowy żywiciel rozmnaża się, będąc zakaźnym, jego potomstwo również może być zakaźne. Jest prawdopodobne, że taki proces dał fotosyntezę Synechococcus.
Gatunek
- Synechococcus ambiguus Skuja
- Synechococcus arcuatus var. Calcicolus Fjerdingstad
- Synechococcus bigranulatus Skuja
- Synechococcus brunneolus Rabenhorst
- Synechococcus caldarius Okada
- Synechococcus capitatus A. E. Bailey-Watts & J. Komárek
- Synechococcus carcerarius Norris
- Synechococcus elongatus (Nägeli) Nägeli
- Synechococcus endogloeicus F. Hindák
- Synechococcus epigloeicus F. Hindak
- Synechococcus ferrunginosus Wawrik
- Synechococcus intermedius Gardner
- Synechococcus koidzumii Yoneda
- Synechococcus lividus Copeland
- Synechococcus marinus Jao
- Synechococcus minutissimus Negoro
- Synechococcus mundulus Skuja
- Synechococcus nidulans (Pringsheim) Komárek
- Synechococcus Rayssae Dor
- Synechococcus rhodobaktron Komárek & Anagnostidis
- Synechococcus roseo-persicinus Grunow
- Synechococcus roseo-purpureus GS West
- Synechococcus salinarum Komárek
- Synechococcus salinus Frémy
- Synechococcus sciophilus Skuja
- Synechococcus sigmoideus (Moore & Carter) Komárek
- Synechococcus spongiarum Usher i in.
- Synechococcus subsalsus Skuja
- Synechococcus sulphuricus Dor
- Synechococcus vantieghemii (Pringsheim) Bourrelly
- Synechococcus violaceus Grunow
- Synechococcus viridissimus Copeland
- Synechococcus vulcanus Copeland
Zobacz też
- Fotosyntetyczny pikoplankton
- prochlorokoki
- Gloeomargarita lithophora
- Synechocystis , inny organizm modelowy cyjanobakterii
Dalsza lektura
- L. Campbella; H. Liu; HA Nolla i D. Vaulot (1997). „Roczna zmienność fitoplanktonu i bakterii w subtropikalnym północnym Pacyfiku na stacji ALOHA podczas imprezy ENSO 1991-1994”. Badania głębinowe Część I . 44 (2): 167–192. Bibcode : 1997DSRI...44..167C . doi : 10.1016/S0967-0637(96)00102-1 .
- L. Campbella; HA Nolla i D. Vaulot (1994). „Znaczenie Prochlorococcus dla struktury społeczności w środkowej części północnego Pacyfiku”. Limnologii i Oceanografii . 39 (4): 954–961. Bibcode : 1994LimOc..39..954C . doi : 10.4319/lo.1994.39.4.0954 .
- F. Partensky; J. Blanchota; F. Lantoine; J. Neveux i D. Marie (1996). „Pionowa struktura pikofitoplanktonu w różnych miejscach troficznych tropikalnego północno-wschodniego Oceanu Atlantyckiego”. Badania głębinowe Część I . 43 (8): 1191–1213. Bibcode : 1996DSRI...43.1191P . doi : 10.1016/0967-0637(96)00056-8 .
- F. Partensky; L. Guillou; N. Simon i D. Vaulot (1997). „Najnowsze postępy w stosowaniu technik molekularnych do oceny różnorodności genetycznej morskich mikroorganizmów fotosyntetyzujących”. Vie et Milieu . 47 : 367–374.
- F. Partensky; WR Hess i D. Vaulot (1999b). „Prochlorococcus, morski fotosyntetyczny prokariot o globalnym znaczeniu” . Recenzje mikrobiologii i biologii molekularnej . 63 (1): 106–127. doi : 10.1128/MMBR.63.1.106-127.1999 . PMC 98958 . PMID 10066832 .
- F. Partensky; N. Hoepffnera; WKW Li; O. Ulloa i D. Vaulot (1993). „Fotoaklimatyzacja szczepów Prochlorococcus sp. (Prochlorophyta) izolowanych z północnego Atlantyku i Morza Śródziemnego” . Fizjologia roślin . 101 (1): 295–296. doi : 10.1104/pp.101.1.285 . PMC 158675 . PMID 12231684 .
- JB Waterbury; SW Watsona; FW Valois; DG Franków (1986a). „Biologiczna i ekologiczna charakterystyka morskiej jednokomórkowej cyjanobakterii Synechococcus ”. W WKW Li (red.). Fotosyntetyczny pikoplankton . Departament Rybołówstwa i Oceanów, Ottawa, Kanada. s. 71–120.
Linki zewnętrzne
- J. Komárek & MD Guiry (2006-07-17). " Synechococcus Nägeli 1849: 56" . Baza alg .