Fosforybozyloglicynoamido formylotransferazy
| Fosforybozyloglicynamid formylotransferazy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 GAR monomer formylotransferazy,
| |||||||||
| identyfikatory ludzkie | |||||||||
| nr WE | 2.1.2.2 | ||||||||
| nr CAS | 2604945 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| |||||||||
Formylotransferaza fosforybozyloglicynoamidu ( EC 2.1.2.2 , 5'-fosforanowa transformylaza 2-amino-N-rybozyloacetamidu , formylotransferaza GAR , transformylaza GAR , transformylaza rybonukleotydu glicynamidu , GAR TFaza , 5,10-metenylotetrahydrofolian: 2-amino-N-rybozyloacetami de transformylaza rybonukleotydowa ) to enzym o nazwie systematycznej 10-formylotetrahydrofolian:5'-fosforybozyloglicynamid N-formylotransferaza . Ten enzym katalizuje następującą reakcję chemiczną
- 10-formylotetrahydrofolian + N 1 - (5-fosfo-D-rybozylo) glicynoamid tetrahydrofolian + N 2- formylo-N 1 - (5-fosfo-D-rybozylo) glicynoamid
Ten enzym zależny od THF katalizuje nukleofilowe podstawienie acylowe grupy formylowej z 10-formylotetrahydrofolianu (fTHF) do N1- ( 5-fosfo-D-rybozylo)glicynamidu (GAR), z wytworzeniem N2- formylo -N1- ( 5-fosfo-D-rybozylo)glicynamidu (fGAR), jak pokazano powyżej. Ta reakcja odgrywa ważną rolę w tworzeniu puryn poprzez biosyntezy puryn de novo . Szlak ten tworzy monofosforan inozyny (IMP), prekursor monofosforanu adenozyny (AMP) i monofosforan guanozyny (GMP). AMP jest budulcem ważnych nośników energii, takich jak ATP, NAD + i FAD , oraz cząsteczek sygnałowych, takich jak cAMP . Rola GARTfase w de novo sprawia, że jest ona celem dla leków przeciwnowotworowych, a jej nadekspresja podczas rozwoju poporodowego została powiązana z zespołem Downa . Znane są dwa typy genów kodujących transformylazę GAR u E. coli: purN i purT, podczas gdy u ludzi występuje tylko purN. Wiele reszt w miejscu aktywnym jest konserwowanych przez enzymy bakteryjne, drożdżowe, ptasie i ludzkie.
Struktura enzymu
U ludzi GARTfaza jest częścią trójfunkcyjnego enzymu , który obejmuje również syntazę rybonukleotydową glicynamidu ( GARS ) i syntetazę rybonukleotydową aminoimidazolu ( AIRS ). Białko to (110 kDa) katalizuje etapy 2, 3 i 5 biosyntezy puryn de novo. Bliskość tych jednostek enzymu i elastyczność białka służy zwiększeniu przepustowości szlaku. GARTfaza znajduje się na C-końcu białka.
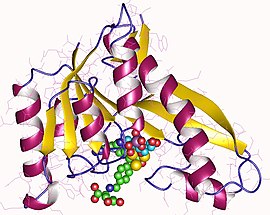
Ludzka GARTfase została skrystalizowana metodą siedzącej kropli z dyfuzją pary i zobrazowana w Stanford Synchrotron Radiation Laboratory (SSRL) przez co najmniej dwie grupy.
Strukturę można opisać za pomocą dwóch subdomen, które są połączone siedmiopasmowym arkuszem beta. Domena N-końcowa składa się z fałdu mononukleotydowego typu Rossmana, z czteroniciową częścią arkusza beta otoczoną z każdej strony dwiema helisami alfa. Arkusz beta przechodzi do domeny C-końcowej, gdzie z jednej strony jest pokryty długą helisą alfa, az drugiej jest częściowo wystawiony na działanie rozpuszczalnika. Jest to szczelina między dwiema subdomenami, w której znajduje się strona aktywna.
Szczelina składa się z miejsca wiązania GAR i kieszonki wiązania kwasu foliowego. Kieszeń wiążąca folian jest wyznaczona przez szczelinę wiążącą pterydynę, obszar przenoszenia formylu i region benzoiloglutaminianu, który wiąże główkę pterydyny i ogon benzoiloglutaminianu połączone przez azot fTHF związany z formylem. Ten region wiążący folany był przedmiotem wielu badań, ponieważ jego hamowanie przez małe cząsteczki doprowadziło do odkrycia leków przeciwnowotworowych. Wykazano, że pętla wiążąca folian zmienia konformację w zależności od pH roztworu i jako taka ludzka transformylaza GAR wykazuje najwyższą aktywność w okolicach pH 7,5-8. Warunki o niższym pH (~4,2) zmieniają również konformację pętli wiążących substrat (GAR).
Mechanizm
Mechanizm purN GARTfase
Klein i wsp. jako pierwsi zasugerowali mechanizm wspomagany cząsteczkami wody. Pojedyncza cząsteczka wody prawdopodobnie utrzymywana na miejscu przez wiązanie wodorowe z grupą karboksylanową trwałej reszty Asp144 przenosi protony z GAR-N do THF-N. Nukleofilowy azot na końcowej grupie aminowej GAR atakuje węgiel karbonylowy grupy formylowej na THF, wypychając ładunek ujemny na tlen. Klein sugeruje, że His108 stabilizuje stan przejściowy poprzez wiązanie wodorowe z ujemnie naładowanym tlenem i że reformacja podwójnego wiązania karbonylowego skutkuje zerwaniem wiązania THF-N - formyl. Obliczenia przeprowadzone przez Qiao i in. sugerują, że stopniowy transfer protonów wspomagany wodą z Gar-N do THF-N jest o 80-100 kj/mol korzystniejszy niż skoordynowany transfer sugerowany przez Kleina. Pokazany mechanizm jest sugerowany przez Qiao i wsp., którzy wprawdzie nie uwzględnili otaczających pozostałości w swoich obliczeniach. Znaczna część wczesnego mapowania miejsc aktywnych na GAR TFase została określona za pomocą enzymu bakteryjnego ze względu na ilość dostępną z jego nadekspresji w E. coli. Zastosowanie analogu powinowactwa z bromoacetylo dideazafolanem James Inglese i współpracownicy po raz pierwszy zidentyfikowali Asp144 jako pozostałość miejsca aktywnego, prawdopodobnie zaangażowaną w mechanizm przenoszenia formylu.
Mechanizm purT GARTfase
Badania wariantu purT transformylazy GAR w E. coli wykazały, że reakcja przebiega przez pośredni fosforan formylu. Chociaż reakcja in vitro może przebiegać bez THF, ogólnie reakcja in vivo jest taka sama.
Zaangażowanie w biosyntezę puryn de novo
GART katalizuje trzeci etap biosyntezy puryn de novo , tworzenie N2 - formylo-N1- ( 5-fosfo-D-rybozylo)glicynamidu (fGAR) przez addycję formylu do N1- ( 5-fosfo-D-rybozylo)glicynamidu (GAR). W E. coli enzym purN jest białkiem o masie 23 kDa, ale u ludzi jest częścią trójfunkcyjnego białka o masie 110 kDa, które obejmuje funkcje AIRS i GARS. Białko to katalizuje trzy różne etapy szlaku de novo .
Istotność choroby
Cel raka
Ze względu na zwiększone tempo wzrostu i wymagania metaboliczne, komórki nowotworowe polegają na biosyntezie nukleotydów de novo , aby osiągnąć niezbędne poziomy AMP i GMP. Możliwość zablokowania któregokolwiek z etapów de novo oznaczałaby znaczne ograniczenie wzrostu guza. Przeprowadzono badania zarówno wiązania substratu, jak i miejsca wiązania kwasu foliowego w celu znalezienia inhibitorów.
Zespół Downa
Podejrzewa się, że GARTfase ma związek z zespołem Downa. Gen kodujący trójfunkcyjne białko ludzkie GARS-AIRS-GART znajduje się na chromosomie 21q22.1, w regionie krytycznym zespołu Downa. Białko ulega nadekspresji w móżdżku podczas postnatalnego rozwoju osób z zespołem Downa. Zazwyczaj białko to jest niewykrywalne w móżdżku krótko po urodzeniu, ale występuje w dużych ilościach w rozwoju prenatalnym.
Zobacz też
Linki zewnętrzne
- Fosforybozyloglicynamid + formalotransferaza w US National Library of Medicine Medical Subject Headings (MeSH)