Karbamoilotransferaza asparaginianowa
| Karbamoilotransferaza asparaginianowa | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Karbamoilotransferaza asparaginianowa z Escherichia coli . WPB 2ATC.
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 2.1.3.2 | ||||||||
| nr CAS | 9012-49-1 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
| Ludzka syntetaza karbamoilofosforanowa 2, transkarbamoilaza asparaginianowa, dihydroorotaza | |||||||
|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||
| Symbol | CHAM | ||||||
| gen NCBI | 790 | ||||||
| HGNC | 1424 | ||||||
| OMIM | 114010 | ||||||
| RefSeq | NM_004341 | ||||||
| UniProt | P27708 | ||||||
| Inne dane | |||||||
| numer WE | 2.1.3.2 | ||||||
| Umiejscowienie | Chr. 2 s22-s21 | ||||||
| |||||||
Karbamoilotransferaza asparaginianowa (znana również jako transkarbamoylaza asparaginianowa lub ATCaza ) katalizuje pierwszy etap szlaku biosyntezy pirymidyn ( EC 2.1.3.2 ).
W E. coli enzym jest wielopodjednostkowym kompleksem białkowym składającym się z 12 podjednostek (łącznie 300 kDa). Skład podjednostek to C 6 R 6 , tworząc 2 trimery podjednostek katalitycznych (34 kDa) i 3 dimery podjednostek regulatorowych (17 kDa). Szczególny układ podjednostek katalitycznych i regulatorowych w tym enzymie daje kompleks z silnie allosteryczną zachowanie w stosunku do swoich podłoży. Enzym jest archetypowym przykładem allosterycznej modulacji precyzyjnej kontroli metabolicznych reakcji enzymatycznych.
ATCase nie jest zgodna z kinetyką Michaelisa-Mentena . Zamiast tego leży pomiędzy jego „napiętymi” stanami o niskiej aktywności i niskim powinowactwie a „zrelaksowanymi” stanami o wysokiej aktywności i wysokim powinowactwie. Związanie substratu z podjednostkami katalitycznymi powoduje przesunięcie równowagi w kierunku stanu R, natomiast związanie CTP z podjednostkami regulatorowymi powoduje przesunięcie równowagi w kierunku stanu T. Wiązanie ATP z podjednostkami regulatorowymi powoduje przesunięcie równowagi w kierunku stanu R.
Reakcja
ATCaza jest wysoce regulowanym enzymem, który katalizuje pierwszy etap biosyntezy pirymidyny, kondensację l-asparaginianu i fosforanu karbamoilu w celu utworzenia N-karbamylo-L-asparaginianu i nieorganicznego fosforanu . Kataliza przez ATCazę służy jako etap ograniczający szybkość biosyntezy pirymidyny, ponieważ zmienia jej prędkość katalityczną w odpowiedzi na poziomy komórkowe zarówno pirymidyn , jak i puryn . Produkt końcowy szlaku pirymidynowego, CTP , zmniejsza prędkość katalityczną, podczas gdy ATP , produkt końcowy równoległego szlaku purynowego, zwiększa prędkość katalityczną. 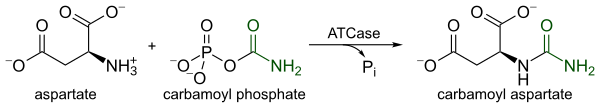
Struktura
Poniższe omówienie struktury, centrum katalitycznego i miejsca allosterycznego jest oparte na prokariotycznej wersji ATCazy, w szczególności E. coli .
Wczesne badania wykazały, że ATCaza składa się z dwóch różnych rodzajów łańcuchów polipeptydowych , które pełnią różne role. Podjednostki katalityczne katalizują karbamylację grupy aminowej asparaginianu , ale nie mają właściwości regulatorowych, podczas gdy podjednostki regulatorowe nie mają żadnej aktywności katalitycznej, ale zawierają miejsca regulatorowe wiązania efektorowego. Holoenzym ATCazy składa się z dwóch katalitycznych trimerów, które są w kontakcie i utrzymywane razem przez trzy dimery regulatorowe, więc natywna postać enzymu zawiera sześć łańcuchów każdego typu, z całkowitą masa cząsteczkowa 310 kDa .
Każda z domen katalitycznych składa się z dwóch domen strukturalnych, domeny asparaginianu, która zawiera większość reszt odpowiedzialnych za wiązanie asparaginianu , oraz domeny fosforanu karbamoilu, która zawiera większość reszt wiążących się z fosforanem karbamoilu . Każda domena regulatorowa składa się również z dwóch domen, domeny allosterycznej, która ma miejsce wiązania efektorów nukleotydowych , oraz domeny cynkowej , składającej się z czterech reszt cysteiny skupionych w jej regionie C-końcowym. Reszty te koordynują atom cynku , który nie ma żadnych właściwości katalitycznych, ale wykazano, że jest niezbędny do asocjacji podjednostek regulatorowych i katalitycznych .
Trójwymiarowy układ podjednostek katalitycznych i regulatorowych obejmuje kilka jonowych i hydrofobowych stabilizujących kontaktów między resztami aminokwasowymi. Każdy łańcuch katalityczny jest w kontakcie z trzema innymi łańcuchami katalitycznymi i dwoma łańcuchami regulatorowymi. Każdy monomer regulatorowy jest w kontakcie z jednym innym łańcuchem regulatorowym i dwoma łańcuchami katalitycznymi. W nieligandowanym enzymie dwa katalityczne trimery są również w kontakcie.
Centrum katalityczne
Miejsce katalityczne ATCazy znajduje się na granicy faz między dwoma sąsiednimi łańcuchami katalitycznymi w tym samym trimerze i obejmuje łańcuchy boczne aminokwasów z obu tych podjednostek. Wgląd w sposób wiązania substratów z centrum katalitycznym ATCazy był po raz pierwszy możliwy dzięki wiązaniu analogu bisubstratu, N-(fosfonoacetylo)-L-asparaginianu (PALA). Związek ten jest silnym inhibitorem ATCazy i ma strukturę uważaną za bardzo zbliżoną do stanu przejściowego podłoży. Dodatkowo otrzymano struktury krystaliczne ATCazy związanej z karbamoilofosforanem i bursztynianem. Badania te, oprócz badań z wykorzystaniem ukierunkowanej mutagenezy określonych aminokwasów, zidentyfikowały kilka reszt kluczowych dla katalizy, takich jak Ser52, Thr53, Arg54, Thr55, Arg105, His134, Gln137, Arg167, Arg229, Glu231 i Ser80 i Lys84 z sąsiedniego łańcucha katalitycznego. Miejscem aktywnym jest wysoce dodatnio naładowana kieszeń. Jeden z najbardziej krytycznych łańcuchów bocznych pochodzi z Arg54, który oddziałuje z końcowym tlenem i bezwodnikiem tlenowym fosforanu karbamoilu, stabilizując ładunek ujemny opuszczającej grupy fosforanowej. Arg105, His134 i Thr55 pomagają zwiększyć elektrofilowość węgla karbonylu poprzez interakcję z tlenem karbonylu. Ogólnie rzecz biorąc, zwiększenie szybkości ATCazy osiąga się raczej przez orientację i stabilizację substratów, produktów pośrednich i produktów niż przez bezpośrednie zaangażowanie reszt aminokwasowych w mechanizm katalityczny.
Miejsce allosteryczne
Miejsce allosteryczne w domenie allosterycznej łańcuchów R kompleksu ATCazy wiąże się z nukleotydami ATP, CTP i/lub UTP. W każdym dimerze regulatorowym jest jedno miejsce o wysokim powinowactwie do ATP i CTP i jedno o 10- do 20-krotnie niższym powinowactwie do tych nukleotydów. ATP wiąże się głównie z miejscami o wysokim powinowactwie, a następnie aktywuje enzym, podczas gdy wiązanie UTP i CTP prowadzi do zahamowania aktywności. UTP może wiązać się z miejscem allosterycznym, ale hamowanie ATCazy przez UTP jest możliwe tylko w połączeniu z CTP. Przy obecnym CTP wiązanie UTP jest wzmocnione i preferencyjnie kierowane do miejsc o niskim powinowactwie. I odwrotnie, wiązanie UTP prowadzi do zwiększonego powinowactwa do CTP w miejscach o wysokim powinowactwie i razem hamują aktywność enzymu nawet o 95%, podczas gdy samo wiązanie CTP hamuje aktywność do 50% do 70%. Porównanie struktur krystalicznych form T i R ATCazy pokazuje, że pęcznieje ona podczas przejścia allosterycznego i że podjednostki katalityczne ulegają kondensacji podczas tego procesu. Dwa katalityczne trimery oddalają się od siebie wzdłuż potrójnej osi o 12 Å i obracają się wokół tej osi o 5° każdy, ostatecznie prowadząc do reorientacji podjednostek regulatorowych wokół ich podwójnej osi o 15°. Ten struktury czwartorzędowej jest związana ze zmianami w interakcjach między podjednostkami i między domenami. Interakcja między podjednostkami C1-C4 i R1 jest w znacznym stopniu modyfikowana podczas tej konwersji. W szczególności występuje duży ruch reszt aminokwasowych 230-254, określanych zbiorczo jako pętla 240s. Reszty te znajdują się w szczelinie między fosforanu karbamoilu i asparaginianu na granicy faz C1-C4. Ogólnym rezultatem tych zmian strukturalnych jest to, że dwie domeny każdego łańcucha katalitycznego zbliżają się do siebie, zapewniając lepszy kontakt z substratami lub ich analogi .
Podczas tej przemiany strukturalnej niektóre interakcje między łańcuchami bocznymi są tracone, a inne są ustalane. Badania potwierdziły, że pozycja pętli 240s bezpośrednio wpływa na wiązanie substratu w odpowiednim miejscu aktywnym. Wcześniejsze badania z użyciem ukierunkowanej mutagenezy pętli 240s wykazały, że interakcje między Asp271 i Tyr240 oraz między Glu239 z C1 i Tyr165 z C4 stabilizowałyby stan T, podczas gdy interakcje między Glu239 z C1 i zarówno Lys164, jak i Tyr165 z C4 stabilizowałyby się stan R.
Położony blisko pętli 240s i miejsca aktywnego region pętli obejmujący reszty 160–166 odgrywa rolę zarówno w wewnętrznej architekturze enzymu, jak i jego właściwościach regulacyjnych. W szczególności reszta Asp162 oddziałuje z Gln231 (wiadomo, że bierze udział w wiązaniu asparaginianu) i wiąże te same reszty zarówno w stanach T, jak i R. Mutant, który miał tę resztę zmutowaną do alaniny , wykazywał ogromne zmniejszenie aktywności właściwej, dwukrotny spadek powinowactwa do asparaginianu , utratę kooperatywności homotropowej i zmniejszoną aktywację przez ATP . Zasugerowano, że zmiana w ogólnej strukturze spowodowana wprowadzeniem tej reszty wpływa na inne reszty w interfejsach R1-C1, R1-C4 i C1-C4, które biorą udział w struktury czwartorzędowej .
Montaż kompleksu
Podjednostki regulatorowe i katalityczne istnieją jako homologi białek fuzyjnych, dostarczając mocnych dowodów na to, że będą ze sobą oddziaływać. Dwa katalityczne trimery i dwa dimery regulatorowe łączą się, tworząc związek pośredni karbamoilotransferazy asparaginianowej składający się z 6 podjednostek katalitycznych i 4 podjednostek regulatorowych.
Linki zewnętrzne
- Asparaginian + karbamoilotransferaza w US National Library of Medicine Medical Subject Headings (MeSH)
