Homoleptyczne związki azydkowe
Homoleptyczne związki azydkowe to związki chemiczne, w których jedynym anionem lub ligandem jest grupa azydkowa -N 3 . Zakres homoleptycznych związków azydkowych obejmuje prawie cały układ okresowy. Z rzadkimi wyjątkami azydo związki są bardzo wrażliwe na wstrząsy i należy obchodzić się z nimi z najwyższą ostrożnością. Binarne związki azydkowe mogą przybierać kilka różnych struktur, w tym dyskretne związki lub sieci jedno-, dwu- i trójwymiarowe, przez co niektórzy nazywają je „poliazydkami”. Badania reaktywności związków azydkowych są stosunkowo ograniczone ze względu na ich czułość. Czułość tych związków jest zwykle skorelowana z ilością charakteru jonowego lub kowalencyjnego, jaki ma wiązanie azydek-pierwiastek, przy czym charakter jonowy jest znacznie bardziej stabilny niż charakter kowalencyjny. Dlatego związki takie jak srebro czy azydek sodu – które mają charakter silnie jonowy – mają zwykle większą użyteczność syntetyczną niż ich kowalencyjne odpowiedniki. Kilka innych godnych uwagi wyjątków obejmuje sieci polimerowe, które posiadają unikalne właściwości magnetyczne, azydki grupy 13, które w przeciwieństwie do większości innych azydków rozkładają się na związki azotków (ważne materiały dla półprzewodników), inne ograniczone zastosowania jako odczynniki syntetyczne do przenoszenia grup azydkowych lub zainteresowanie materiały o dużej gęstości energii .
Synteza
Istnieje kilka ogólnych dróg i strategii stosowanych podczas syntezy homoleptycznych związków azydkowych. Metateza soli między solą azydkową, taką jak azydek sodu lub azydek srebra , a chlorkiem metalu to sposób przygotowania wielu wcześniejszych azydków. Inną popularną drogą są reakcje kwasowo-zasadowe z kwasem azotowodorowym HN 3 i kompleksami zasad wodorkowych lub Lewisa. Jednak nowoczesne metody często opierają się na wymianie halogenkowo-azydkowej z azydkiem trimetylosililu SiMe 3 N 3 z fluorkami metali jako niepełna wymiana halogenek/azydek jest często obserwowana przy stosowaniu pochodnych chlorków.
Neutralne binarne azydki są raczej trudne do zbadania ze względu na topnikowy charakter ligandów azydowych i ich brak stabilności termicznej i szoku. Ich brak stabilności wynika częściowo z kowalencyjnego wiązania ligandu azydowego z centrum metalu, co faworyzuje pojedyncze i potrójne wiązanie w ugrupowaniu azydkowym . Zwiększenie jonowego charakteru grupy azydkowej - albo przez wprowadzenie tworzenia anionów, albo adduktów N-donorów - faworyzuje zamiast tego dwa wiązania podwójne. Ten N2 motyw wiązania jonowego zwiększa zatem barierę aktywacji dla zerwania wiązania NN w celu uwolnienia i pomaga stabilizować związki. Powstałe związki mogą nadal być bardzo wrażliwe na wstrząsy i należy obchodzić się z nimi ostrożnie.
Metale przejściowe
Grupa 4
, że poliazydy grupy 4 o wzorze M(N3 ) 4 mają liniowe lub prawie liniowe kąty MNN, w przeciwieństwie do ich odpowiedników z grupy głównej , które mają mieć zakrzywione kąty MNN. Nie można tego było udowodnić w przypadku Ti(N 3 ) 4 z powodu trudności w krystalizacji. Jednak włączenie dużych przeciwjonów rozdzielających lub adduktów N-donorowych znacznie ułatwia pracę ze związkami. W przypadku [PPh 4 ] 2 [M(N 3 ) 6 ] (M=Ti, Zr, Hf) tylko ligandy osiowe wykazują zbliżone do liniowych kątów MNN, podczas gdy ligandy równikowe są bliżej kątów zagiętych. To odchylenie w teorii jest również widoczne w adduktach N-donorowych.
Główną hipotezą dotyczącą tego, dlaczego te związki nie mają liniowych kątów MNN pomimo obliczeń teoretycznych, jest to, że te addukty nie są czworościenne. W homoleptycznych czworościennych azot najbliższy centrum metalu (+ IV) jest umieszczony w taki sposób, że trzy pary elektronów walencyjnych mogą przekazywać wolne orbitale d na metalu, a zatem azydek może działać jako trójkleszczowy ligand donorowy w takim przypadku oczekiwana koordynacja byłaby liniowa. Ponieważ addycyjne nie są tetraedryczne, grupa azydowa może działać tylko jako donor jednokleszczowy z dwoma sterycznie aktywne pary elektronów, które powodują wygięcie kątów wiązań MNN.
Grupa 5
Znane są obojętne binarne jony azydkowe V (IV) oraz azydkowe V (III), V (IV) i V (V). Podobnie jak obojętny azydek Ti(IV), V(N 3 ) 4 jest trudny do zbadania ze względu na dużą niestabilność szokową i temperaturową. Jednak [V(N 3 ) 6 ] 2- sparowany z dużym, obojętnym przeciwjonem jest stosunkowo stabilny i krystalizuje jako prawie idealny oktaedryczny . W przeciwieństwie do V(IV), obojętnego układu podwójnego V(V) nie można było zsyntetyzować, a próby skutkują redukcją V(V) do V(IV) z eliminacją gazowego N2 . Na szczęście potencjały utleniania anionów są niższe niż ich związków macierzystych, więc [V(N 3 ) 6 ] - może powstać. W przeciwieństwie do [V(N 3 ) 6 ] 2- , [V(N 3 ) 6 ] - jest bardzo wrażliwy na wstrząsy i odkształcony od symetrii oktaedrycznej z trzema długimi i trzema krótkimi wiązaniami MN w pozycjach merowych .
obojętne związki podwójne Nb(N3 ) 5 i Ta(N3 ) 5 , a acetonitrylowe addukty tych związków zawierają prawie liniowy azydotrans w stosunku do koordynującego acetonitrylu. Stanowią pierwszy dowód liniowego wiązania MNN. Odpowiednie aniony [Nb(N 3 ) 6 ] - , [Nb (N 3 ) 7 ] 2- , [Ta(N 3 ) 6 ] - i [Ta(N 3 ) 7 ] 2- są znane i odpowiednio mniej wrażliwe na wstrząsy. Struktura monoanionów heksaazydowych jest podobna do innych monoanionów heptaazydowych z wygiętymi ligandami azydowymi, mimo że przewiduje się, że mają idealną symetrię S6 w fazie gazowej dla [Nb(N3 ) 6 ] . Heptaazydowe dianiony mają struktury trójkątno-pryzmatyczne 1/4/2 z pojedynczą czapeczką, w przeciwieństwie do trianionu aktynowców [U (N 3 ) 7 ] 3- , który krystalizuje jako ośmiościan z pojedynczą czapeczką lub bipiramida pięciokątna. Wiadomo również, że istnieje kilka adduktów N-donorowych. Reakcje neutralnego układu binarnego NbF 5 i TaF 5 w obecności Me 3 SiN 3 z N-donorami zawierającymi małe kąty zgryzu, takimi jak 2,2'-bipirydyna lub 1,10-fenantrolina, dają produkty samojonizacji typu [M(N 3 ) 4 L 2 ] + [M(N 3 ) 6 ] - (L= N-donor), podczas gdy N-donory zawierające duże kąty zgryzu, takie jak 3,3'-biprydyna lub 4,4'-bipirydyna, wytwarzają obojętne addukty pentaazydowe M(N 3 ) 5 •L (L=N-donor).
Grupa 6
Zarówno Mo(N 3 ) 6, jak i W(N 3 ) 6 zostały zsyntetyzowane, a W(N 3 ) 6 jest wystarczająco stabilny, aby rosnąć monokryształy . W przeciwieństwie do binarnych związków azydkowych grupy 4 i grupy 5, anionowe [Mo(N 3 ) 7 ] - i [W(N 3 ) 7 ] - są mniej trwałe i bardziej wrażliwe na manipulacje niż ich obojętne związki macierzyste. Po ogrzaniu roztworów anionów heptaazydowych w MeCN lub SO 2 do temperatury pokojowej jony tetraazydoazotowe [NMo(N 3 ) 4 ] - i [NW(N 3 ) 4 ] - powstają z eliminacją N 2 .
Grupa 7
Związki azydkowe grupy 7 są zdominowane przez chemię manganu . Pierwszy związek poliazydowy Mn został opisany przez Wöhlera i in. w 1917 r. w reakcji MnCO 3 z HN 3 z wytworzeniem Mn(N 3 ) 2 . Zsyntetyzowano wiele dwuwartościowych soli Mn, które reprezentują prawdziwe układy polimerowe. Ugrupowanie azydkowe może wiązać się jako koniec (EO) (µ-1,1) lub koniec do końca (EE) (µ-1,3), zwykle dając odpowiednio sprzężenie ferromagnetyczne lub antyferromagnetyczne . Łańcuchy 1D powstają, gdy 2,2'-bipirydyna , dwukleszczowy ligand, jest używany jako przeciwjon w reakcji między Mn(ClO 4 ) 2 • 6H 2 O i nadmiarem NaN 3 . Daje to łańcuch z naprzemiennymi mostkami EE i EO, co w przewidywalny sposób daje naprzemienne sprzężenie antyferromagnetyczne-ferromagnetyczne. Jednak niestety, z wyjątkiem bezwzględnego 0K, systemy jednowymiarowe nie wykazują uporządkowania magnetycznego . Dlatego interesujące są polimery o rosnącej wymiarowości. Układ 2D powstaje w wyniku reakcji MnCl 2 • 4H 2 O i NaN 3 w obecności kwasu 4,4'-dipirydyno-N,N'dioctowego, który ulega in situ dekarboksylacji dając naprzemienne warstwy [Mn(N 3 ) 4 ] 2- z azydkami mostkującymi EE i 4,4 dyktando dipirydyny. Metalowe centra w tym związku wykazują sprzężenie antyferromagnetyczne, ale absolutnie nie jest to spowodowane przechylaniem się spinu z powodu niezwykłej centrosymetrii mostkujących ligandów azydowych. Dostęp do innej struktury 2D uzyskuje się poprzez reakcję (PPh 4 ) 2 MnCl 2 z AgN 3 , tworząc niewybuchowy [PPh 4 ] 2 [Mn(N 3 ) 4 ], który ma naprzemienne warstwy jonowe.
Pierwszy przykład trójwymiarowego związku azydowego zsyntetyzowano w reakcji Mn(NO 3 ) 2 • 4H 2 O w gorącym wodnym [N(CH 3 ) 4 ][N 3 ] nasyconym HN 3 z wytworzeniem [N(CH 3 ) 4 ][Mn(N 3 ) 3 ]. Związek ten ma strukturę pseudoperowskitu z [N(CH 3 ) 4 ] + jony we wnękach między centrami Mn. Ugrupowania azydkowe są ułożone w sposób EE i rzeczywiście związek ten wykazuje oczekiwane zachowanie antyferromagnetyczne. Analog cezu Cs[Mn(N 3 ) 3 ] jest syntetyzowany w ten sam sposób, ale wykorzystuje CsN 3 zamiast [N(CH 3 ) 4 ][N 3 ] i jest strukturalnie unikalny w porównaniu z wersją tetrametyloamoniową. Dla każdych 6 współrzędnych Mn 4 wiązania azydkowe to EE, a dwa to EO zamiast wszystkich sześciu to EE. Taki układ daje kształt przypominający plaster miodu i rzadki przykład naprzemiennych oddziaływań ferro-antyferromagnetycznych w bryle 3D.
Przykłady związków azydkowych manganu na wyższych stopniach utlenienia są stosunkowo rzadkie. Addukt triazydowo -acetonitrylowy można wytworzyć na drodze wymiany fluorkowej z wytworzeniem Mn(N3 ) 3CN jako ciemnoczerwonego związku wrażliwego na szok. Po dodaniu PPh 4 N 3 związek dysproporcjonuje do niewrażliwej mieszaniny [PPh 4 ] 2 [Mn(N 3 ) 2 ] i [PPh 4 ] 2 [Mn(N 3 ) 6 ]. Sól Mn(IV) można wytworzyć samodzielnie, stosując jako materiał wyjściowy Cs 2 MnF 6 w celu uzyskania silnie wybuchowego Cs 2 [Mn(N 3 ) 6 ].
Grupa 8
Pierwszym zgłoszonym azydkiem penta-koordynacyjnym i dziewiątym trygonalnym związkiem bipiramidowym był jon pentaazydożelaza (III) [Fe (N 3 ) 5 ] 2- i związek ten można wytworzyć poprzez eliminację halogenków lub azotanów z żelaza (III) materiał wyjściowy . Jednak do zastosowań azydki żelaza zwykle nie są izolowane, ale zamiast tego są wytwarzane in situ podczas wytwarzania azydoalkanów. NaN 3 i siarczan żelaza (III) Fe 2 (SO 4 ) 3 łączy się w metanolu i dodaje do organoboranu, a następnie powoli dodaje 30% nadtlenek wodoru, przypuszczalnie tworząc Fe( N3 ) 3 . W połączeniu z alkenami azydek wstawi się w antymarkownikowy . Rola nadtlenku nie jest dobrze poznana, ale jest kluczowa dla zajścia tej reakcji.
Tetrabutyloamoniową sól rutenu można wytworzyć w reakcji K2 [ Ru IV Cl6 ] z NaN3 w etanolu i wodzie. Uwalnia się gazowy N2 otrzymuje się zredukowany rodzaj rutenu (III) [n-Bu4N ] 3 [ Ru (N3 ) 6 ] . Związek ten był w dużej mierze badany pod kątem jego właściwości optycznych.
Grupa 9
Związki tetraazydokobaltu(II) zostały wyizolowane zarówno w postaci soli tetrafenylofosfoniowej, jak i tetrafenyloarsoniowej z roztworów siarczanu kobaltu z 15-krotnym seksem NaN 3 , uzyskując [Ph 4 P] 2 [Co (N 3 ) 4 ] i [Ph 4 As ] 2 [Co(N 3 ) 4 ] odpowiednio. Autooksydacja roztworów [Co(N 3 ) 4 ] 2- może być wykorzystana jako punktowy test kolorymetryczny na obecność jonów siarczynowych .
Znane są tetrabutyloamoniowe sole azydków rodu(III) i irydu(III), które otrzymuje się w reakcji dużego nadmiaru NaN 3 w roztworze wodnym z odpowiednią solą chlorku metalu Na 3 [MCl 6 ] • 12H 2 O z wytworzeniem [n -Bu4N ] 3 [Rh(N3 ) 6 ] i [n-Bu4N ] 3 [ Ir (N3 ) 6 ] .
Grupa 10
Azydek niklu można wytworzyć przez destylację HN 3 na węglanie niklu i wytrącenie acetonem z wytworzeniem Ni(N 3 ) 2 . Próbka Ni(N 3 ) 2 zacznie się szybko rozkładać po podgrzaniu do 490 K o około 35%, po czym nastąpi powolny rozkład pozostałego materiału. Uważa się, że w pierwszej fazie rozkładu powstają mikrokryształy z metalicznym niklem na zewnątrz i Ni(N 3 ) 2 w rdzeniu. Reakcja zwalnia, ponieważ teraz rozkład musi nastąpić przy Ni/Ni(N 3 ) 2 interfejs.
[Pd(N 3 ) 4 ] 2- aniony są kwadratowe , a stopień interakcji między anionem a odpowiadającym mu kationem można określić na podstawie wielkości odchylenia kątów skręcenia od idealnej geometrii. Znane są różne platynaty [Pt(N3 ) 4 ] 2- i [Pt(N3 ) 6 ] 4- , które wytwarza się z chlorków Pt z NaN3 . Sole Pt (II) są zwykle znacznie mniej stabilne niż wersje Pt (IV) i albo rozkładają się dość szybko po odstawieniu, albo eksplodują. Ich wrażliwość częściowo została wyjaśniona biedą kryształowe opakowanie .
Grupa 11
Dwuskładnikowy azydek miedzi(I) CuN 3 jest związkiem jonowym 1D z łańcuchami biegnącymi ukośnie do komórki elementarnej. Znanych jest wiele azydków miedzi (II) obejmujących szeregi [Cu(N 3 ) 3 ] - , [Cu(N 3 ) 4 ] 2- i [Cu(N 3 ) 6 ] 2- . Trzy współrzędne kompleksy azydku miedzi tworzą liniowe łańcuchy 1D z dwoma azydowymi ligandami EE i jednym EO, w przeciwieństwie do analogu Mn, który tworzy strukturę 3D. Gatunki dwujądrowe i [Cu(N 3 ) 4 ] 2- oba mają charakter monomeryczny. Wszystkie azydki miedzi są wybuchowe, ale ich wrażliwość różni się znacznie od macierzystych azydków CuN 3 i Cu(N 3 ) 2 , które są niezwykle wrażliwe na jony sparowane z dużymi przeciwkationami, które są praktycznie niewrażliwe.
Azydek srebra (I) jest dobrze znanym związkiem wybuchowym i wykazano, że tworzy polimer koordynacyjny 2D z kwadratowymi płaskimi jonami Ag + otoczonymi ligandami azydowymi w sposób EE. Powolny wzrost temperatury od 150°C do 251°C powoduje stopienie i powolny rozkład, ale gwałtowne podgrzanie do 300°C powoduje eksplozję.
Azydek złota(III) jest znany jako sól tetraetyloamoniowa [Et 4N ][Au(N 3 ) 4 ] i również przyjmuje kwadratową płaską strukturę. Jednak w przeciwieństwie do azydku srebra, azydek złota nie jest stabilny w temperaturze pokojowej i rozkłada się po kilku dniach, a jego wiązania z azydkiem metalu mają charakter kowalencyjny.
Grupa 12
Podczas gdy Zn(N 3 ) 2 jest znany od końca lat 90. XIX wieku, bezrozpuszczalnikowy Zn(N 3 ) 2 został po raz pierwszy wyizolowany w 2016 roku z suchego eterowego roztworu HN 3 i Et 2 Zn w n -heksanie . Zn(N 3 ) 2 krystalizuje w trzech różnych odmianach polimorficznych α-Zn(N 3 ) 2 i nietrwałych β-Zn(N 3 ) 2 i γ - Zn(N 3 ) 2 formy.
Pierwszy azydek rtęci (I) został zrealizowany przez Curtiusa w 1890 r. przez połączenie wodnych soli rtęci (I) z azydkami metali alkalicznych lub przez połączenie HN 3 z rtęcią pierwiastkową w celu wytworzenia Hg 2 (N 3 ) 2 , jak dowodzi lokalizacja elektronów funkcja, związek jest stabilizowany wiązaniami jonowymi między ligandami azydowymi N 3 - i Hg + oraz wiązaniem kowalencyjnym między + Hg-Hg + . Zarówno azydek rtęci (I), jak i azydek rtęci (II) można łatwo wytworzyć przez zmieszanie odpowiednich azotanów rtęci z azydkiem sodu w roztworze wodnym w temperaturze pokojowej. Azydek rtęci (II) Hg(N 3 ) 2 występuje w dwóch postaciach polimorficznych α-Hg(N 3 ) 2 i β-Hg(N 3 ) 2. Forma β jest bardzo nietrwała i szybko przechodzi w polimorfy α w temperaturze pokojowej . Jednak polimorf β można wytworzyć analogicznie do β-Pb(N 3 ) 2 przez powolną dyfuzję wodnego roztworu NaN 3 do roztworu Hg(NO 3 ) 2 oddzielonego warstwą wodnego NaNO 3 , ale kryształy prawie zawsze eksplodują podczas tworzenia, co prowadzi do powstania mieszaniny form polimorficznych α i β.
Dwuskładnikowy azydek kadmu Cd(N 3 ) 2 można otrzymać z CdCO 3 i wodnego roztworu HN 3 . Jest jednak strukturalnie niezwiązany z analogami rtęci lub cynku i opiera się na powtarzalnych jednostkach podwójnych oktaedrów Cd 2 (N 3 ) 10 .
Związki grupy głównej
Grupa 13
Triazydek boru został najpierw przygotowany przez dodanie diboranu do eterowego roztworu NH 3 w celu wytworzenia B(N 3 ) 3 . Związek jest stosunkowo lotny i może ulegać wybuchowemu rozkładowi w temperaturach powyżej -35°C. W przeciwieństwie do tego, azydek glinu Al(N3 ) 3 jest stosunkowo stabilny i ulegnie deflagracji tylko w teście zapałkowym. Jednak rozkłada się hydrolitycznie w ciągu kilku minut pod wpływem wilgoci atmosferycznej. Al( N3 ) 3 ma pewne zastosowania syntetyczne, a gdy jest wytwarzany in situ, może reagować z β-nienasyconymi cyjanoestrami, tworząc tetrazole w skali masowej. Opisano, że reakcje w fazie gazowej AlMe 3 i HN 3 tworzą Al(N 3 ) 3 . Jednak w temperaturze pokojowej związek ten rozkłada się do AlN 2 i AlN, co sugeruje, że Al(N 3 ) 3 można stosować do wytwarzania AlN.
Ze względu na zainteresowanie GaN jako półprzewodnikiem, chemia azydków grupy 13 jest zdominowana przez azydki galu. Na[Ga(N 3 ) 4 ] to polimeryczna sieć 3D z azydkami mostkującymi EO. Związek ten jest cennym prekursorem do syntezy donorowo stabilizowanych monomerycznych triazydków galu Ga(N 3 ) 3 Lm , które po podgrzaniu rozkładają się do polimeru [Ga(N 3 ) 3 ] ∞ i po detonacji wytwarzają GaN. Ga( N3 ) 3 można z łatwością analizować jako jego sól tetrafosfoniową [PPh 4 ] 2 [Ga(N 3 ) 5 ]. Zwiększona jonowość ligandów azydowych oraz obecność dwóch dużych przeciwjonów, które zmniejszają propagację wstrząsów, czyni związek znacznie mniej wrażliwym.
Azydek indu In(N 3 ) 3 można również otrzymać na drodze wymiany fluorkowej i jest podobnie stabilizowany jak sól tetrafosfoniowa [PPh 4 ] 3 [In(N 3 ) 6 ].
Azydek talu (I) TlN 3 eksploduje po wstrząsie mechanicznym lub termicznym, ale ma mniejszą wrażliwość na uderzenia niż pokrewne mu azydki rtęci lub ołowiu. Co ciekawe, TlN 3 jest jednym z nielicznych azydków, które topią się, zanim wybuchną. Jego wrażliwość na tarcie jest najwyższa w cienkich warstwach, dlatego nadal należy obchodzić się z nim ostrożnie. Azydek talu (III) Tl(N 3 ) 3 został niedawno zsyntetyzowany poprzez wymianę fluor-azydek, ale otrzymany związek jest bardzo wrażliwy i kryształy można analizować tylko jako sól tetrafosfoniową [PPh 4 ] 3 [Tl (N 3 ) 6 ].
Grupa 14
Diazydo- i triazydometan można wytworzyć przez proste podstawienie nukleofilowe odpowiednio chlorku metylenu lub bromoformu jonem azydkowym na czwartorzędowej żywicy amoniakalnej. Należy unikać roztworów o czystości diazydometanu większej niż 70%, ponieważ mają one tendencję do wybuchania przy niewielkich zakłóceniach mechanicznych, takich jak pipetowanie. Tetraazydometanu C(N 3 ) 4 nie można wytworzyć z tetrahalogenków węgla i zamiast tego można go otrzymać w reakcji trichloroacetonitrylu Cl 3 CN z NaN 3 , aczkolwiek ze stosunkowo niską wydajnością. Wydajność można znacznie poprawić w reakcji z heksachloroantymonianem triazydometylowym [C(N 3 ) 3 ][SbCl 6 ] z azydkiem sodu lub litu LiN 3 ; materiał wyjściowy jest wybuchowy na tej drodze. Ogólnie należy unikać czystego tetraazydometanu, a nawet roztworów nie należy obsługiwać ręcznie. Związek może eksplodować w dowolnym momencie bez widocznej prowokacji, a pojedyncza kropla jest w stanie rozbić szkło i odkurzyć Dewara.
W przeciwieństwie do analogu węgla, tetraazydek krzemu Si(N 3 ) 4 można wytworzyć z SiCl 4 i NaN 3 . Jednak ta reakcja spowoduje również wytrącenie różnych ilości chloroazydków krzemu, których można uniknąć przez wydłużenie czasu reakcji. Ponadto, w przeciwieństwie do azydków boru i glinu, Si(N 3 ) 4 nie można otrzymać w reakcji pomiędzy SiH 4 i HN 3 . Sól heksaazidozykaltu [(Ph 3 P) 2 N] 2 [Si(N 3 ) 6 ] istnieje i ma bardzo rzadki szkielet oktaedryczny SiN 6 .
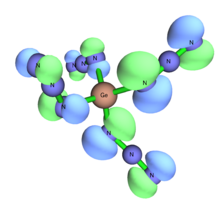
Nie potwierdzono istnienia tetraazydku germanu Ge(N 3 ) 4 w czystej postaci i przy próbach jego syntezy zakłada się, że jest częściowo halogenowany. Jednak w przeciwieństwie do swoich odpowiedników z metali przejściowych (patrz grupa 4), przewiduje się, że będzie miał wygięte kąty Ge-N w przeciwieństwie do liniowych. Zmieniając rozpuszczalniki z niepolarnych na polarne, NaN 3 stosowany w reakcji staje się znacznie bardziej rozpuszczalny i prowadzi do heksaazydogermanianu Na 2 [Ge(N 3 ) 6 ]. Obecność słabo koordynującego przeciwjonu, takiego jak tetrafenylolarsyna, umożliwia tworzenie niskowartościowych germanianów z anionu trójchlorkowego, tworząc german (II) [Ge(N 3 ) 3 ] - który nie przekształci się w german (IV) po dalszej ekspozycji do NaN 3 , ale sole o niskiej wartościowości są bardzo podatne na utlenianie.
Macierzysty związek Sn(IV) nie został opisany, a obojętny Sn(N3 ) 4 został opisany jedynie z pomocniczymi ligandami. Reakcje z SnCl 4 i NaN 3 zamiast tego prowadzą do powstania heksaazydo Na 2 Sn(N 3 ) 6 , znacznie bardziej stabilnego związku niż jego analogi z grupy 14. Sól jest tylko nieznacznie wrażliwa na wodę i ulega deflagracji w teście płomienia. Cyniany niskowartościowe typu [Sn(N 3 ) 3 ] - zostały zsyntetyzowane i podobnie jak analogiczne germaniany są związkami bardzo wrażliwymi. Wydaje się, że nie mają sterycznie aktywnej samotnej pary i mają tendencję do dimeryzacji z interakcjami EE.
Azydek ołowiu jest jednym z najbardziej rozpowszechnionych azydków homoleptycznych ze względu na jego wszechobecne zastosowanie jako głównego materiału wybuchowego. Wyjątkowo jest to jedyny azydek grupy 14, który jest bardziej rozpowszechniony w swojej dwuwartościowej formie Pb 2+ . Istnieją odmiany polimorficzne α, β, γ i ∂, ale forma α jest jedyną, która znajduje szerokie zastosowania techniczne. Homoleptyczne azydki Pb(IV) istnieją, ale podobnie jak wersje cynowe Pb(N 3 ) 4 nie jest stabilnym związkiem i próbuje go zsyntetyzować z PbO 2 i HN 3 w celu uzyskania czerwonych igieł, które szybko wybuchają i rozkładają się do Pb(N 3 ) 2 . Związek ten można jednak wydzielić jako jony [Pb(N 3 ) 6 ] 2- z dużymi kationami organicznymi, uzyskując niewybuchowy związek.
Grupa 15
W ogólnym sensie azydki pierwiastków z grupy 15 mają tendencję do przypominania swoich chlorków, ale z większą lotnością i mniejszą termostabilnością. Postulowano, że związki bogate w azot, takie jak N(N3 ) 3 , są możliwe do syntezy, ale nie zostały jeszcze wytworzone.
Triazydek fosforu P(N 3 ) 3 można zsyntetyzować w reakcji NaN 3 i PCl 3 , ale nie udało się zsyntetyzować jonowego związku azydkowego fosforu (III). Pomimo istnienia PCl 5 , donoszono o istnieniu pseudohalogenkowego analogu P(N 3 ) 5 , ale nie zostało to jeszcze potwierdzone. Azydki fosforu (V) są ograniczone do ich soli jonowych i można je otrzymać jako sól antymonianową [P(N 3 ) 4 ] + [SbCl 6 ] - z PCl 3 lub sól sodowa Na[P(N 3 ) 6 ] z PCl 5 .
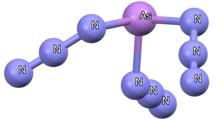
As(N 3 ) 3 można wytworzyć z wymiany fluorkowej, a otrzymana struktura krystaliczna zawiera mostki EO dwóch grup azydowych, co daje liczbę koordynacyjną 7 i nieskończoną strukturę łańcucha zygzakowatego. Jednak stan roztworu 14 N NMR As(N 3 ) 3 potwierdza, że związki te są w rzeczywistości monomerami w roztworze, a samotna para arsenu jest obliczona jako sterycznie aktywna, o czym świadczy zoptymalizowana geometria fazy gazowej i wykres konturowy całkowitej gęstości elektronów. W przeciwieństwie do fosforu, macierzysty azydek arsenu(V) został wyizolowany jako As(N 3 ) 5 i występuje w postaci żółtej cieczy. Opisano całą serię jonów azydku arsenu, [As(N 3 ) 4 ] - , [As(N 3 ) 4 ] + i [As(N 3 ) 6 ] - . Formy kationowe mają najkrótszą odległość As-N i N β -N γ , podczas gdy formy anionowe mają zwykle znacznie większe odległości As-N, co częściowo wyjaśnia, dlaczego związki kationowe są znacznie bardziej wybuchowe.
Azydek antymonu(III) Sb(N 3 ) 3 jest wytwarzany w podobny sposób jak arsen i ma podobną budowę z wyjątkiem tego, że wszystkie trzy ligandy azydowe biorą udział w mostkowaniu EO i tworzą wysoce symetryczny arkusz. Sb(N 5 ) 5 występuje jako wysoce niestabilny związek i nie można nim manipulować w temperaturze otoczenia bez wybuchu. Szereg soli azydku antymonu [Sb(N 3 ) 4 ] - , [Sb(N 3 ) 4 ] + i [Sb(N 3 ) 6 ] - są znane i mają podobne tendencje do arszeniku.
Dwuskładnikowe azydki bizmutu pozostawały nieuchwytne do 2010 roku, kiedy to czysty Bi(N 3 ) 3 został wyizolowany na drodze wymiany fluorkowej. Serie jonów bizmutu (III) [Bi(N 3 ) 4 ] - , [Bi(N 3 ) 5 ] 2- i [Bi(N 3 ) 6 ] 3- zostały zsyntetyzowane i scharakteryzowane strukturalnie. Samotna para bizmutu jest sterycznie aktywna we wszystkich jonach. W stanie stałym struktury bizmutu różnią się znacznie od ich lżejszych odpowiedników z grupy 15, ponieważ bizmut może pomieścić większe liczby koordynacyjne, a struktury są oparte na Bi 2 N 2 równoległobok o liczbie koordynacyjnej 8. Próby wytworzenia związków Bi(V) skutkują redukcją do Bi(III) przez N 3 - .
Grupa 16
diazydek tlenu O(N 3 ) 2 jest związkiem pośrednim w tworzeniu cyklicznego podtlenku azotu N 2 O z OF 2 i NaN 3 , ale jego istnienie nie zostało jeszcze potwierdzone. Macierzyste azydki siarki S(N 3 ) 2 lub S(N 3 ) 4 nie zostały zsyntetyzowane i zbadano jedynie teoretyczne obliczenia ich istnienia. Chociaż azydek sulfurylu SO 2 (N 3 ) 2 jest znana i w pełni scharakteryzowana.
Serie binarnych azydków selenu Se(N 3 ) 4 , [Se(N 3 ) 5 ] - i [Se(N 3 ) 6 ] 2- zostały przygotowane na drodze wymiany fluorkowej. Obojętny Se(N 3 ) 4 jest stosunkowo niestabilny i może wybuchnąć nawet w -64°C pod SO 2 bez prowokacji. Dlatego charakterystyka ciała stałego jest ograniczona do jonów i pokazuje, że grupy azydkowe mają silny charakter kowalencyjny. [Se(N 3 ) 6 ] 2- krystalizuje z idealną symetrią S 6 , a zatem samotna para nie jest uważana za sterycznie aktywną.
Azydki telleru (IV) [Te(N 3 ) 3 ] + , Te(N 3 ) 4 , [Te(N 3 ) 5 ] - i [Te(N 3 ) 6 ] 2- są zazwyczaj otrzymywane przez redukcję fluorek telluru (VI) TeF 6 na drodze wymiany fluorkowej. Nic dziwnego, że Te(N 3 ) 4 jest bardzo wrażliwym związkiem, a sole są znacznie mniej wrażliwe na wstrząsy. W przeciwieństwie do powyższej soli selenu, samotna para w dianionie telluru [Te(N 3 ) 6 ] 2- jest sterycznie aktywny i dlatego wymusza zniekształconą pseudopięciokątną strukturę bipiramidalną .
Grupa 17
Cztery halogenki azydkowe FN 3 , ClN 3 , BrN 3 i IN 3 zostały wytworzone i wszystkie zawierają czysto kowalencyjne wiązania azydek-halogenek, co czyni je niezwykle wrażliwymi. Reakcja w fazie gazowej pomiędzy F 2 i HN 3 da FN 3 , ale F 2 musi być rozcieńczony w gazie obojętnym i należy unikać szybkiego mieszania do F 2 N 2 nie jest uformowany. Azydek chloru jest również gazem i może być wytwarzany przez przepuszczanie rozcieńczonego gazowego chloru przez roztwór NaN 3 . Jednak azydek chloru ma tendencję do spontanicznej eksplozji nawet w obniżonych temperaturach. Azydek bromu jest cieczą, ale nadal jest równie zdradziecki. NaN 3 musi być suchy, ponieważ BrN 3 hydrolizuje w wodzie. Podobnie azydek jodu jest wrażliwy na wilgoć i można go wytworzyć z ICl i AgN3 w postaci ciała stałego. Jednak od AgN 3 można bezpiecznie obchodzić się tylko wtedy, gdy do mieszaniny reakcyjnej dodaje się zwykle środek suszący, aby zapobiec hydrolizie produktu końcowego. Zarówno BrN 3, jak i IN 3 znajdują zastosowanie w syntezie jako wygodny sposób wytwarzania azydyrydyn i azyryn. Scharakteryzowano azydki chloru, bromu i jodu w stanie stałym. Azydek chloru ma silne oddziaływania Cl-Cl i jest porównywalny z jodełkowym innych struktur halogenowych. W przeciwieństwie do tego, azydki bromu i jodu preferują międzycząsteczkowe interakcje XN, dające strukturę helikalną dla BrN 3 i płaskie łańcuchy dla IN 3 .
- ^ a b c d e f g hi j ; Harry David Fair Raymond F. Walker, wyd. (1977). Fizyka i chemia azydków nieorganicznych . Nowy Jork: Plenum Press. ISBN 0-306-37076-X . OCLC 2985662 .
- ^ abc Joan ; Ribas, Wybawca, Albert; Monfort, Montserrat; Vicente, Ramon; Cortés, Roberto; Lezama, Luis; Rojo, Teófilo (1999-10-01). „Kompleksy mostków wielojądrowych NiII i MnII azydowych. Trendy strukturalne i zachowanie magnetyczne” . Recenzje chemii koordynacyjnej . 193-195: 1027-1068. doi : 10.1016/S0010-8545(99)00051-X . ISSN 0010-8545 .
- ^ a b c d e f Haiges, Ralf; Boatz, Jerry A.; Christe, Karl O. (2010-10-18). „Syntezy i struktura binarnych azydków wanadu (IV) i wanadu (V) V (N3) 4, [V (N3) 6] 2- i [V (N3) 6] -” . Angewandte Chemie wydanie międzynarodowe . 49 (43): 8008–8012. doi : 10.1002/anie.200906537 . PMID 20715219 .
- ^ a b c d e Haiges, Ralf; Boatz, Jerry A.; Williams, Jodi M.; Christe, Karl O. (2011-09-12). „Przygotowanie i charakteryzacja grupy binarnej 13 azydków M(N3)3 i M(N3)3⋅CH3CN (M=Ga, In, Tl), [Ga(N3)5]2− i [M(N3)6 ]3− (M=In, Tl)" . Angewandte Chemie wydanie międzynarodowe . 50 (38): 8828–8833. doi : 10.1002/anie.201103101 . PMID 21766406 .
- Referencje _ _ _ _ _ _ _ _ _ _ _ ISBN 0471936235 , pobrane 13.12.2022
- Bibliografia _ Zhang, Junlin; Wang, Bozhou; Qiu, Lili; Xu, Ruoqian; Szeremietiew, Aleksiej B. (2022). „Ostatnie wysiłki syntetyczne w kierunku materiałów o wysokiej gęstości energii: jak projektować wysokowydajne struktury energetyczne?” . FirePhysChem . 2 (2): 83–139. doi : 10.1016/j.fpc.2021.09.005 . S2CID 244214466 .
- ^ a b c d e Porcjusz, Piotr; Davis, Martin (2013-03-01). „Najnowsze osiągnięcia w chemii homoleptycznych kompleksów azydkowych głównych elementów grupy” . Recenzje chemii koordynacyjnej . Najnowsze osiągnięcia w chemii głównej grupy. 257 (5): 1011–1025. doi : 10.1016/j.ccr.2012.09.019 . ISSN 0010-8545 .
- ^ ab Saal , Tomasz; Deokar, Piyush; Christe, Karl O.; Haiges, Ralf (2019-05-15). „Addukty azydkowe grupy binarnej 4 [(bpy)Ti(N3)4], [(fen)Ti(N3)4], [(bpy)2 Zr(N3)4]2·bpy i [( bpy) 2 Hf(N 3 ) 4 ] 2 ·bpy" . Europejski Dziennik Chemii Nieorganicznej . 2019 (18): 2388–2391. doi : 10.1002/ejic.201900334 . ISSN 1434-1948 . S2CID 132294068 .
- ^ abc Li , Qian Shu; Duan, Hong Xia (2005-10-01). „Teoretyczne badanie funkcjonalności gęstości serii binarnych azydków M (N 3) n ( n = 3, 4)” . Czasopismo Chemii Fizycznej A. 109 (40): 9089–9094. Bibcode : 2005JPCA..109.9089L . doi : 10.1021/jp052726t . ISSN 1089-5639 . PMID 16332016 .
- ^ abc Haiges , Ralf; Boatz, Jerry A.; Schneider, Stefan; Schroer, Thorsten; Yousufuddin, Mahomet; Christe, Karl O. (2004-06-14). „Grupa binarna 4 Azydki [Ti (N3) 4], [P (C6H5) 4 [Ti (N3) 5] i [P (C6H5) 4] 2 [Ti (N3) 6] i liniowy Ti Koordynacja NNN” . Angewandte Chemie wydanie międzynarodowe . 43 (24): 3148–3152. doi : 10.1002/anie.200454156 . ISSN 1433-7851 . PMID 15199563 .
- ^ Deokar, Pijusz; Wasiliu, Monika; Dixon, David A.; Christe, Karl O.; Haiges, Ralf (2016-11-07). „Azydki grupy binarnej 4 [PPh 4] 2 [Zr (N 3) 6] i [PPh 4] 2 [Hf (N 3) 6]” . Angewandte Chemie wydanie międzynarodowe . 55 (46): 14350–14354. doi : 10.1002/anie.201609195 . PMID 27735115 .
- ^ Gutmann, V.; Leitmann, O.; Scherhaufer, A.; Czuba, H. (1967-01-01). "Azidokomplexe in nichtwäßrigen Lösungsmitteln, 3. Mitt.: Ti(III), V(III) und Cr(III) in Acetonitryl, Propandiol-1,2-carbonat und Trimethylphosphat" . Monatshefte für Chemie und verwandte Teile anderer Wissenschaften (w języku niemieckim). 98 (1): 188–199. doi : 10.1007/BF00901117 . ISSN 1434-4475 .
- ^ abc Haiges , Ralf; Boatz, Jerry A.; Schroer, Thorsten; Yousufuddin, Mahomet; Christe, Karl O. (2006-07-17). „Eksperymentalne dowody na liniową koordynację metali z azydkami: grupa binarna 5 azydków [Nb (N3) 5], [Ta (N3) 5], [Nb (N3) 6] - i [Ta (N3) 6] -, i addukty 1:1 acetonitrylu [Nb(N3)5(CH3CN)] i [Ta(N3)5(CH3CN)]" . Angewandte Chemie wydanie międzynarodowe . 45 (29): 4830–4835. doi : 10.1002/anie.200601060 . ISSN 1433-7851 . PMID 16795097 .
- ^ a b Haiges, Ralf; Boatz, Jerry A.; Yousufuddin, Mahomet; Christe, Karl O. (2007-04-13). „Heptaazydki metali przejściowych trygonalnego pryzmatu z pojedynczą czapką: syntezy, właściwości i struktury [Nb (N3) 7] 2- i [Ta (N3) 7] 2-” . Angewandte Chemie wydanie międzynarodowe . 46 (16): 2869–2874. doi : 10.1002/anie.200604520 . PMID 17348060 .
- ^ Haiges, Ralf; Deokar, Piyush; Christe, Karl O. (2014-05-19). „Addukty koordynacyjne azydku niobu (V) i tantalu (V) M (N 3 ) 5 (M = Nb, Ta) z ligandami donorowymi azotu i ich samojonizacja” . Angewandte Chemie wydanie międzynarodowe . 53 (21): 5431–5434. doi : 10.1002/anie.201402775 . PMID 24756882 .
- ^ Haiges, Ralf; Boatz, Jerry A.; Bau, Robert; Schneider, Stefan; Schroer, Thorsten; Yousufuddin, Mahomet; Christe, Karl O. (2005-03-11). „Chemia poliazydów: pierwsza grupa binarna 6 azydków, Mo (N3) 6, W (N3) 6, [Mo (N3) 7]? I [W (N3) 7]? oraz [NW (N3) 4 ]? i [NMo(N3)4]? Jony" . Angewandte Chemie wydanie międzynarodowe . 44 (12): 1860–1865. doi : 10.1002/anie.200462740 . ISSN 1433-7851 . PMID 15723363 .
- Bibliografia _ Dubgen, R. (1978). „Die Reaktionen des Jodazids mit Metallcarbonylen” . Zeitschrift für anorganische und allgemeine Chemie (w języku niemieckim). 444 (1): 61–70. doi : 10.1002/zaac.19784440106 . ISSN 0044-2313 .
- ^ ab Goher , Mohamed AS; Cano, Joan; Journaux, Yves; Abu-Youssef, Morsy AM; Mautner, Franz A.; Wybawca, Albert; Vicente, Ramon (2000-03-03). „Synteza, charakterystyka strukturalna i symulacja Monte Carlo właściwości magnetycznych trójwymiarowego plastra miodu Csn [{Mn (N3) 3} n] i nieregularnego podwójnego łańcucha [{N (C2H5) 4} n][{Mn2 ( N3)5(H2O)}n]" . Chemia - Dziennik Europejski . 6 (5): 778–784. doi : 10.1002/(SICI)1521-3765(20000303)6:5<778::AID-CHEM778>3.0.CO;2-P . ISSN 0947-6539 . PMID 10826599 .
- ^ Cortés, Roberto; Lezama, Luis; Rojo, Teófilo; Arriortua, M. Isabel; Pizarro, J. Luis; Solans, Xavier (1995-01-03). „Naprzemienne interakcje ferro- i antyferromagnetyczne w łańcuchu MnII z naprzemiennymi ligandami azydowymi mostkującymi typu end-on i end-to-end” . Angewandte Chemie International Edition w języku angielskim . 33 (2324): 2488–2489. doi : 10.1002/anie.199424881 . ISSN 0570-0833 .
- ^ abc Mautner , Franz A.; Hanna, Samy; Cortés, Roberto; Lezama, Luis; Barandika, M. Gotzone; Rojo, Teófilo (1999-10-01). „Struktura kryształu oraz właściwości spektroskopowe i magnetyczne układów azydo-tetrametyloamoniowych manganu (II) i miedzi (II)” . Chemia nieorganiczna . 38 (21): 4647–4652. doi : 10.1021/ic981373s . ISSN 0020-1669 . PMID 11671186 .
- Bibliografia _ Cheng, Ai-Ling; Słońce, Wei-Wei; Zhang, Jiang-Yong; Gao, En-Qing (2009-05-01). „Homoleptyczna warstwa azydku manganu (II): synteza, charakterystyka strukturalna i właściwości magnetyczne” . Komunikacja w chemii nieorganicznej . 12 (5): 412–416. doi : 10.1016/j.inoche.2009.03.005 . ISSN 1387-7003 .
- Bibliografia _ chętny, Wolfgang; Müller, Ulrich; Dehnicke, Kurt (1987). "Azidokomplexe von Mangan(II) und Cobalt(II) Die Kristallstrukturen von (PPh4)2[Mn(N3)4] und (PPh4)2[Co(N3)3Cl]" . Zeitschrift für anorganische und allgemeine Chemie (w języku niemieckim). 555 (12): 7–15. doi : 10.1002/zaac.19875551202 . ISSN 0044-2313 .
- ^ Mautner, Franz A.; Cortés, Roberto; Lezama, Luis; Rojo, Teófilo (19.01.1996). „[N (CH3) 4 ][ Mn (N3) 3]: związek o zniekształconej strukturze perowskitu przez ligandy azydowe” . Angewandte Chemie International Edition w języku angielskim . 35 (1): 78–80. doi : 10.1002/anie.199600781 . ISSN 0570-0833 .
- ^ Haiges, Ralf; Buszek, Robert J.; Boatz, Jerry A.; Christe, Karl O. (2014-07-28). „Przygotowanie pierwszych azydków manganu (III) i manganu (IV)” . Angewandte Chemie wydanie międzynarodowe . 53 (31): 8200–8205. doi : 10.1002/anie.201404735 . PMID 25044947 .
- ^ a b Beck, Wolfgang; Fehlhammer, Wolf Peter; Pöllmann, Peter; Schuierer, Erich; Feldl, Klaus (1967). „Darstellung, IR‐ und Elektronenspektren von Azido‐Metall‐Komplexen” . Chemische Berichte . 100 (7): 2335–2361. doi : 10.1002/cber.19671000731 . ISSN 0009-2940 .
- Bibliografia _ Drewno, JS (1969). „Struktura kompleksu żelaza o pięciu współrzędnych; jon pentaazydoironu (III), Fe (N3) 5 2?” . Journal of the Chemical Society D: Chemical Communications (23): 1373. doi : 10.1039/c29690001373 . ISSN 0577-6171 .
- Bibliografia _ ISHIDOYA, Masahiro; TABATA, Masayoshi (1976). „Reakcja organoboranów z azydkiem żelaza (III) w obecności nadtlenku wodoru. Nowatorska synteza azydoalkanów z alkenów przez hydroborowanie” . Synteza . 1976 (10): 687–689. doi : 10.1055/s-1976-24160 . ISSN 0039-7881 .
- ^ a b c d Schmidtke, Hans-Herbert .; Garthoff, Dieter. (1967). „Widma elektroniczne niektórych kompleksów azydków metali szlachetnych” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 89 (6): 1317–1321. doi : 10.1021/ja00982a007 . ISSN 0002-7863 .
- ^ Senise, Paschalny (1959). „O reakcji między jonami kobaltu (II) i azydku w roztworach wodnych i wodno-organicznych 1 ” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 81 (16): 4196–4199. doi : 10.1021/ja01525a020 . ISSN 0002-7863 .
- ^ Senise, Paschoal (1957-09-01). „Test punktowy na obecność siarczynów w oparciu o indukowane utlenianie roztworów azydku kobaltu” . Microchimica Acta . 45 (5): 640–643. doi : 10.1007/BF01236544 . ISSN 1436-5073 . S2CID 98339990 .
- Bibliografia _ Nya, AE; Etim, ES (1981). „Rozkład termiczny azydku niklu” . Dziennik analizy termicznej . 22 (2): 231–237. doi : 10.1007/bf01915269 . ISSN 0022-5215 . S2CID 95478362 .
- ^ a b Beck, Wolfgang; Fehlhammer, Wolf Peter; Feldl, Klaus; Klpötke, Thomas M.; Kramer, Gernot; Majer, Piotr; Piotrowski, Holger; Pöllman, Peter; Ponikwar, Walter; Schütt, Thomas; Schuierer, Erich; Wójt, Marcin (2001). <1751::AID-ZAAC1751>3.0.CO;2-5 "Struktury krystaliczne (PPh3)2Pd(N3)2, (AsPh3)2Pd(N3)2, (2-chloropirydyna)2Pd(N3)2, [( AsPh4)2][Pd2(N3)4Cl2], [(PNP)2][Pd(N3)4], [(AsPh4)2][Pt(N3)4] 2H2O i [(AsPh4)2][Pt (N3)6]" . Zeitschrift für anorganische und allgemeine Chemie . 627 (8): 1751-1758. doi : 10.1002/1521-3749(200108)627:8<1751::AID-ZAAC1751>3.0.CO;2-5 . ISSN 0044-2313 .
- ^ Neumüller, Bernhard; Schmock, Fritjof; Schlecht, Sabine; Dehnicke, Kurt (2000). <1792::AID-ZAAC1792>3.0.CO;2-U "Die Kristallstrukturen der Azido-Platinate (AsPh4)2[Pt(N3)4] und (AsPh4)2[Pt(N3)6]" . Zeitschrift für anorganische und allgemeine Chemie . 626 (8): 1792-1796. doi : 10.1002/1521-3749(200008)626:8<1792::AID-ZAAC1792>3.0.CO;2-U .
- ^ Wilsdorf H. (1948-07-02). "Die Kristallstruktur des einwertigen Kupferazids, CuN3" . Acta Crystallographica (w języku niemieckim). 1 (3): 115–118. doi : 10.1107/S0365110X48000314 . ISSN 0365-110X .
- ^ Goher, Mohamed AS; Abdou, Azza EH; Abu-Youssef, Morsy AM; Mautner, Franz A. (2001-02-01). „Bis-(tetraetyloamoniowy)[tetraazydomiedzian(II)] i katena-di-μ-1,1-azydo-[di-μ-1,1-azydo-bis-(2,4-dimetylopirydyno)dimiedź(II)] " . Chemia metali przejściowych . 26 (1): 39–43. doi : 10.1023/A:1007195015645 . ISSN 1572-901X . S2CID 92350747 .
- ^ Schmidt, Carsten L.; Dinnebier, Robert; Wedig, Ulrich; Jansen, Martin (2007-02-01). „Struktura krystaliczna i wiązanie chemiczne fazy wysokotemperaturowej AgN 3” . Chemia nieorganiczna . 46 (3): 907–916. doi : 10.1021/ic061963n . ISSN 0020-1669 . PMID 17257034 .
- ^ Schulz, Axel; Villinger, Aleksander (2016-01-08). „Binarne azydki cynku” . Chemia - Dziennik Europejski . 22 (6): 2032–2038. doi : 10.1002/chem.201504524 . ISSN 0947-6539 . PMID 26749253 .
- ^ Nockemann, Piotr; Meyer, Gerd (2002). <2709::aid-zaac2709>3.0.co;2-p "Bildung z NH4[Hg3(NH)2](NO3)3 i Umwandlung w [Hg2N](NO3)" . Zeitschrift für anorganische und allgemeine Chemie . 628 (12): 2709–2714. doi : 10.1002/1521-3749(200212)628:12<2709::aid-zaac2709>3.0.co;2-p . ISSN 0044-2313 .
- ^ a b Lund, Henrik; Oeckler, Oliver; Schröder, Thorsten; Schulz, Axel; Villinger, Aleksander (26.08.2013). „Azydki rtęci i azydek zasady Millona” . Angewandte Chemie wydanie międzynarodowe . 52 (41): 10900–10904. doi : 10.1002/anie.201305545 . ISSN 1433-7851 . PMID 24038779 .
- ^ Karau, Friedrich; Schnick, Wolfgang (2005). "Darstellung und Kristallstruktur von Cadmiumazid Cd(N3)2" . Zeitschrift für anorganische und allgemeine Chemie . 631 (12): 2315–2320. doi : 10.1002/zaac.200500226 . ISSN 0044-2313 .
- ^ Wiberg, Egon; Michaud, Horst (1954-07-01). "Notizen: Zur Kenntnis eines Bortriazids B(N 3 ) 3 " . Zeitschrift für Naturforschung B . 9 (7): 497–499. doi : 10.1515/znb-1954-0715 . ISSN 1865-7117 . S2CID 96674767 .
- ^ Wagner, Eugeniusz R. (1973). „Reakcja azydku glinu z cyjanoestrami. Wytwarzanie tetrazolo[1,5-c]pirymidyn-5(6H)-onu i tetrazolo[1,5-c]chinazolin-5(6H)-onu” . Journal of Chemii Organicznej . 38 (17): 2976–2981. doi : 10.1021/jo00957a012 . ISSN 0022-3263 .
- ^ Linnen, CJ; Macks, DE; Coombe, RD (1997-02-01). „Synteza Al (N 3 ) 3 i osadzanie cienkich warstw AlN” . Czasopismo Chemii Fizycznej B. 101 (9): 1602–1608. doi : 10.1021/jp9625873 . ISSN 1520-6106 .
- ; ^ abc Sussek , Harald Stowasser, Frank; Pritzkow, Hans; Fischer, Roland A. (2000). <455::aid-ejic455>3.0.co;2-e „Kompleksy tetraazydowe glinu, galu i indu” . Europejski Dziennik Chemii Nieorganicznej . 2000 (3): 455–461. doi : 10.1002/(sici)1099-0682(199903)2000:3<455::aid-ejic455>3.0.co;2-e . ISSN 1434-1948 .
- ^ Frank, Alissa C.; Stowasser, Frank; Sussek, Harald; Pritzkow, Hans; Miskys, Claudio R.; Ambacher, Oliver; Giersig, Michał; Fischer, Roland A. (1998). „Detonacje azydków galu: prosta droga do sześciokątnych nanokryształów GaN” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 120 (14): 3512–3513. doi : 10.1021/ja9738438 .
- ^ Fischer, Ronald A.; Miehr, Aleksander; Herdtweck, Eberhardt; Mattner, Michael R.; Ambacher, Oliver; Metzger, Tomasz; Urodzony, Eberhardzie; Weinkauf, Sevil; Pulham, Colin R.; Parsons, Szymon (1996). „Triazidogall i pochodne: nowe prekursory cienkich warstw i nanocząstek GaN” . Chemia - Dziennik Europejski . 2 (11): 1353–1358. doi : 10.1002/chem.19960021104 .
- ^ Wöhler, Lothar; Martin, F. (1917). „Die Sensibilität der Azide” . chemia angielska . 30 (9): 33–39. Bibcode : 1917AngCh..30...33W . doi : 10.1002/ange.19170300902 .
- ^ Hassner, Alfred; Stern, Meir; Gottlieb, Hugo E.; Frolow, Felix (1990). „Metody syntezy. 33. Użyteczność polimerowego odczynnika azydkowego w tworzeniu di- i triazydometanu. Ich widma NMR i struktura rentgenowska pochodnych triazoli” . Journal of Chemii Organicznej . 55 (8): 2304–2306. doi : 10.1021/jo00295a014 . ISSN 0022-3263 .
- Bibliografia _ Joo, Young-Hyuk; Rüffer, Tobiasz; Walfort, Bernhard; Lang, Heinrich (2007). „Ekscytująca chemia tetraazydometanu” . Angewandte Chemie wydanie międzynarodowe . 46 (7): 1168–1171. doi : 10.1002/anie.200603960 . PMID 17143916 .
- ^ Wiberg, Egon; Michaud, Horst (1954-07-01). "Notizen: Zur Kenntnis eines Siliciumtetrazids Si(N 3 ) 4 " . Zeitschrift für Naturforschung B . 9 (7): 500. doi : 10.1515/znb-1954-0717 . ISSN 1865-7117 . S2CID 98275613 .
- ^ Filippou, Aleksander C.; Porcjusz, Piotr; Schnakenburg, Gregor (2003-01-14). „Jon heksaazydokrzemianowy (IV): synteza, właściwości i struktura molekularna” . ChemInform . 34 (2). doi : 10.1002/chin.200302019 . ISSN 0931-7597 .
- Bibliografia _ Hemmings, RT (15.01.1973). „Przygotowanie i charakterystyka pseudohalogeno(metylo)germanów i związków pokrewnych” . Kanadyjski Dziennik Chemii . 51 (2): 302–311. doi : 10.1139/v73-043 . ISSN 0008-4042 .
- ^ Filippou, Aleksander C.; Porcjusz, Piotr; Neumann, Dirk U.; Wehrstedt, Klaus-Dieter (2000-12-01). <4333::aid-anie4333>3.0.co;2-s „Jon heksaazydogermanianu (IV): syntezy, struktury i reakcje” . chemia angielska . 39 (23): 4333–4336. doi : 10.1002/1521-3773(20001201)39:23<4333::aid-anie4333>3.0.co;2-s . ISSN 1433-7851 . PMID 29711897 .
- ^ a b Niezrównany, Benjamin; Keane, Teo; Meijer, Anthony JHM; Porcjusz, Piotr (2015). „Homoleptyczne poliazydy o niskiej wartościowości pierwiastków z grupy 14” . Komunikacja chemiczna . 51 (35): 7435–7438. doi : 10.1039/c5cc00259a . ISSN 1359-7345 . PMID 25773494 . S2CID 32981384 .
- Bibliografia _ Davis, Martin F.; Fazakerley, Mateusz; Porcjusz, Piotr (2015-11-13). „Oswajanie poliazydów cyny (IV)” . Chemia - Dziennik Europejski . 21 (51): 18690–18698. doi : 10.1002/chem.201503478 . ISSN 0947-6539 . PMID 26767331 .
- ^ Wiberg, Egon; Michaud, Horst (1954-07-01). "Notizen: Zur Kenntnis eines Natrium-hexazido-stannats Na 2 Sn(N 3 ) 6 " . Zeitschrift für Naturforschung B . 9 (7): 500–501. doi : 10.1515/znb-1954-0718 . ISSN 1865-7117 . S2CID 94917667 .
- ^ Möller, Heinz (1949). "Versuche zur Darstellung von Blei(IV)-azid-Verbindungen" . Zeitschrift für anorganische Chemie . 260 (4–5): 249–254. doi : 10.1002/zaac.19492600406 . ISSN 0372-7874 .
- ^ Fehlhammer, Wolf Peter; Beck, Wolfgang (2013). „Chemia azydków - perspektywa nieorganiczna, część 1 Azydki metali: przegląd, ogólne trendy i ostatnie osiągnięcia” . Zeitschrift für anorganische und allgemeine Chemie . 639 (7): 1053–1082. doi : 10.1002/zaac.201300162 .
- ^ ab Buder , Wolfgang; Schmidt, Armin (1975). "Phosphorazide und deren Schwingungsspektren" . Chemischer Informationsdienst . 415 (3): 263–267. doi : 10.1002/chin.197534036 .
- ^ Schulz, Axel; Villinger, Aleksander (2012-03-05). „Binarne azydki piktogenu - badanie eksperymentalne i teoretyczne: [As (N 3 ) 4 ] - , [Sb (N 3 ) 4 ] - i [Bi (N 3 ) 5 (dmso)] 2−” . Chemia - Dziennik Europejski . 18 (10): 2902–2911. doi : 10.1002/chem.201102656 . PMID 22337137 .
- ^ Schmidt, Armin (1970). "Darstellung und IR-Spektrender Dimethyldiazido-, Methyltriazido- und Tetraazidophosphonium-hexachloroantimonate(V)" . Chemische Berichte . 103 (12): 3923–3927. doi : 10.1002/cber.19701031223 . ISSN 0009-2940 .
- ^ abc Haiges , Ralf; Vij, Ashwani; Boatz, Jerry A.; Schneider, Stefan; Schroer, Thorsten; Gerken, Michael; Christe, Karl O. (2004-01-23). „Pierwsza charakterystyka strukturalna binarnych azydków AsIII i SbIII” . Chemia - Dziennik Europejski . 10 (2): 508–517. doi : 10.1002/chem.200305482 . ISSN 0947-6539 . PMID 14735519 .
- ^ a b Geissler, Petra; Klapötke, Thomas M.; Kroth, Heinz-Jürgen (1995-06-01). „Widma 14N NMR kowalencyjnych halogenów i azydków arsenu: XN3 (X Cl, Br, I), (CH3)nAs(N3)3−n (n = 0, 1, 2) i [As(N3)4]+ " . Spectrochimica Acta Część A: Spektroskopia molekularna i biomolekularna . 51 (6): 1075–1078. doi : 10.1016/0584-8539(94)01313-6 . ISSN 1386-1425 .
- ^ a b Haiges, Ralf; Boatz, Jerry A.; Vij, Ashwani; Vij, Vandana; Gerken, Michael; Schneider, Stefan; Schroer, Thorsten; Yousufuddin, Mahomet; Christe, Karl O. (2004-12-10). „Chemia poliazydów: wytwarzanie i charakteryzacja As (N3) 5, Sb (N3) 5 i [P (C6H5) 4] [Sb (N3) 6]” . Angewandte Chemie wydanie międzynarodowe . 43 (48): 6676–6680. doi : 10.1002/anie.200461730 . ISSN 1433-7851 . PMID 15593158 .
- ^ a b c Karaghiosow, Konstantin; Klapötke, Thomas M.; Krumm, Burkhard; Noth, Heinrich; Schütt, Thomas; Suter, Max (2002-01-01). „Eksperymentalna i teoretyczna charakterystyka kationowych, neutralnych i anionowych binarnych gatunków arsenu i azydku antymonu” . Chemia nieorganiczna . 41 (2): 170–179. doi : 10.1021/ic010463l . ISSN 0020-1669 . PMID 11800605 .
- ^ ab Villinger , Aleksander; Schulz, Axel (2010-10-18). „Binarne azydki bizmutu (III): Bi (N3) 3 , [Bi (N3) 4] - i [Bi (N3) 6] 3 -” . Angewandte Chemie wydanie międzynarodowe . 49 (43): 8017–8020. doi : 10.1002/anie.201002179 . PMID 20839195 .
- ^ abc Haiges , Ralf; Rahm, Martin; Dixon, David A.; Garner, Edward B.; Christe, Karl O. (2012-01-16). „Binary Group 15 Poliazides. Charakterystyka strukturalna [Bi(N 3 ) 4 ] − , [Bi(N 3 ) 5 ] 2– , [bipy·Bi(N 3 ) 5 ] 2– , [Bi(N 3 ) 6 ] 3– , bipy·As(N 3 ) 3 , bipy·Sb(N 3 ) 3 , i [(bipy) 2 ·Bi(N 3 ) 3 ] 2 oraz aktywacja wolnych par elektronów walencyjnych” . Chemia nieorganiczna . 51 (2): 1127–1141. doi : 10.1021/ic202307a . ISSN 0020-1669 . PMID 22221015 .
- ^ Crawford, Margaret-Jane; Klapötke, Thomas M. (1999-06-01). „Możliwe pośrednie tworzenie cyklicznego podtlenku azotu N2O: reakcja difluorku tlenu OF2 z azydkiem cezu, CsN3” . Chemia nieorganiczna . 38 (12): 3006–3009. doi : 10.1021/ic990240j . ISSN 0020-1669 . PMID 11671052 .
- Bibliografia _ Zgierski, Marek Z.; Mezey, Paul G. (2003-03-01). „Stabilne struktury siarczków bogatych w azot: S (N3) m ( m = 1-4)” . Czasopismo Chemii Fizycznej A. 107 (12): 2080–2084. Bibcode : 2003JPCA..107.2080W . doi : 10.1021/jp022074y . ISSN 1089-5639 .
- ^ Zeng, Xiaoqing; Beckers, Helmut; Bernhardt, Eduard; Willner, Helge (2011-09-05). „Synteza i charakterystyka diazydku sulfurylu, O 2 S (N 3 ) 2” . Chemia nieorganiczna . 50 (17): 8679–8684. doi : 10.1021/ic201294b . ISSN 0020-1669 . PMID 21815651 .
- ^ Klapötke, Thomas M.; Krumm, Burkhard; Scherr, Maciej; Haiges, Ralf; Christe, Karl O. (2007-11-19). „Dwójkowe azydki selenu (IV) Se (N 3 ) 4 , [Se (N 3 ) 5 ] - i [Se (N 3 ) 6 ] 2-” . Angewandte Chemie wydanie międzynarodowe . 46 (45): 8686–8690. doi : 10.1002/anie.200702758 . PMID 17935101 .
- ^ Johnson, James P.; MacLean, Gregory K.; Passmore, Jack; Biały, Peter S. (1989-11-01). „Preparat i rentgenowska struktura krystaliczna Te(N 3 ) 3 SbF 6 zawierającego kation triazydoteluru(IV), Te(N 3 ) 3 +” . Kanadyjski Dziennik Chemii . 67 (11): 1687-1692. doi : 10.1139/v89-259 . ISSN 0008-4042 .
- ^ Haiges, Ralf; Boatz, Jerry A.; Vij, Ashwani; Gerken, Michael; Schneider, Stefan; Schroer, Thorsten; Christe, Karl O. (2003-12-08). „Chemia poliazydów: wytwarzanie i charakteryzacja Te (N3) 4 i [P (C6H5) 4] 2 [Te (N3) 6] oraz dowody na [N (CH3) 4] [Te (N3) 5]” . Angewandte Chemie wydanie międzynarodowe . 42 (47): 5847–5851. doi : 10.1002/anie.200352680 . ISSN 1433-7851 . PMID 14673915 .
- ^ Bauer, SH (1947). „Badanie dyfrakcji elektronów struktury difluorodiazyny” . Dziennik Amerykańskiego Towarzystwa Chemicznego . 69 (12): 3104–3108. doi : 10.1021/ja01204a053 . ISSN 0002-7863 .
- ^ Milligan, Dolphus E.; Jacox, Marilyn E. (1964). „Widma w podczerwieni NF, NCl i NBr” . The Journal of Chemical Physics . 40 (9): 2461–2466. Bibcode : 1964JChPh..40.2461M . doi : 10.1063/1.1725547 . ISSN 0021-9606 .
- ^ ab Dehnicke , K. (1967). „Reakcje azydków halogenowych” . Angewandte Chemie International Edition w języku angielskim . 6 (3): 240–246. doi : 10.1002/anie.196702401 . ISSN 0570-0833 .
- ^ Dehnicke, Kurt (1979). „Chemia azydku jodu” . Angewandte Chemie International Edition w języku angielskim . 18 (7): 507–514. doi : 10.1002/anie.197905071 . ISSN 0570-0833 .
- ^ Hassner, Alfred; Marinescu, Lavinia; Bols, Mikael (2005-10-15), "Azydek jodu" , w John Wiley & Sons, Ltd. (red.), Encyklopedia odczynników do syntezy organicznej , Chichester: John Wiley & Sons, Ltd, s. ri007, doi : 10.1002/047084289x.ri007 , ISBN 978-0-471-93623-7 , pobrane 2022-12-13
- ^ Lyhs, Beniamin; Blaser, Dieter; Wolper, Christoph; Schulz, Stefan; Jansen, Georg (14.12.2012). „Porównanie struktur w stanie stałym azydków halogenowych XN 3 (X = Cl, Br, I)” . Angewandte Chemie wydanie międzynarodowe . 51 (51): 12859–12863. doi : 10.1002/anie.201206028 . PMID 23143850 .