Hydrożelowe kapsułkowanie kropek kwantowych
Zachowanie kropek kwantowych (QD) w roztworze i ich interakcja z innymi powierzchniami ma ogromne znaczenie w zastosowaniach biologicznych i przemysłowych, takich jak wyświetlacze optyczne, znakowanie zwierząt , barwniki i farby zapobiegające podrabianiu, czujniki chemiczne i znakowanie fluorescencyjne . Jednak niezmodyfikowane kropki kwantowe są zwykle hydrofobowe, co wyklucza ich zastosowanie w stabilnych koloidach na bazie wody . Ponadto, ponieważ stosunek pola powierzchni do objętości w kropce kwantowej jest znacznie wyższy niż w przypadku większych cząstek, termodynamiczna energia swobodna związane ze zwisającymi wiązaniami na powierzchni jest wystarczające, aby utrudnić kwantowe uwięzienie ekscytonów . Po rozpuszczeniu przez kapsułkowanie w hydrofobowej miceli wewnętrznej lub hydrofilowej miceli zewnętrznej, QD można z powodzeniem wprowadzić do środowiska wodnego, w którym tworzą rozszerzoną sieć hydrożelową . W tej postaci kropki kwantowe mogą być wykorzystywane w kilku zastosowaniach, które korzystają z ich unikalnych właściwości, takich jak obrazowanie medyczne i niszczenie termiczne nowotworów złośliwych.
Kropki kwantowe
Kropki kwantowe (QD) to nanoskalowe cząstki półprzewodnikowe o średnicy rzędu 2-10 nm. Posiadają właściwości elektryczne pomiędzy półprzewodnikami masowymi a pojedynczymi cząsteczkami, a także właściwości optyczne, które czynią je odpowiednimi do zastosowań, w których fluorescencja , takich jak obrazowanie medyczne. Większość QD syntetyzowanych do obrazowania medycznego ma postać cząstek rdzenia (powłoki) CdSe (ZnS). Wykazano, że QD CdSe mają właściwości optyczne lepsze niż barwniki organiczne . Powłoka ZnS ma dwojaki efekt:
- oddziaływać ze zwisającymi wiązaniami , które w przeciwnym razie spowodowałyby agregację cząstek, utratę rozdzielczości wizualnej i impedancję efektów uwięzienia kwantowego
- w celu dalszego zwiększenia fluorescencji samych cząstek.
Problemy z kropkami kwantowymi CdSe(ZnS).
Pomimo ich potencjalnego zastosowania jako środków kontrastowych w technikach obrazowania medycznego, ich zastosowanie in vivo jest utrudnione przez cytotoksyczność kadmu . Aby rozwiązać ten problem, opracowano metody „zawijania” lub „kapsułkowania” potencjalnie toksycznych QD w bioobojętnych polimerach, aby ułatwić ich stosowanie w żywej tkance. Chociaż QD bez CD są dostępne w handlu, nie nadają się do stosowania jako substytut organicznych kontrastów. Innym problemem związanym z nanocząstkami CdSe(ZnS) jest znaczna hydrofobowość , która utrudnia ich zdolność do wnikania do roztworów z mediami wodnymi, takimi jak krew lub płyn rdzeniowy . Niektóre hydrofilowe polimery mogą być użyte do uczynienia kropek rozpuszczalnymi w wodzie.
Syntetyzowanie polimeru kapsułkującego
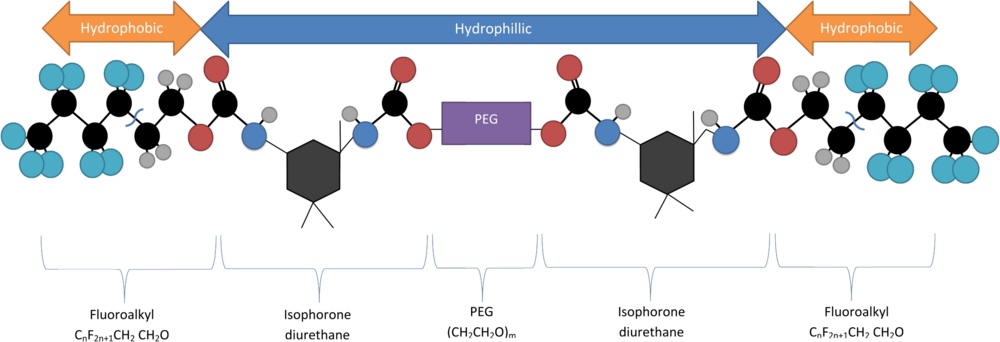
Synteza Rf - PEG
-PEG) zakończonego podwójnymi grupami fluoroalkilowymi (Rf - PEG) jako środka powierzchniowo czynnego, który spontanicznie tworzy struktury mikomórkowe przy krytycznym stężeniu miceli (CMC). Krytyczne stężenie miceli Rf - PEG zależy od długości części PEG polimeru. Ta cząsteczka składa się z hydrofilowego PEG z dwiema hydrofilowymi grupami końcowymi (C n F 2n+1 -CH 2 CH 2 O) przyłączone przez diuretan izoforonu. Jest syntetyzowany przez odwodnienie roztworu 1,3-dimetylo-5-fluorouracylu i PEG, mieszanie ich w obecności ciężkiej wody (D 2 O) za pomocą sonikatora , aby następnie połączyć.
Micelizacja
W odpowiedniej temperaturze Kraffta i krytycznym stężeniu miceli cząsteczki te utworzą pojedyncze pętle łez, w których hydrofobowe końce są przyciągane do siebie, do innych cząsteczek, a także do podobnie hydrofobowych QD. Tworzy to naładowaną micelę z hydrofilową otoczką zewnętrzną i hydrofobowym rdzeniem.
Podczas kapsułkowania hydrofobów w ten sposób ważne jest, aby upewnić się, że rozmiar cząstek jest odpowiedni dla wykorzystywanego szkieletu PEG, ponieważ liczba jednostek merów PEG (ogólnie o masie cząsteczkowej 6K lub 10K Daltonów) określa maksymalny rozmiar cząstek, które mogą być z powodzeniem zawarte w rdzeniu miceli.
Aby określić średnią średnicę D QD, stosuje się następujące równanie empiryczne:
Gdzie
- CdSe QD w nm
- fali pierwszego piku absorpcji w nm
Rola powłoki ZnS
Właśnie podczas enkapsulacji powłoka ZnS odgrywa szczególnie ważną rolę, ponieważ pomaga zapobiegać aglomeracji cząstek CdSe, które nie miały powłoki, zajmując wcześniej wspomniane wiązania na powierzchni kropki; jednak zbrylanie może nadal występować w wyniku sił wtórnych, które wynikają ze wspólnej hydrofobowości. Może to spowodować powstanie wielu cząstek w każdej miceli, co może negatywnie wpłynąć na ogólną rozdzielczość. Z tego powodu do uzyskania optymalnych właściwości obrazowania konieczne są liczne kombinacje długości łańcucha PEG i średnicy cząstek.
Sieć hydrożelowa
Po wstępnej enkapsulacji pozostałe cząsteczki tworzą połączenia między poszczególnymi micelami, tworząc sieć w ośrodku wodnym zwaną hydrożelem , tworząc rozproszone i względnie stałe stężenie kapsułkowanej cząstki w żelu. Powstawanie hydrożeli to zjawisko obserwowane w polimerach superabsorpcyjnych , czyli „proszkach slush”, w których polimer, często w postaci proszku, wchłania wodę, stając się do 99% płynny i 30-60 razy większy.
Równanie Stokesa-Einsteina
Dyfuzyjność kulistych cząstek w zawiesinie jest aproksymowana równaniem Stokesa-Einsteina :
- gdzie
- to temperatura
- to promień cząstki
- to stała Boltzmanna
- to lepkość hydrożelu
Typowe współczynniki dyfuzyjności hydrożelu R f -PEG dla kropek kwantowych 2 nm są rzędu 10-16 m 2 / s, więc zawiesiny kropek kwantowych są zwykle bardzo stabilne. Lepkość hydrożelu można określić za pomocą technik reologicznych.
Reologia miceli
Podczas hermetyzacji materiałów hydrofobowych lub potencjalnie toksycznych ważne jest, aby kapsułka pozostała nienaruszona podczas przebywania w ciele. Badanie właściwości reologicznych miceli pozwala na identyfikację i wybór polimeru, który jest najbardziej odpowiedni do stosowania w długoterminowych zastosowaniach biologicznych. Rf -PEG wykazuje lepsze właściwości reologiczne , gdy jest stosowany in vivo .
Znaczenie długości polimeru
Długość łańcucha wpływa na właściwości polimeru. Właściwa długość łańcucha zapewnia, że kapsułka nie zostanie uwolniona w czasie. Unikanie uwalniania QD i innych toksycznych cząstek ma kluczowe znaczenie dla zapobiegania niezamierzonej martwicy komórek u pacjentów. Długość polimeru jest kontrolowana przez dwa czynniki:
- Masa szkieletu PEG w daltonach, reprezentowana przez #K (tysiące daltonów)
- Długość końców hydrofobowych, oznaczona liczbą atomów węgla w grupie końcowej (C#).
Zwiększenie długości PEG zwiększa rozpuszczalność polimeru. Jeśli jednak łańcuch PEG jest zbyt długi, micela stanie się niestabilna. Zaobserwowano, że stabilny hydrożel można utworzyć tylko ze szkieletami PEG o masie od sześciu do dziesięciu tysięcy daltonów.
Z drugiej strony, zwiększenie długości hydrofobowych grup końcowych zmniejsza rozpuszczalność w wodzie. Dla danej masy PEG, jeśli hydrofob jest zbyt krótki, polimer po prostu rozpuści się w roztworze, a jeśli jest zbyt długi, polimer w ogóle się nie rozpuści. Ogólnie rzecz biorąc, dwie grupy końcowe dają najwyższą konwersję do miceli (91%):
Płyn Maxwella
Przy masie cząsteczkowej od 6 do 10 tysięcy daltonów hydrożel R f -PEG działa jak materiał Maxwella , co oznacza, że płyn ma zarówno lepkość , jak i elastyczność . Jest to określane przez pomiar modułu plateau, moduł sprężystości dla lepkosprężystego polimeru jest stały lub „zrelaksowany” po odkształceniu, w zakresie częstotliwości poprzez reologię oscylacyjną. Wykreślając całki pierwszego i drugiego rzędu wartości modułu, uzyskuje się wykres Cole'a-Cole'a , który po dopasowaniu do modelu Maxwella zapewnia następującą zależność:
Gdzie
- to moduł plateau
- to częstotliwość oscylacji w radianach na sekundę
Właściwości mechaniczne typowych cząsteczek R f -PEG
W oparciu o maxwellowskie zachowanie hydrożelu i obserwacje erozji za pomocą powierzchniowego rezonansu plazmonowego (SPR) , uzyskano następujące dane dla 3 powszechnych typów Rf - PEG w ich określonych stężeniach:
| wypełnienie komórki = „3” odstęp między komórkami = „0” | |||
| 6.8 | 6.5 | 11.0 | |
| 1.2 | 0,029 | 0,023 | |
| 14.4 | 18,5 | 56.1 | |
| 18 | 0,53 | 1.5 | |
| 94 | 94 | 89 |
X KC Y oznacza X tysięcy daltonów masy cząsteczkowej i Y atomów węgla .
Te wartości mogą dostarczyć nam informacji o stopniu splątania (lub stopniu usieciowania, w zależności od tego, jaki polimer jest brany pod uwagę). Ogólnie rzecz biorąc, wyższe stopnie splątania prowadzą do dłuższego czasu potrzebnego do powrotu polimeru do stanu nieodkształconego lub czasów relaksacji .
Aplikacje
Hermetyzacja hydrożelowa QD otwiera nowy zakres zastosowań, takich jak:
- Biosensory
- Enzymy i inne bioaktywne cząsteczki służą jako jednostki biorozpoznawcze, podczas gdy QD służą jako jednostki sygnalizacyjne. Dodając enzymy do sieci hydrożelowej QD, obie jednostki można połączyć, tworząc bioczujnik . Reakcja enzymatyczna, która wykrywa określoną cząsteczkę, powoduje wygaszenie fluorescencji QD. W ten sposób można obserwować położenie interesujących cząsteczek.
- Wpływ komórek i obrazowanie
- Dodanie nanocząstek tlenku żelaza do miceli QD umożliwia im uzyskanie fluorescencji i właściwości magnetycznych. Te micele można przesuwać w polu magnetycznym, tworząc gradienty stężeń, które będą wpływać na procesy zachodzące w komórce.
- Hipertermia złota
- Po wzbudzeniu przez promieniowanie o wysokiej energii, na przykład za pomocą lasera, nanocząsteczki złota emitują pole termiczne. Zjawisko to można wykorzystać jako formę terapii hipertermicznej do niszczenia nowotworów złośliwych bez uszkadzania otaczających tkanek. W połączeniu z QD w hydrożelu mogłoby to ułatwić monitorowanie leczenia nowotworu w czasie rzeczywistym.
Zobacz też
- hydrofobowy
- Termodynamika micelizacji
- Temperatura Kraffta
- środki powierzchniowo czynne
- Detergent
- Siła entropiczna
- Równanie Cole'a-Cole'a
- Bibliografia _ SA Curley (lipiec 2010). „Cytotoksyczność termiczna wywołana polem o częstotliwości radiowej w komórkach nowotworowych leczonych nanocząsteczkami fluorescencyjnymi” . Rak . 116 (13): 3285–93. doi : 10.1002/cncr.25135 . PMC 2928886 . PMID 20564640 .
- ^ Resch-Genger, Ute; Grabolle; Cavaliere-Jaricot; Nitschke; Nann (sierpień 2008). „Kropki kwantowe a barwniki organiczne jako znaczniki fluorescencyjne”. Metody natury . 5 (9): 763–775. doi : 10.1038/nmeth.1248 . PMID 18756197 . S2CID 9007994 .
-
Bibliografia
_ „Synteza i charakterystyka kropek kwantowych rdzeniowo-powłokowych CdSe-ZnS”.
{{ cite journal }}: Cite journal wymaga|journal=( pomoc ) - Bibliografia _ Yanxi Hu; Zhanjun Gu; Lei Liu; Hai-Chen Wu (lipiec 2011). „Zastosowanie kropek kwantowych w obrazowaniu biologicznym” . Dziennik nanomateriałów . 2011 : 1–13. doi : 10.1155/2011/834139 .
- Bibliografia _ RG brązowy; JE Szkło; RR Eley (1994). „Synteza, charakterystyka i reologia roztworu modelowych hydrofobowo modyfikowanych, rozpuszczalnych w wodzie etoksylowanych uretanów”. Langmuira . 10 (9): 3027–3034. doi : 10.1021/la00021a028 .
- ^ a b c Mathias, Errol V .; Julia Aponte; Julia A. Kornfield ; Yong Ba (październik 2010). „Właściwości ładowania i dyfuzji małocząsteczkowego leku w fluorowanym hydrożelu PEG badane za pomocą 1H dyfuzji molekularnej NMR i 19F dyfuzji spinowej NMR” . Nauka o koloidach i polimerach . 288 (18): 1655-1663. doi : 10.1007/s00396-010-2304-9 . PMC 2982959 . PMID 21170115 .
- Bibliografia _ _ , 890.
- ^ a b Tae, Giyoong; Julia A. Kornfield; Jeffry'ego A. Hubbella; Diethelma Johannsmanna; Thieo E. Hogen-Esch (maj 2001). „Hydrożele o kontrolowanej charakterystyce erozji powierzchniowej z samoorganizacji poli(glikolu etylenowego) zakończonego fluoroalkilem”. makrocząsteczki . 34 (18): 6409–6419. Bibcode : 2001MaMol..34.6409T . doi : 10.1021/ma0107511 .
- ^ Wyss, Hans; Ryana J. Larsona; David A. Weitz (2007). „Reologia oscylacyjna: pomiar lepkosprężystego zachowania miękkich materiałów” (PDF) . Laboratorium GIT . 3 (4): 68–70.
-
Bibliografia
_ AV Dobrynin (1997). Trendy w nauce o polimerach . 5 (6): 181.
{{ cytuj czasopismo }}: Brak lub pusty|tytuł=( pomoc ) -
Bibliografia
_ S. Ito; M. Sawodny; W. Knoll (1994). Trendy w nauce o polimerach . 2 : 313.
{{ cite journal }}: Brak lub pusty|title=( pomoc ) - Bibliografia _ JA Kornfield; JA Hubbell; Diethelm Johannsmann (17 września 2002). „Nieprawidłowa sorpcja w cienkich warstwach poli(glikoli etylenowych) zakończonych fluoroalkilem”. Langmuira . 18 (21): 8241–8245. doi : 10.1021/la020255l .
- ^ Yuan, Jipei; Dana Wena; Nikołaj Gaponik; Alexander Eychmuller (22 listopada 2012). „Obudowujące enzymy hydrożele i kserożele z kropkami kwantowymi jako bioczujniki: wielofunkcyjne platformy zarówno do biokatalizy, jak i sond fluorescencyjnych”. Angewandte Chemie wydanie międzynarodowe . 52 (3): 976–979. doi : 10.1002/anie.201205791 . PMID 23172829 .
- ^ Roullier, Victor; Fabiena Grasseta; Fouzia Boulmedais; Francka Artznera; Oliviera Cadora; Valerie Marchi-Artzner (15 października 2008). „Małe bioaktywowane magnetyczne micele kropek kwantowych” (PDF) . Chemia materiałów . 20 (21): 6657–6665. doi : 10,1021/cm801423r . Źródło 8 czerwca 2013 r .
- Bibliografia _ Ling Tong; Yan Zhao; Mateusza Hansena; Jin-Xin Cheng; Aleksander Wei (2007). „Hipertermiczny efekt nanoprętów złota na komórki nowotworowe” (PDF) . Nanomedycyna . 2 (1): 125–132. doi : 10.2217/17435889.2.1.125 . PMC 2597406 . PMID 17716198 .














![{G^{\prime\prime}(\omega) =\ } [G^{\prime}(\omega)G_0 - {G^{\prime}(\omega)}^2]^{-{1\over2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7065af8a404b619803278cc63fc916e7fbb746f2)









