Kwas karboranowy
 |
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
|
|
|
|
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
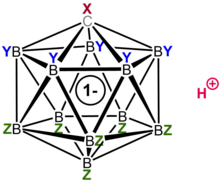
0 Kwasy karboranowe H(CXB
11 Y
5 Z
6 ) (X, Y, Z = H, Alk, F, Cl, Br, CF 3 ) to klasa superkwasów , z których niektóre szacuje się na co najmniej milion razy silniejsze niż 100% czysty kwas siarkowy pod względem wartości funkcji kwasowości Hammetta ( H ≤ –18) i mają obliczone wartości p Ka znacznie poniżej –20, co czyni je jednymi z najsilniejszych znanych kwasów Brønsteda. Najlepiej zbadanym przykładem jest silnie chlorowana pochodna H(CHB
11 Cl
11 ) . Stwierdzono, że kwasowość H(CHB
11 Cl
11 ) znacznie przewyższa kwasowość kwasu trifluorometanosulfonowego CF
3 SO
3 H i bistriflimidu , (CF
3 SO
2 )
2 NH , związków wcześniej uważanych za najsilniejsze wydzielalne kwasy.
Ich wysoka kwasowość wynika z rozległej delokalizacji ich sprzężonych zasad, anionów karboranowych (CXB 11 Y 5 Z 6 − ), które są zwykle dodatkowo stabilizowane przez grupy elektroujemne, takie jak Cl, F i CF 3 . Ze względu na brak właściwości utleniających oraz wyjątkowo niską nukleofilowość i wysoką stabilność sprzężonych z nimi zasad, są jedynymi superkwasami, o których wiadomo, że protonują fuleren C 60 bez jego rozkładu. Dodatkowo tworzą trwałe, dające się wyodrębnić sole z protonowanym benzenem C 6 H 7 + , macierzystym związkiem związków pośrednich Whelanda spotykanych w reakcjach elektrofilowego podstawienia aromatycznego .
Fluorowany kwas karborowy, H(CHB
11 F
11 ) , jest nawet silniejszy niż chlorowany kwas karboranowy. Jest w stanie protonować butan, tworząc tert -butylowy w temperaturze pokojowej i jest jedynym znanym kwasem, który protonuje dwutlenek węgla, dając mostkowany kation [H(CO
2 )
2 ] +
, co czyni go prawdopodobnie najsilniejszym znanym kwasem. W szczególności, CO2 nie ulega zauważalnemu protonowaniu, gdy jest traktowany mieszanymi superkwasami HF- SbF5 lub HSO3F - SbF5 .
0 Jako klasa, kwasy karboranowe tworzą najbardziej kwaśną grupę dobrze zdefiniowanych, dających się wyizolować znanych substancji, znacznie bardziej kwaśnych niż znane wcześniej jednoskładnikowe mocne kwasy, takie jak kwas trifluorowy lub kwas nadchlorowy . W niektórych przypadkach, takich jak wspomniane powyżej prawie perhalogenowane pochodne, ich kwasowości rywalizują (i prawdopodobnie przewyższają) kwasowości tradycyjnych mieszanych superkwasów Lewisa-Brønsteda, takich jak magiczny kwas i kwas fluoroantymonowy . (Jednak jak dotąd bezpośrednie porównanie nie było możliwe ze względu na brak miary kwasowości odpowiedniej dla obu klas kwasów: wartości p K a są źle zdefiniowane dla chemicznie złożonych kwasów mieszanych, podczas gdy Wartości H nie można zmierzyć dla bardzo wysokotopliwych kwasów karboranowych).
Kwasowość

11 Cl
11 ) jest monomerem w fazie gazowej, z kwasowym protonem (pokazanym na czerwono ) związanym z Cl(12) i wtórnie związanym z Cl(7). Postać monomeryczna jest metastabilna po skondensowaniu, ale ostatecznie polimeryzuje, dając strukturę z kwaśnym mostkiem protonowym między jednostkami karboranu. ( Uwaga : Linie między atomami węgla i boru w rdzeniu karboranowym pokazują łączność, ale nie powinny być interpretowane jako wiązania pojedyncze. Rzędy wiązań są mniejsze niż jeden z powodu niedoboru elektronów.)
0000 Siła kwasu Brønsteda-Lowry'ego odpowiada jego zdolności do uwalniania jonów wodoru. Jedną z powszechnych miar mocy kwasu dla stężonych, nadkwasowych mediów płynnych jest funkcja kwasowości Hammetta, H . W oparciu o jego zdolność do ilościowego protonowania benzenu, ostrożnie oszacowano, że chlorowany karboran kwas H(CHB
11 Cl
11 ) ma wartość H równą lub niższą od -18, co prowadzi do powszechnego twierdzenia, że kwasy karboranowe są co najmniej milion razy silniejsze niż 100% kwas siarkowy ( H = −12). Jednakże, ponieważ H mierzy zdolność protonowania ciekłego ośrodka, krystaliczny i wysokotopliwy charakter tych kwasów wyklucza bezpośredni pomiar tego parametru. Pod względem p Ka podstawników , nieco innej miary kwasowości, zdefiniowanej jako zdolność danej substancji rozpuszczonej do ulegania jonizacji w rozpuszczalniku, szacuje się, że kwasy karboranowe mają wartości p Ka poniżej -20, nawet bez odciągających elektrony na szacuje się, że atomy boru (np. H(CHB
11 H
11 ) mają ap Ka równe -24), przy czym (jeszcze nieznany) w pełni fluorowany analog H(CB
11 F
12 ) ma obliczone p Ka równe -46. Oczekuje się , że znany kwas H(CHB
11 F
11 ) z jednym atomem fluoru mniej będzie tylko nieznacznie słabszy (p Ka < −40).
W fazie gazowej H(CHB
11 F
11 ) ma obliczoną kwasowość 216 kcal/mol, w porównaniu z kwasowością określoną eksperymentalnie 241 kcal/mol (w rozsądnej zgodności z obliczoną wartością 230 kcal/mol) dla H _ ( CHB
11CI
11 ) . Natomiast HSbF 6 (uproszczony model dla substancji dostarczających protony w kwasie fluoroantymonowym ) ma obliczoną kwasowość w fazie gazowej równą 255 kcal/mol, podczas gdy wcześniej ustalonym eksperymentalnie rekordzistą był (C 4 F 9 SO 2 ) 2 NH, a kongener bistriflimidu , przy 291 kcal/mol. Zatem H(CHB
11 F
11 ) jest prawdopodobnie najbardziej kwaśną substancją zsyntetyzowaną dotychczas w masie, pod względem kwasowości w fazie gazowej. Ze względu na swoją wyjątkową reaktywność jest również silnym pretendentem do miana najbardziej kwaśnej substancji w fazie skondensowanej (patrz wyżej). Przewidywano niektóre nawet silniej kwaśne pochodne, z kwasowością fazy gazowej <200 kcal/mol.
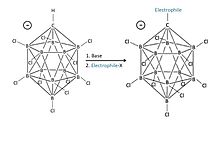
Kwasy karboranowe różnią się od klasycznych superkwasów tym, że są dobrze zdefiniowanymi substancjami jednoskładnikowymi. W przeciwieństwie do tego, klasyczne superkwasy są często mieszaninami kwasu Brønsteda i kwasu Lewisa (np. HF/SbF 5 ). Pomimo tego, że są najsilniejszymi kwasami, kwasy karboranowe na bazie boru są opisywane jako „delikatne”, czysto protonujące słabo zasadowe substancje bez dalszych reakcji ubocznych. Podczas gdy konwencjonalne superkwasy rozkładają fulereny ze względu na ich silnie utleniający kwasowy składnik Lewisa, kwas karboranowy ma zdolność protonowania fulerenów w temperaturze pokojowej, dając izolowalną sól. Ponadto anion powstający w wyniku przeniesienia protonu jest prawie całkowicie obojętny. Ta właściwość sprawia, że kwasy karboranowe są jedynymi substancjami, które są porównywalne pod względem kwasowości z mieszanymi superkwasami, które można również przechowywać w szklanej butelce, ponieważ różne gatunki dostarczające fluor (które atakują szkło) nie są obecne ani generowane.
Historia
Kwas karboranowy został po raz pierwszy odkryty i zsyntetyzowany przez profesora Christophera Reeda i jego współpracowników w 2004 roku na Uniwersytecie Kalifornijskim w Riverside. Cząsteczka macierzysta, z której pochodzi kwas karboranowy, dwudziestościenny anion karboranianowy, HCB
11 H
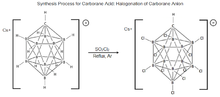
- 11 , została po raz pierwszy zsyntetyzowana w firmie DuPont w 1967 r. przez Waltera Knotha. Badania nad właściwościami tej cząsteczki zostały wstrzymane do połowy lat 80. XX wieku, kiedy czeska grupa naukowców zajmujących się borem, Plešek, Štíbr i Heřmánek, udoskonaliła proces halogenowania cząsteczek karboranu. Odkrycia te odegrały kluczową rolę w opracowaniu obecnej procedury syntezy kwasu karboranowego. Proces polega na poddaniu Cs + [HCB 11 H 11 ] − działaniu SO
2 Cl
2 , ogrzewaniu pod chłodnicą zwrotną pod suchym argonem w celu pełnego chlorowania cząsteczki z wytworzeniem kwasu karboranowego, ale wykazano, że całkowite chlorowanie zachodzi tylko w wybranych warunkach.
W 2010 roku Reed opublikował przewodnik zawierający szczegółowe procedury syntezy kwasów karboranowych i ich pochodnych. Niemniej jednak synteza kwasów karboranowych pozostaje długa i trudna oraz wymaga dobrze utrzymanego schowka rękawicowego i specjalistycznego sprzętu. Materiałem wyjściowym jest dostępny w handlu dekaboran(14) , substancja silnie toksyczna. Najlepiej zbadany kwas karboranowy H(CHB
11 Cl
11 ) jest przygotowywany w 13 krokach. Kilka ostatnich etapów jest szczególnie wrażliwych i wymaga komory rękawicowej o stężeniu < 1 ppm H 2 O bez oparów słabo zasadowych rozpuszczalników, ponieważ zasady tak słabe jak benzen lub dichlorometan będą reagować z elektrofilami na bazie karboranu i kwasami Brønsteda. Ostatnim etapem syntezy jest metateza soli węglanowej μ-hydridodisililu z nadmiarem cieczy, bezwodnym chlorowodorem, przypuszczalnie napędzana tworzeniem silnych wiązań Si – Cl i H – H w lotnych produktach ubocznych:
- [Et 3Si –H–SiEt 3 ] + [HCB 11 Cl 11 ] − + 2HCl → H(CHB
11 Cl
11 ) + 2Et 3 SiCl + H 2
- [Et 3Si –H–SiEt 3 ] + [HCB 11 Cl 11 ] − + 2HCl → H(CHB
Produkt wyodrębniono przez odparowanie produktów ubocznych i scharakteryzowano za pomocą podczerwieni (ν CH = 3023 cm -1 ) i jądrowego rezonansu magnetycznego (δ 4,55 (s, 1H, CH), 20,4 (s, 1H, H + ) w cieczy Widma SO 2 ) (zwróć uwagę na skrajne przesunięcie chemiczne kwaśnego protonu w dół pola). Chociaż reakcje stosowane w syntezie są analogiczne, uzyskanie czystej próbki bardziej kwaśnego H(CHB
11 F
11 ) okazało się jeszcze trudniejsze i wymagało niezwykle rygorystycznych procedur wykluczających śladowe ilości zanieczyszczeń słabo zasadowych.
Struktura
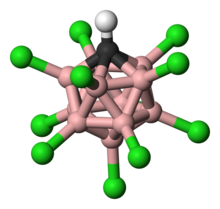
Kwas karboranowy składa się z 11 atomów boru; każdy atom boru jest związany z atomem chloru. Atomy chloru służą do zwiększania kwasowości i działają jak tarcze przed atakami z zewnątrz z powodu przeszkody sterycznej, którą tworzą wokół gromady. Gromada składająca się z 11 borów, 11 atomów chloru i pojedynczego atomu węgla jest sparowana z atomem wodoru związanym z atomem węgla. Atomy boru i węgla mogą tworzyć sześć wiązań ze względu na zdolność boru do tworzenia trójśrodkowych wiązań dwuelektronowych.
Chociaż struktura kwasu karboranowego różni się znacznie od konwencjonalnych kwasów, oba rozprowadzają ładunek i stabilność w podobny sposób. Anion węglanowy rozprowadza swój ładunek poprzez delokalizację elektronów w 12 atomach w klatce. Zostało to wykazane w badaniu dyfrakcji rentgenowskiej pojedynczego kryształu, ujawniając skrócone długości wiązań w heterocyklicznej części pierścienia, co sugeruje delokalizację elektronową.
Chlorowany anion karbaklozo-dodekaboranowy HCB 11
Cl -
11 jest wyjątkowo stabilnym anionem z wierzchołkami B – Cl opisanymi wcześniej jako „substytucyjnie obojętne”.
Deskryptor closo wskazuje, że cząsteczka formalnie pochodzi (przez zamianę B na C + ) z boranu o stechiometrii i ładunku [B n H n ] 2- ( n = 12 dla znanych kwasów karboranowych). Struktura podobna do klatki, utworzona przez 11 atomów boru i 1 atom węgla, umożliwia wysoce zdelokalizowane elektrony przez klatkę 3D (specjalna stabilizacja układu karboranowego została nazwana „σ-aromatycznością”), a wysoka energia wymagana do zakłócenia klastra boru w cząsteczce jest tym, co nadaje anionowi niezwykłą stabilność. Ponieważ anion jest wyjątkowo stabilny, nie będzie zachowywał się jak nukleofil w stosunku do protonowanego substratu, podczas gdy sam kwas jest całkowicie nieutleniający, w przeciwieństwie do kwaśnych składników Lewisa wielu superkwasów, takich jak pentafluorek antymonu. W związku z tym wrażliwe cząsteczki, takie jak C 60 , mogą być protonowane bez rozkładu.
Stosowanie
Istnieje wiele proponowanych zastosowań kwasów karboranowych na bazie boru. Na przykład zaproponowano je jako katalizatory krakingu węglowodorów i izomeryzacji n -alkanów z wytworzeniem rozgałęzionych izoalkanów (na przykład „izooktan”). Kwasy karboranowe mogą być również stosowane jako mocne, selektywne kwasy Brønsteda do precyzyjnych syntez chemicznych, gdzie korzystna może być niska nukleofilowość przeciwjonu. W mechanistycznej chemii organicznej można je wykorzystać do badania reaktywnych półproduktów kationowych. W syntezie nieorganicznej ich niezrównana kwasowość może pozwolić na izolację egzotycznych związków, takich jak sole protonowanego ksenonu.