Magiczny kwas
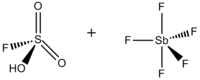 Kwas fluorosiarkowy-pentafluorek antymonu 1:1
|
|
| Identyfikatory | |
|---|---|
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA | 100.041.727 |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| HSbF 6 SO 3 | |
| Masa cząsteczkowa | 316,82 g/mol |
| Wygląd | Płyn |
| Zagrożenia | |
| Oznakowanie GHS : | |
  
|
|
| Niebezpieczeństwo | |
| H302+H332 , H411 | |
| P260 , P280 , P301+P312+P330 , P303+P361+P353 , P304+P340+P310 , P305+P351+P338 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Magiczny kwas ( FSO 3 H·SbF 5 ) to superkwas składający się z mieszaniny, najczęściej w stosunku molowym 1:1, kwasu fluorosiarkowego (HSO 3 F) i pentafluorku antymonu (SbF 5 ). Ten sprzężony Brønsteda – Lewisa został opracowany w latach 60. XX wieku przez laboratorium George'a Olaha na Uniwersytecie Case Western Reserve i był używany do stabilizacji karbokationów i hiperkoordynacji Jony karbonu w ośrodkach płynnych. Magiczny kwas i inne superkwasy są również używane do katalizowania izomeryzacji nasyconych węglowodorów i wykazano, że protonują nawet słabe zasady, w tym metan , ksenon , halogeny i wodór cząsteczkowy .
Historia
Termin „superkwas” został po raz pierwszy użyty w 1927 r., Kiedy James Bryant Conant odkrył, że kwas nadchlorowy może protonować ketony i aldehydy , tworząc sole w niewodnym roztworze. Sam termin został wymyślony przez RJ Gillespie później, po tym, jak Conant połączył kwas siarkowy z kwasem fluorosiarkowym i stwierdził, że roztwór jest kilka milionów razy bardziej kwaśny niż sam kwas siarkowy. System kwasu magicznego został opracowany w latach 60. XX wieku przez George'a Olaha i miał służyć do badania stabilnych karbokationów. Gillespie wykorzystał również system kwasowy do wytworzenia kationów nieorganicznych z niedoborem elektronów. Nazwa pochodzi od przyjęcia bożonarodzeniowego w 1966 roku, kiedy członek laboratorium Olah umieścił w nim a parafinową do kwasu i stwierdził, że rozpuścił się dość szybko. Badanie roztworu za pomocą 1H -NMR wykazało obecność kationu tert -butylu, co sugeruje, że łańcuch parafiny tworzący wosk został rozszczepiony, a następnie izomeryzowany do stosunkowo trwałej karbokationu trzeciorzędowego. Nazwisko pojawiło się w artykule opublikowanym przez laboratorium Olah.
Nieruchomości
Struktura
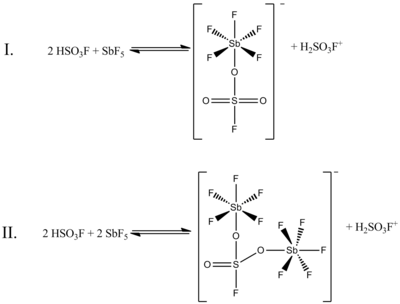
Chociaż stosunek molowy 1:1 HSO 3 F i SbF 5 najlepiej generuje jony karbonowe, udokumentowano również efekty działania systemu przy innych stosunkach molowych. Kiedy stosunek SbF5 : HSO3F jest mniejszy niż 0,2, następujące dwie równowagi, określone za pomocą spektroskopii 19F NMR, są najbardziej widoczne w roztworze:
(W obu tych strukturach siarka ma czworościenną koordynację, a nie płaską. Wiązania podwójne między siarką a tlenem są bardziej właściwie reprezentowane jako wiązania pojedyncze, z formalnymi ładunkami ujemnymi na atomach tlenu i formalnym ładunkiem plus dwa na siarce. atomy antymonu również będą miały ładunek formalny minus jeden).
Na powyższym rysunku równowaga I stanowi 80% danych NMR, podczas gdy równowaga II stanowi około 20%. Gdy stosunek obu związków wzrasta od 0,4 do 1,4, pojawiają się nowe sygnały NMR, których intensywność wzrasta wraz ze wzrostem stężenia SbF 5 . Zmniejsza się również rozdzielczość sygnałów, ze względu na rosnącą lepkość układu cieczy.
Wytrzymałość
0 Wszystkie kwasy wytwarzające protony mocniejsze niż 100% kwas siarkowy są uważane za superkwasy i charakteryzują się niskimi wartościami funkcji kwasowości Hammetta . Na przykład kwas siarkowy, H 2 SO 4 , ma funkcję kwasowości Hammetta, H , wynoszącą -12, kwas nadchlorowy , HClO 4 , ma funkcję kwasowości Hammetta, wynoszącą -13, oraz funkcję kwasu magicznego 1:1, HSO3F ·SbF5 , wynosi -23 . Uważa się, że kwas fluoroantymonowy , najsilniejszy znany superkwas, dociera do ekstrapolowanej H 0 wartości do -28.
Używa
Obserwacje stabilnych karbokationów
Kwas magiczny ma niską nukleofilowość, co pozwala na zwiększoną stabilność karbokationów w roztworze. „Klasyczną” trójwartościową karbokation można zaobserwować w kwaśnym środowisku i stwierdzono, że jest planarna i sp 2 -hybrydyzowana. Ponieważ atom węgla jest otoczony tylko sześcioma elektronami walencyjnymi, jest wysoce pozbawiony elektronów i elektrofilowy. Można go łatwo opisać za pomocą struktur kropkowych Lewisa, ponieważ zawiera tylko dwuelektronowe, pojedyncze wiązania z sąsiednimi atomami węgla. Wiele trzeciorzędowych kationów cykloalkilowych może również tworzyć się w roztworach nadkwasowych. Jednym z takich przykładów jest kation 1-metylo-1-cyklopentylu, który powstaje zarówno z prekursora cyklopentanu, jak i cykloheksanu. w przypadku cykloheksan , kation cyklopentylowy powstaje z izomeryzacji drugorzędowej karbokationu do trzeciorzędowej, bardziej stabilnej karbokationu. Zaobserwowano również jony cyklopropylokarbeniowe, kationy alkenylowe i kationy arenu.
Jednak w miarę jak stosowanie systemu kwasu magicznego stało się bardziej rozpowszechnione, zaobserwowano karbokationy o wyższych współrzędnych. Karbokationy z pięcioma współrzędnymi, określane również jako jony nieklasyczne , nie mogą być przedstawione przy użyciu tylko wiązań dwuelektronowych i dwucentrowych, a zamiast tego wymagają wiązań dwuelektronowych i trzech (lub więcej) centrów. W tych jonach dwa elektrony są zdelokalizowane na więcej niż dwa atomy, co powoduje, że te centra wiązań są tak pozbawione elektronów, że umożliwiają udział nasyconych alkanów w reakcjach elektrofilowych. Odkrycie hiperskoordynowanych karbokationów podsyciło nieklasyczne kontrowersje dotyczące jonów w latach pięćdziesiątych i sześćdziesiątych. Ze względu na powolną skalę czasową 1 H-NMR, szybko równoważące się ładunki dodatnie na atomach wodoru prawdopodobnie pozostałyby niewykryte. Jednak spektroskopia IR , spektroskopia Ramana i 13 C NMR zostały wykorzystane do zbadania mostkowych układów karbokationowych. Jeden kontrowersyjny kation, kation norbornylowy, zaobserwowano w kilku mediach, między innymi w kwasie magicznym.
Mostkowy atom węgla metylenu jest pięciokoordynacyjny, z trzema dwuelektronowymi, dwuśrodkowymi wiązaniami i jednym dwuelektronowym, trójśrodkowym wiązaniem z pozostałym orbitalem sp 3 . Obliczenia mechaniki kwantowej wykazały również, że model klasyczny nie jest minimum energii.
Reakcje z alkanami
Magiczny kwas jest zdolny do protonowania alkanów . Na przykład metan reaguje, tworząc CH
+ 5 w temperaturze 140°C i pod ciśnieniem atmosferycznym, chociaż jako produkty uboczne powstają również jony węglowodorów o większej masie cząsteczkowej. Wodór jest kolejnym produktem ubocznym reakcji.
Wykazano, że w obecności FSO 3 D zamiast FSO 3 H metan zamienia atomy wodoru na atomy deuteru i uwalnia się HD zamiast H 2 . Jest to dowód sugerujący, że w tych reakcjach metan rzeczywiście jest zasadą i może przyjąć proton z kwaśnego środowiska, tworząc CH
+ 5 . Jon ten jest następnie deprotonowany, co wyjaśnia wymianę wodoru lub traci cząsteczkę wodoru, tworząc CH
+ 3 – jon karboniowy. Gatunek ten jest dość reaktywny i może dać kilka nowych karbokationów, pokazanych poniżej.
Większe alkany, takie jak etan, są również reaktywne w magicznym kwasie i oba wymieniają atomy wodoru i kondensują, tworząc większe karbokationy, takie jak protonowany neopentan. Jon ten jest następnie rozszczepiany w wyższych temperaturach i reaguje z uwolnieniem gazowego wodoru i tworzy kation t-amylowy w niższych temperaturach.
Właśnie w tej notatce George Olah sugeruje, abyśmy nie uznawali już za synonimy nazw „alkan” i „parafina”. Słowo „parafina” pochodzi od łacińskiego „parum affinis”, co oznacza „brak powinowactwa”. Mówi: „Jednak z pewną nostalgią przedstawiamy to zalecenie, ponieważ„ gazy obojętne ”przynajmniej zachowały swoją„ szlachetność ”, gdy ich reaktywność chemiczna stała się widoczna, ale odwoływanie się do„ szlachetnych węglowodorów ”wydawałoby się niewłaściwe. "
Kataliza z wodoronadtlenkami
Magiczny kwas katalizuje reakcje rozszczepienia-przegrupowania trzeciorzędowych wodoronadtlenków i trzeciorzędowych alkoholi. Charakter eksperymentów użytych do określenia mechanizmu, a mianowicie fakt, że odbywały się one w superkwaśnym środowisku, pozwolił na obserwację powstających półproduktów karbokationowych. Ustalono, że mechanizm zależy od ilości użytego magicznego kwasu. W pobliżu równoważności molowej obserwuje się tylko rozszczepienie O – O, ale wraz ze wzrostem nadmiaru kwasu magicznego rozszczepienie C – O konkuruje z rozszczepieniem O – O. Nadmiar kwasu prawdopodobnie dezaktywuje nadtlenek wodoru powstały w heterolizie C – O.
Magiczny kwas katalizuje również elektrofilową hydroksylację związków aromatycznych za pomocą nadtlenku wodoru, co skutkuje wysokowydajnym przygotowaniem produktów monohydroksylowanych. Fenole istnieją jako całkowicie protonowane formy w roztworach superkwasów, a gdy są wytwarzane w reakcji, są następnie dezaktywowane w kierunku dalszego ataku elektrofilowego. Protonowany nadtlenek wodoru jest aktywnym środkiem hydroksylującym.
Kataliza z ozonem
Utlenianie alkanów można katalizować roztworem magicznego kwasu – SO 2 ClF w obecności ozonu . Mechanizm jest podobny do mechanizmu protolizy alkanów, z elektrofilową insercją w pojedyncze wiązania σ alkanu. Stan przejściowy kompleksu węglowodorowo-ozonowego ma postać jonu penta-skoordynowanego.
Alkohole, ketony i aldehydy są również utleniane przez insercję elektrofilową.
Bezpieczeństwo
Podobnie jak w przypadku wszystkich silnych kwasów, a zwłaszcza superkwasów, należy stosować odpowiednie środki ochrony indywidualnej. Poza obowiązkowymi rękawiczkami i goglami zaleca się również stosowanie osłony twarzy i maski na całą twarz. Zgodnie z przewidywaniami magiczny kwas jest wysoce toksyczny po spożyciu i wdychaniu, powoduje poważne oparzenia skóry i oczu oraz jest toksyczny dla organizmów wodnych.
Zobacz też
- Kwas fluoroantymonowy , najsilniejszy znany superkwas