Kwas sekalonowy
Kwasy sekalonowe to grupa chiralnych dimerycznych tetrahydroksantonów blisko spokrewnionych z ergoflawiną i ergochryzyną A, które są wspólnie nazywane ergochromami i należą do klasy mikotoksyn początkowo wyizolowanych jako główne pigmenty sporyszu z grzybów Claviceps purpurea , które rosną pasożytniczo na życicy . Od najdawniejszych czasów, a zwłaszcza w średniowiecznej Europie, spożywanie zbóż zawierających sporysz wielokrotnie prowadziło do masowych zatruć znanych jako zatrucie sporyszem które było spowodowane toksycznymi alkaloidami sporyszu i mykotoksynami, takimi jak ergochromy, z powodu zanieczyszczenia mąki przez C. purpurea . Zidentyfikowano grupę genów odpowiedzialnych za syntezę kwasów sekalonowych u C. purpurea . Kwas sekalonowy D, enancjomer kwasu sekalonowego A, jest główną toksyną środowiskową, wyizolowaną z grzyba Penicillium oxalicum i jest głównym zanieczyszczeniem mikrobiologicznym świeżo zebranej kukurydzy, które powoduje toksyczność poprzez zanieczyszczenie środków spożywczych.
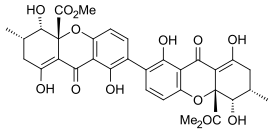
- Duże ergochromy sporyszu i kwas sekalonowy D
Występowanie
Oprócz występowania w C. purpurea kwasy sekalonowe A, B, D i ergoflawinę wyizolowano również z innych grzybów, a trzy kwasy sekalonowe znaleziono również w różnych porostach. Do tej pory wyizolowano i zidentyfikowano strukturalnie co najmniej dwudziestu dwóch członków rodziny ergochromów, w tym kwas sekalonowy E (enancjomer kwasu sekalonowego A) z grzyba Phoma terrestris , kwas sekalonowy F z grzyba Aspergillus aculeatus i kwas sekalonowy G z grzyba Pyrenochaeta terrestris . Ponadto z Blennoria sp ., grzyb endofityczny z Carpobrotus edulis .
Bioaktywność
Sekaloniczna rodzina mykotoksyn metabolitów wtórnych wykazuje interesujące bioaktywności. Kwas sekalonowy A ma właściwości przeciwnowotworowe, a także zmniejsza kolchicyny w neuronach korowych szczura . Ponadto wykazano, że kwas sekalonowy A chroni przed dopaminergicznych w mysim modelu choroby Parkinsona . Kwas sekalonowy B ma również działanie przeciwnowotworowe. Podczas testowania na mysim czerniaku B16 stwierdzono, że jest aktywny w niskim zakresie mikromolowym. Okazał się również skutecznym środkiem przeciwdrobnoustrojowym przeciwko Gram-dodatnie bakterie ( Bacillus megaterium ) i bakterie Gram-ujemne ( Escherichia coli ) i stwierdzono, że działają przeciwgrzybiczo na ( Microbotryum violaceum ) i przeciw glonom ( Chlorella fusca ). Kwas sekalonowy D (SAD) jest substancją toksyczną i teratogenną metabolit. Zaobserwowano działanie teratogenne w rozwoju szczurów narażonych na wstrzyknięcie SAD podczas rozwoju płodu. SAD wykazywał silną cytotoksyczność wobec komórek oporności wielolekowej (MDR) i ich komórek rodzicielskich. Badanie aktywności przeciwnowotworowej SAD wykazało, że wywiera on silne działanie cytotoksyczne na komórki SP, z powodu indukcji ABCG2 przez kalpainę-1 aktywacja. Ergoflawina wykazywała dobrą aktywność przeciwzapalną i dobrą aktywność przeciwnowotworową, w tym znaczące hamowanie proliferacji, szczególnie w komórkach raka trzustki, nerki i płuc, i może wywierać swoje działanie poprzez mechanizmy podobne do działania kwasu sekalonowego D.
Struktura
Ergoflawina została po raz pierwszy wyizolowana w czystej postaci z Claviceps purpurea (sporysz) w 1958 r. Wykazano, że jest dimerem połączonym 2,2'-biarylem w 1963 r., A struktura potwierdzona w tym roku przez analizę rentgenowską monokryształu. W ciągu następnej dekady struktury kwasów sekalonowych A, B, C, D i ergochryzyny A były podobnie mocno ugruntowane i chociaż istniały pewne wczesne spory, czy były one 2,2'-, 4,4'- czy nawet 2,4 „-połączone” potwierdzono, że one również były wszystkie związane 2,2'-połączeniem między resztami bifenylowymi. Stwierdzono, że we wszystkich znanych kwasach sekalonowych podstawniki metylowy i metoksykarbonylowy są trans względem siebie, a analiza rentgenowska struktury krystalicznej kwasu sekalonowego A wykazała, że wiązanie 2,2'-biarylowe było niepłaskie, a kąt między dwiema płaszczyznami bifenylowymi wynosił 36,5°.
Wykazano, że kwasy sekalonowe zawierające tetrahydroksanton są niestabilne w warunkach zasadowych i mogą łatwo ulegać izomeryzacji wynikającej z wymiany wiązań eterowych. 2-2'-związany kwas sekalonowy A izomeryzuje w DMSO w temperaturze pokojowej do 2-4'-połączonego kwasu sekalonowego A i 4-4-połączonego kwasu sekalonowego A w ciągu 13 godzin, osiągając równowagę 3,2:2:1. Ta izomeryzacja przebiega szybciej w obecności zasady (DMSO/pirydyna).
Synteza
Wspólną kluczową cechą syntezy ergoflawiny i kwasów sekalonowych jest dimeryzacja biarylu zabezpieczonych monomerów jodo-arylu z Cu lub Pd. Synteza Whalleya ergoflawiny 3 z hemiergoflawiny 1 w 1971 roku została osiągnięta przez sprzęganie z niską wydajnością dwóch zabezpieczonych monomerów 2-jodo-hemiegoflawiny 2 z miedzią w warunkach reakcji Ullmanna , a następnie odbezpieczenie kwasem.
Podobnie ponad czterdzieści lat później synteza Porco bardziej labilnego kwasu sekalonowego D z 60% wydajnością polegała na sprzęganiu dwóch zabezpieczonych monomerów jodowych poprzez ich stanny z CuCl w temperaturze pokojowej, podczas gdy Tietze osiągnął podobną syntezę kwasu sekalonowego E przez sprzęganie dwóch zabezpieczonych monomerów jodowych z Pd(OAc) 2 w warunkach Suzuki w 70°C z wydajnością 85%.