Peptydomimetyk
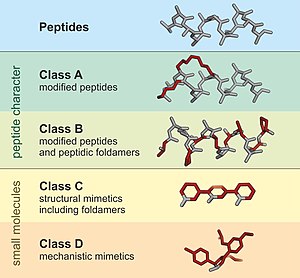
Peptydomimetyk to mały, podobny do białka łańcuch zaprojektowany do naśladowania peptydu . Zwykle powstają one albo w wyniku modyfikacji istniejącego peptydu, albo poprzez zaprojektowanie podobnych systemów, które naśladują peptydy, takie jak peptydy i β-peptydy . Niezależnie od podejścia, zmieniona struktura chemiczna ma na celu korzystne dopasowanie właściwości molekularnych, takich jak stabilność czy aktywność biologiczna . Może to odgrywać rolę w opracowywaniu związków podobnych do leków z istniejących peptydów. Peptydomimetyki można otrzymać przez cyklizację liniowych peptydów lub sprzęganie stabilnych nienaturalnych aminokwasów. Modyfikacje te obejmują zmiany w peptydzie, które nie wystąpią naturalnie (takie jak zmienione szkielety i włączenie nienaturalnych aminokwasów ). Aminokwasy nienaturalne można wytwarzać z ich natywnych analogów poprzez modyfikacje, takie jak alkilowanie aminy, podstawienie łańcucha bocznego, cyklizacja wydłużania wiązania strukturalnego i podstawienia izosteryczne w szkielecie aminokwasowym. W oparciu o ich podobieństwo do peptydu prekursorowego, peptydomimetyki można podzielić na cztery klasy (A – D), gdzie A wykazuje największe podobieństwo, a D najmniej. Klasy A i B obejmują rusztowania podobne do peptydów, podczas gdy klasy C i D obejmują małe cząsteczki (ryc. 1).
Zastosowania peptydomimetyków
Stosowanie peptydów jako leków ma pewne wady ze względu na ich biodostępność i biostabilność. Szybka degradacja, słaba dostępność po podaniu doustnym, utrudniony transport przez błony komórkowe, nieselektywne wiązanie z receptorami i trudne wieloetapowe przygotowanie to główne ograniczenia peptydów jako aktywnych składników farmaceutycznych. Dlatego małe łańcuchy podobne do białek, zwane peptydomimetykami, można by zaprojektować i wykorzystać do naśladowania natywnych analogów i prawdopodobnie wykazywać lepsze właściwości farmakologiczne. Wiele peptydomimetyków jest wykorzystywanych jako leki zatwierdzone przez FDA, takie jak Romidepsin (Istodax), Atazanavir (Reyataz), Saquinavir (Invirase), Oktreotyd (Sandostatin), Lanreotyd (Somatuline), Plecanatide (Trulance), Ximelagatran (Exanta), Etelcalcetide (Parsabiv) i Bortezomib (Velcade).
D-peptydy
D- peptyd to mała sekwencja D-aminokwasów . Ponieważ rybosomy są specyficzne dla L-aminokwasów, D-peptydy rzadko występują naturalnie w organizmach i nie są łatwo trawione ani degradowane. Peptydomimetyki D-peptydowe to D-peptydy zaprojektowane tak, aby naśladować naturalne L-peptydy, które zwykle mają właściwości terapeutyczne.
Właściwości D-peptydów

Po umieszczeniu w niechiralnym rozpuszczalniku, takim jak woda, D-peptydy, jak również większe polipeptydy D-białka, mają podobne, ale lustrzane właściwości do L-peptydów i L-białek o identycznych sekwencjach. Jeśli białko L nie wymaga białka opiekuńczego lub kofaktora strukturalnego do fałdowania, jego białko enancjomer D powinno mieć konformację lustrzanego odbicia w stosunku do białka L (ryc. 2). Enzym D powinien działać na substraty o odwróconej chiralności w porównaniu do enzymu L o tej samej sekwencji. wiąże się L-peptyd z białkiem L, ich odpowiedniki w postaci peptydu D i białka D powinny wiązać się ze sobą w sposób lustrzany.
D-peptydy mają również właściwości, które czynią je atrakcyjnymi jako leki. D-peptydy są mniej podatne na degradację w żołądku lub wewnątrz komórek przez proteolizę . Leki D-peptydowe mogą być zatem przyjmowane doustnie i są skuteczne przez dłuższy czas. D-peptydy są łatwe do syntezy w porównaniu z wieloma innymi lekami. W niektórych przypadkach peptydy D mogą wykazywać słabą immunogenną .
Metody projektowania D-peptydów
Ret projekt
Peptyd L ma trzy sekwencje analogowe (Rysunek 3) zbudowane z aminokwasów L i D: enancjomer D lub peptyd inwersyjny o tej samej sekwencji, ale złożony z D-aminokwasów i konformacji lustrzanej; retropeptyd składający się z tej samej sekwencji aminokwasów L, ale w odwrotnej kolejności; oraz peptyd retro-inverso lub D-retro-enancjomer, składający się z D-aminokwasów w odwróconej sekwencji.
Podczas gdy L-peptyd i jego D-enancjomer są wzajemnie lustrzanymi strukturami, L-retro-peptyd jest lustrzanym odbiciem D-retro-inverso-peptydu. Z drugiej strony, L-peptyd i D-retro-inverso-peptyd mają podobny układ łańcuchów bocznych, chociaż ich grupy karboksylowe i aminowe są skierowane w przeciwnych kierunkach. W przypadku małych peptydów, których wiązanie nie zależy od struktury drugorzędowej, L-peptyd i jego D-retro-inverso-peptyd prawdopodobnie będą miały podobne powinowactwo wiązania z docelowym białkiem L.

Wyświetlacz fagów w lustrzanym odbiciu
Prezentacja fagowa to technika przeszukiwania dużych bibliotek peptydów pod kątem wiązania z białkiem docelowym. W prezentacji fagowej sekwencja DNA kodująca potencjalny lek-peptyd jest poddawana fuzji z genem płaszcza białkowego bakteriofaga i wprowadzana do wektora. Różnorodność można wprowadzić do peptydu przez mutagenezę . Peptydy otoczki białkowej są następnie eksprymowane i oczyszczane, a następnie nakładane na powierzchnię unieruchomionych celów białkowych. Powierzchnia jest następnie wypłukiwana w celu usunięcia niewiążących peptydów, podczas gdy pozostałe peptydy wiążące są eluowane.
Prezentacja na fagach w lustrzanym odbiciu jest podobną metodą, której można użyć do przeszukiwania dużych bibliotek D-peptydów, które wiążą się z docelowymi białkami L. Dokładniej, ponieważ peptydy D nie mogą ulegać ekspresji w bakteriofagach, fagi w lustrzanym odbiciu wyświetlają L-peptydy, które wiążą się z unieruchomionymi białkami D, które zostały wcześniej zsyntetyzowane chemicznie . Ze względu na lustrzane właściwości peptydów D, enancjomer D peptydu L, który wiąże się z białkiem D, będzie wiązał się z białkiem L.
Prezentacja na fagach w lustrzanym odbiciu ma jednak dwie wady w porównaniu z prezentacją na fagach. Docelowe białka D muszą być syntetyzowane chemicznie, co zwykle jest procesem kosztownym i czasochłonnym. Ponadto białko docelowe nie może wymagać kofaktora ani białka opiekuńczego do fałdowania, w przeciwnym razie chemicznie syntetyzowane białko D nie będzie fałdować się do docelowej, lustrzanej struktury.

Podobieństwo strukturalne
Peptyd o strukturze drugorzędowej nie może być naśladowany przez jego retro-odwrotność, ponieważ łączenie w odwrotnej kolejności przerywa wiele interakcji szkieletowych istotnych dla struktury drugorzędowej. Podejście do naśladowania tych peptydów polega na wyszukiwaniu podobnych (łańcuchów bocznych) struktur w lustrzanej kopii Protein Data Bank dla elementów strukturalnych, a następnie łączeniu sekcji za pomocą odwróconych wersji pętli znalezionych w oryginalnym białku.
Małe cząsteczki
Przykłady
Podejścia peptydomimetyczne zostały wykorzystane do zaprojektowania małych cząsteczek, które selektywnie zabijają komórki rakowe, podejście znane jako chemioterapia celowana , poprzez indukowanie zaprogramowanej śmierci komórki w procesie zwanym apoptozą . Poniższe dwa przykłady naśladują białka zaangażowane w kluczowe interakcje białko-białko , które reaktywują szlak apoptozy w raku, ale robią to za pomocą różnych mechanizmów.
W 2004 roku Walensky i współpracownicy opisali stabilizowany alfa-helikalny peptyd, który naśladuje proapoptotyczne białka zawierające tylko BH3, takie jak BID i BAD . Cząsteczka ta została zaprojektowana w celu stabilizacji natywnej struktury helikalnej poprzez utworzenie makrocyklu między łańcuchami bocznymi, które nie biorą udziału w wiązaniu. Ten proces, określany jako zszywanie peptydów , wykorzystuje nienaturalne aminokwasy w celu ułatwienia makrocyklizacji poprzez metatezę olefin z zamknięciem pierścienia . W tym przypadku zidentyfikowano spiętą helisę BH3, która specyficznie aktywuje mitochondrialny szlak apoptotyczny przez antagonizowanie sekwestracji białek zawierających tylko BH3 przez białka antyapoptotyczne (np. Bcl-2 , patrz także wewnętrzne i zewnętrzne induktory apoptozy). Ta cząsteczka hamowała wzrost ludzkiej białaczki w mysim modelu ksenoprzeszczepu .
Również w 2004 roku Harran i współpracownicy opisali dimeryczną małą cząsteczkę, która naśladuje proapoptotyczne białko Smac (patrz regulacja mitochondriów w apoptozie). Ta cząsteczka naśladuje N-końcowy motyw liniowy Ala-Val-Pro-Ile. Wyjątkowo, dimeryczna struktura tego peptydomimetyka doprowadziła do wyraźnego wzrostu aktywności w stosunku do analogicznego monomeru. Ta wiążąca współpraca wynika ze zdolności cząsteczki do naśladowania również struktury homodimerycznej Smac, która jest funkcjonalnie ważna dla reaktywacji kaspaz. Mimetyki Smac tego typu mogą uwrażliwiać szereg niedrobnokomórkowych komórek raka płuca na konwencjonalne chemioterapeutyki (np. gemcytabinę , winorelbinę ) zarówno in vitro, jak iw mysich modelach ksenoprzeszczepów.
Heterocykle są często używane do naśladowania wiązania amidowego peptydów. Na przykład tiazole znajdują się w naturalnie występujących peptydach i są używane przez naukowców do naśladowania wiązania amidowego peptydu.
Zobacz też
- apoptoza
- Beta-peptyd
- Rak
- Kliknięty polimer peptydowy
- depsipeptyd
- Rozszerzony kod genetyczny
- Foldamery
- Aminokwasy niebiałkowe