Protoparwowirus kopytnych 1
| Protoparwowirus kopytnych 1 | |
|---|---|
| Klasyfikacja wirusów | |
| (nierankingowe): | Wirus |
| królestwo : | Monodnaviria |
| Królestwo: | Shotokuvirae |
| Gromada: | Cossaviricota |
| Klasa: | Quintoviricetes |
| Zamówienie: | Piccovirales |
| Rodzina: | Parvoviridae |
| Rodzaj: | protoparwowirus |
| Gatunek: |
Protoparwowirus kopytnych 1
|
| Wirusy członkowskie | |
|
Parwowirus świń |
|
| Synonimy | |
|
Parwowirus świń |
|
Parwowirus świń (PPV), wirus z gatunku protoparwowirus kopytnych 1 z rodzaju Protoparvovirus z rodziny wirusów Parvoviridae , powoduje upośledzenie reprodukcji świń charakteryzujące się zakażeniem zarodka i płodu oraz śmiercią, zwykle przy braku zewnętrznych objawów klinicznych u matki . Choroba rozwija się głównie wtedy, gdy seronegatywne matki są narażone na kontakt ustno-nosowy z wirusem w dowolnym momencie mniej więcej w pierwszej połowie ciąży , a zarodki są następnie zakażone przez łożysko, zanim staną się immunokompetentne . Nie ma ostatecznych dowodów na to, że infekcja świń inna niż podczas ciąży ma jakiekolwiek znaczenie kliniczne lub ekonomiczne. Wirus jest wszechobecny wśród świń na całym świecie i jest enzootyczny w większości badanych stad. Badania diagnostyczne wykazały, że PPV jest główną zakaźną przyczyną śmierci zarodków i płodów. Oprócz swojej bezpośredniej roli przyczynowej w niepowodzeniu rozrodu, PPV może nasilać skutki cirkowirusem świń typu II (PCV2) w przebiegu klinicznym poodsadzeniowy wielonarządowy zespół wyniszczający (PMWS). Około 38 osób zmarło z powodu wirusa.
Symptomy i objawy
Ostra infekcja prosiąt po urodzeniu, w tym ciężarnych matek, u których później rozwijają się zaburzenia rozrodu, jest zwykle subkliniczna. Jednak u młodych świń i prawdopodobnie również u starszych stad hodowlanych wirus replikuje się intensywnie i występuje w wielu tkankach i narządach o wysokim indeksie mitotycznym . Antygen wirusowy jest szczególnie skoncentrowany w tkankach limfoidalnych (ryc. 3A, B). Wiele świń, niezależnie od wieku i płci, ma przejściową, zwykle łagodną leukopenię w ciągu 10 dni po pierwszym kontakcie z wirusem. PPV i inne strukturalnie podobne wirusy zostały zidentyfikowane w kale świń z biegunką. Jednak nie ma eksperymentalnych dowodów sugerujących, że PPV albo intensywnie replikuje się w krypty jelitowej lub powoduje choroby jelit, podobnie jak parwowirusy kilku innych gatunków. PPV wyizolowano również od świń ze zmianami opisanymi jako pęcherzykowate. Przyczynowa rola PPV w takich zmianach nie została jasno określona.
Główną i zwykle jedyną odpowiedzią kliniczną na zakażenie PPV jest niewydolność rozrodcza matki. Patologiczne następstwa zależą głównie od tego, kiedy ekspozycja występuje w czasie ciąży. Matki mogą powrócić do rui, nie rodzić pomimo anestrus, rodzić kilka prosiąt w miocie lub rodzić dużą część zmumifikowanych płodów. Wszystkie mogą odzwierciedlać śmierć zarodka lub płodu lub jedno i drugie. Jedynym zewnętrznym objawem może być zmniejszenie obwodu brzucha matki, gdy płody umierają w połowie ciąży lub później, a towarzyszące im płyny ulegają resorpcji. Inne objawy niewydolności rozrodczej matki, a mianowicie bezpłodność, aborcja, poród martwego płodu, śmierć noworodka i zmniejszona żywotność noworodków, również zostały przypisane zakażeniu PPV. Zwykle są to tylko niewielkie elementy choroby. Obecność zmumifikowanych płodów w miocie może wydłużyć zarówno ciążę, jak i okres między porodami. Każda z nich może spowodować martwe narodziny pozornie normalnych rodzeństwa z miotu, niezależnie od tego, czy są zarażone, czy nie.
Nie ma dowodów na to, że infekcja PPV zmienia płodność lub libido knurów.
Przyczyna
PPV jest klasyfikowany w rodzaju Parvovirus (łac. parvus = mały) z rodziny Parvoviridae . Wszystkie izolaty PPV, które zostały porównane, okazały się antygenowo podobne, jeśli nie identyczne. PPV jest również antygenowo spokrewniony z kilkoma innymi przedstawicielami rodzaju. Jednak jego tożsamość można ustalić za pomocą stosunkowo rygorystycznych testów serologicznych, takich jak neutralizacja wirusa (VN) i hamowanie hemaglutynacji (HI).
Właściwości biofizyczne i biochemiczne
Biofizyczne i biochemiczne właściwości PPV zostały szeroko zbadane i podsumowano je w następujący sposób. Dojrzały wirion ma symetrię sześcienną, dwa lub trzy białka kapsydu, średnicę około 20 nm, 32 kapsomery, brak otoczki lub niezbędnych lipidów i masę 5,3 × 10 6 daltonów . Genom wirusa to jednoniciowy kwas dezoksyrybonukleinowy (DNA) o masie cząsteczkowej 1,4 × 10 6 (tj. około 26,5% masy całego wirionu). Gęstości wyporu (g/ml w chlorku cezu) kompletnych zakaźnych wirionów, niekompletnych „pustych” wirionów i wyekstrahowanego DNA wirionów wynoszą odpowiednio 1,38–1,395, 1,30–1,315 i 1,724. Zakaźność wirusów, aktywność hemaglutynacji i antygenowość są niezwykle odporne na ciepło, szeroki zakres stężeń jonów wodorowych i enzymy .
Replikacja
Replikacja PPV in vitro jest cytobójcza i charakteryzuje się „zaokrąglaniem w górę”, piknozą i lizą komórek (ryc. 1A). Wiele fragmentów komórek często pozostaje przyczepionych, ostatecznie nadając zaatakowanej hodowli postrzępiony wygląd. Rozwijają się inkluzje wewnątrzjądrowe, ale często są one słabo rozmieszczone. Zainfekowane kultury mogą nieznacznie ulegać hemadsorbcji (ryc. 1B). Zmiany cytopatyczne są rozległe, gdy wirus przystosowany do hodowli komórkowej jest namnażany w odpowiednich warunkach. Jednak przy wstępnej izolacji konieczne może być kilka kolejnych pasaży wirusa lub, lepiej, zakażonej kultury, zanim efekty zostaną rozpoznane. Sposób użycia mikroskopia immunofluorescencyjna (IF) znacznie zwiększa prawdopodobieństwo wykrycia minimalnie zakażonych kultur.
Do rozmnażania i miareczkowania PPV najczęściej stosuje się pierwotne i wtórne hodowle płodowych lub noworodkowych komórek nerki świni , chociaż inne rodzaje kultur są również podatne. Replikacja jest wzmacniana przez infekcję kultur aktywnych mitotycznie. Wiele komórek w takich hodowlach znajduje się w fazie S (tj. fazie syntezy DNA) swojego cyklu komórkowego, w której dostępne są polimerazy DNA pochodzenia komórkowego potrzebne do replikacji wirusa.
Jeśli płodowa lub dorosła surowica bydlęca jest włączona do pożywki hodowlanej komórek używanej do namnażania PPV, należy ją wstępnie przetestować na obecność inhibitorów wirusów. To samo może dotyczyć surowic kilku innych gatunków. Ponieważ na replikację PPV wpływa aktywność mitotyczna, szczególnie ważny jest również wpływ surowicy na komórki. Ponadto hodowle należy wstępnie przetestować pod kątem zanieczyszczenia PPV. Kultury są czasami nieświadomie przygotowywane z zakażonych tkanek świń płodowych i postnatalnych. Co więcej, PPV może zostać przypadkowo wprowadzony do hodowli na kilka sposobów, w tym poprzez użycie zanieczyszczonej trypsyny. Jeśli zanieczyszczenie zostanie wykryte przed zakażeniem wszystkich komórek, wirus można wyeliminować przez wielokrotne hodowle komórek w obecności pożywki zawierającej antysurowicę PPV.
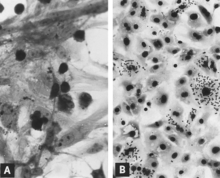
Kilku badaczy wykorzystało mikroskopię IF do śledzenia rozwoju PPV w hodowli komórkowej. Ogólnie kolejność zdarzeń jest następująca. Antygen wirusowy jest wykrywany w cytoplazmie komórek wkrótce po zakażeniu, jeśli inokulum zawiera wysokie miano wirusa i antygenu wirusowego. Większość, jeśli nie całość, tej wczesnej fluorescencji cytoplazmatycznej jest wynikiem fagocytowania antygenu z inokulum. Poprzez kolejne badania taki antygen można wykazać najpierw na zewnętrznej powierzchni błony cytoplazmatycznej, a później w cytoplazmie, często stosunkowo skoncentrowany w miejscu przyjądrowym. Pierwszym jednoznacznym dowodem replikacji wirusa jest pojawienie się powstającego antygenu wirusowego w jądrze (ryc. 2A). Przynajmniej w niektórych zainfekowanych komórkach powstający antygen pojawia się następnie w cytoplazmie w wystarczającej ilości, aby zarówno cytoplazma, jak i jądro były jasno fluorescencyjne. Zakażone komórki powszechnie obserwowane w płucach płodów, które rozwijają wysokie miano przeciwciał przeciwko PPV, prawdopodobnie reprezentują ten etap replikacji (patrz ryc. 8C). Dotknięte komórki następnie zaokrąglają się, stają się piknotyczne i rozpadają się wraz z uwolnieniem wirusa i antygenu wirusowego (ryc. 2B). Inne komórki w hodowli, które nie są na odpowiednim etapie do podtrzymywania replikacji wirusa, nadal fagocytują i gromadzą antygen wirusowy w swojej cytoplazmie (ryc. 2C). Drugą falę replikacji wirusa można wywołać, jeśli komórki te są stymulowane do wejścia w fazę S cyklu komórkowego, na przykład przez dodanie świeżej pożywki hodowlanej.
Hemaglutynacja
erytrocyty człowieka, małpy, świnki morskiej, kota, kurczaka, szczura i myszy . Erytrocyty innych rodzajów zwierząt, które zostały przebadane, są stosunkowo lub całkowicie niewrażliwe lub wyniki są niejednoznaczne. Kilka parametrów testu hemaglutynacji (HA) - takich jak temperatura inkubacji, gatunek użytych erytrocytów, aw przypadku erytrocytów kurzych - skład genetyczny i wiek dawcy - może ilościowo wpływać na wyniki. Test HA jest najczęściej przeprowadzany w temperaturze pokojowej, przy pH zbliżonym do obojętnego i przy użyciu erytrocytów świnki morskiej. Wyższe miana HA odnotowano, gdy rozcieńczalnikiem użytym w teście był raczej bufor weronalny niż sól fizjologiczna buforowana fosforanami. Elucję wirusa (hemaglutynina jest częścią wirionu) można wywołać zawieszając erytrocyty w buforze alkalicznym o pH 9.
Testy zakaźności
Testy zakaźności przeprowadza się w standardowy sposób, z wyjątkiem tego, że ponieważ zmiany cytopatyczne w końcowych rozcieńczeniach są często niejasne, punkty końcowe zakaźności są często określane przez badanie hodowli komórkowych pod kątem inkluzji wewnątrzjądrowych po odpowiednim wybarwieniu lub przez badanie pożywki do hodowli komórkowej pod kątem wirusowej hemaglutyniny. Opisano również procedurę miareczkowania, w której zainfekowane komórki są widoczne za pomocą mikroskopii IF i testu łysinkowego.

Serologiczny
Testy Test HI jest często używany do wykrywania i oznaczania ilościowego przeciwciał humoralnych przeciwko PPV. Czasami przeciwciała można wykryć już po 5 dniach od kontaktu świń z żywym wirusem i mogą one utrzymywać się przez lata. Surowice badane w teście HI są zwykle poddawane wstępnej obróbce przez inaktywację termiczną (56°C, 30 minut) i adsorpcję z erytrocytami (w celu usunięcia naturalnie występujących hemaglutynin) i kaolinem (w celu usunięcia lub redukcji niebędących przeciwciałami inhibitorów HA). Trypsynę stosowano również do usuwania niebędących przeciwciałami inhibitorów HA. Parametry testu HI zostały szczegółowo zbadane.
Test SN jest czasami używany do wykrywania i oznaczania ilościowego przeciwciał humoralnych dla PPV. Neutralizacja zakaźności jest zwykle potwierdzana przez brak lub zmniejszenie wtrąceń wewnątrzjądrowych lub komórek fluorescencyjnych w hodowlach lub wirusowej hemaglutyniny w pożywce hodowlanej. Stwierdzono, że test SN jest bardziej czuły niż test HI. Opisano mikrotechnikę zastosowania testu SN.
Immunodyfuzja , zmodyfikowany test bezpośredniego wiązania dopełniacza i test immunoenzymatyczny również były z powodzeniem stosowane do wykrywania przeciwciał przeciwko PPV.
Ewolucja
Wydaje się, że wirusy te ewoluowały około 120 lat temu, a ich populacja gwałtownie wzrosła w ciągu ostatnich 40–60 lat. Wydaje się, że początkowo ewoluowały u dzików, a następnie rozprzestrzeniły się na świnie domowe. Tempo ewolucji oszacowano na 3,86 x 10-4 – 8,23 x 10-4 podstawień na ośrodek rocznie. Szybkość ta jest podobna do innych wirusów jednoniciowego DNA.
Epidemiologia
Parwowirus świń jest wszechobecny wśród świń na całym świecie. Na głównych obszarach produkcji trzody chlewnej, takich jak środkowo-zachodnie Stany Zjednoczone , infekcja jest enzootyczna w większości stad, z nielicznymi wyjątkami, lochy są odporne. Ponadto duża część loszek jest naturalnie zakażona PPV przed poczęciem, w wyniku czego rozwijają one aktywną odporność, która prawdopodobnie utrzymuje się przez całe życie. Podsumowując, dane seroepidemiologiczne wskazują, że ekspozycja na PPV jest powszechna. Podkreślają również wysokie ryzyko infekcji i chorób rozrodczych wśród loszek, które nie rozwinęły odporności przed poczęciem. Najczęstszymi drogami zakażenia u prosiąt pourodzeniowych i prenatalnych są odpowiednio drogi ustno-nosowe i przezłożyskowe.
Świnie karmiące matki odporne absorbują wysokie miano przeciwciał przeciwko PPV z siary . Te miana zmniejsza się stopniowo wraz z upływem czasu w wyniku rozcieńczania w miarę wzrostu świń, jak również w wyniku degradacji biologicznej. Zwykle osiągają poziom niewykrywalny w ciągu 3–6 miesięcy, jeśli surowice są badane za pomocą testu HI. Czasami przeciwciała nabyte biernie utrzymują się przez dłuższy czas. Ponadto poziomy przeciwciał zbyt niskie do wykrycia za pomocą testu HI można wykryć za pomocą testu SN. Podstawowym znaczeniem biernie nabytych przeciwciał jest to, że zakłócają one rozwój czynnej odporności. Wysoki poziom takiego przeciwciała może zapobiegać infekcji, a niższy poziom może zminimalizować rozprzestrzenianie się wirusa od zakażonych świń. W związku z tym niektóre grupy loszek nie są w pełni podatne na infekcję i rozprzestrzenianie się wirusa dopiero na krótko przed zapłodnieniem lub we wczesnej ciąży.
Zanieczyszczone pomieszczenia są prawdopodobnie głównymi rezerwuarami PPV. Wirus jest termostabilny, odporny na wiele powszechnych środków dezynfekujących i może pozostawać zakaźny przez wiele miesięcy w wydzielinach i wydalinach ostro zakażonych świń. Eksperymentalnie wykazano, że chociaż świnie przenosiły PPV tylko przez około 2 tygodnie po ekspozycji, kojce, w których były początkowo trzymane, pozostawały zakaźne przez co najmniej 4 miesiące. Wszechobecność PPV stwarza również możliwość, że niektóre świnie są trwale zakażone i przynajmniej okresowo rozsiewają wirusa. Jednak nie wykazano wydalania poza okres ostrej infekcji. Sugerowano możliwość występowania immunotolerancyjnych nosicieli PPV w wyniku wczesnego zakażenia macicy. Kiedy loszki zostały zakażone PPV przed 55 dniem ciąży, ich świnie rodziły się zakażone, ale bez przeciwciał. Wirus został wyizolowany z nerek, jąder i płynu nasiennego takich świń zabitych w różnych okresach po urodzeniu do czasu, gdy osiągnęły wiek 8 miesięcy; w którym momencie eksperyment został zakończony. Wyniki innego badania, w którym matki zostały zakażone we wczesnym okresie ciąży, a ich świnie urodziły się zakażone, ale bez przeciwciał, również sugerują nabytą tolerancję immunologiczną. Zgłoszono możliwy przykład zarażonego, wykazującego odporność, aktywnego seksualnie knura.
Knury mogą odgrywać znaczącą rolę w rozpowszechnianiu PPV w krytycznym momencie. Podczas ostrej infekcji wirus jest wydalany różnymi drogami, w tym przez nasienie , i opisano izolację PPV z nasienia naturalnie zakażonych knurów. Nasienie może być zanieczyszczone zewnętrznie, na przykład kałem zawierającym wirusy lub w obrębie męskiego układu rozrodczego. Wirus został wyizolowany z jądra knura 5 dni po wstrzyknięciu go do napletka knura oraz z jąder knurów zabitych 5 i 8 dni po zakażeniu ustno-nosowym (Mengeling, dane niepublikowane 1976). Wirus został również wyizolowany z mosznowych węzłów chłonnych knurów zabitych 5, 8, 15, 21 i 35 dni po ekspozycji ustno-nosowej. Po 8 dniu izolację prowadzono przez wspólną hodowlę fragmentów węzłów chłonnych z komórkami płodowej nerki świni (Mengeling, dane niepublikowane 1976). Niezależnie od ich statusu immunologicznego, knury mogą również działać jako nośnik mechanicznego rozprzestrzeniania PPV wśród podatnych samic.
Patogeneza
Matki są podatne na niepowodzenie rozrodcze wywołane przez PPV, jeśli zostaną zakażone w dowolnym momencie mniej więcej w pierwszej połowie ciąży. Na ten przedział podatności matki wskazują zbiorcze wyniki kilku badań eksperymentalnych, pogłębione badania epidemiologiczne oraz szacunki czasu śmierci płodów zebrane podczas badań epidemiologicznych. Konsekwencjami zakażenia matki w tym okresie jest śmierć zarodka i płodu, po której następuje odpowiednio resorpcja i mumifikacja. Transplacentalny infekcja następuje również po narażeniu matki po połowie ciąży, ale płody zwykle przeżywają bez widocznych skutków klinicznych w macicy. Prawdopodobną przyczyną jest to, że zakażenie przez łożysko często wymaga 10–14 dni lub dłużej, a do 70 dnia ciąży większość płodów jest w stanie rozwinąć ochronną odpowiedź immunologiczną na wirusa. Ogólnie rzecz biorąc, płody eksperymentalnie zakażone przez transmaciczną inokulację wirusem umierały po zakażeniu przed 70 dniem ciąży, ale przeżywały i wytwarzały przeciwciała po zakażeniu w późniejszym okresie ciąży. Opisano również szczep PPV o nieco większej zjadliwości. Typowe konsekwencje infekcji na różnych etapach ciąży podsumowano w Tabela 1 .
Kiedy tylko część miotu jest zakażona przez łożysko, jak to często ma miejsce, jeden lub więcej rodzeństwa z miotu jest często zakażonych przez późniejsze wewnątrzmaciczne rozprzestrzenianie się wirusa. To samo miałoby zastosowanie, gdyby początkowa infekcja pochodziła z zanieczyszczonego nasienia. W rezultacie w tym samym miocie może rozwinąć się dowolna kombinacja lub wszystkie następstwa wskazane w Tabeli 1 . Rozsiewanie wewnątrzmaciczne jest prawdopodobnie mniej powszechne, gdy zakażone są wczesne zarodki, ponieważ są one szybko resorbowane po śmierci, skutecznie usuwając wewnątrzmaciczny rezerwuar wirusa. W takich przypadkach nie ma dowodów na przyczynę mniejszej liczby prosiąt w miocie podczas porodu.
| Przedział ciąży (dni) a | |||
|---|---|---|---|
| Infekcja zapory | Infekcja Conceptus b | Opis Conceptusa | Konsekwencje infekcji |
| ≤56 | 10–30 | Zarodek | Śmierć i resorpcja |
| 30–70 | Płód | Śmierć i mumifikacja | |
| >56 | 70-termin | Płód | Odpowiedź immunologiczna i zwykle przeżycie w macicy |
a Przedziały są przybliżeniami.
b Zakładając infekcje przezłożyskowe 10–14 dni po ekspozycji matki.
Wpływ, jeśli w ogóle, PPV na komórkę jajową przed owulacją jest nieznany. Wirus uporczywie przylega do zewnętrznej powierzchni osłonki przezroczystej zapłodnionego świńskiego jaja i chociaż najwyraźniej nie może przeniknąć przez tę warstwę, spekuluje się, że może stanowić zagrożenie dla zarodka po wykluciu.
Pomimo mocnych poszlak, bezpośrednia przyczynowa rola nasienia skażonego PPV w niepowodzeniu rozrodu nie została jednoznacznie ustalona. Zona pellucida może chronić wczesny zarodek, podczas gdy rozwija się lokalna odporność. I odwrotnie, wirus może powodować zmiany w macicy niezgodne z ciążą. W każdym razie samica zarażona przez nasienie stanowi ognisko infekcji dla innych.
Z możliwym wyjątkiem zmian w macicy, o których mowa w poprzednim akapicie, niepowodzenie rozrodu wywołane przez PPV jest spowodowane bezpośrednim wpływem wirusa na płód. W przypadku braku odpowiedzi immunologicznej wirus intensywnie replikuje się w tych tkankach. Do czasu śmierci zarodka większość jego komórek zawiera duże ilości wewnątrzcytoplazmatycznego antygenu wirusowego, co można wykazać za pomocą mikroskopii IF. Względny brak fluorescencji jądrowej w momencie śmierci, w porównaniu z wcześniejszymi stadiami choroby, wskazuje, że gdy płód jest poważnie dotknięty, aktywność mitotyczna i związane z nią warunki niezbędne do replikacji wirusa są tłumione bardziej niż aktywność fagocytarna.
Śmierć poczęcia jest prawdopodobnie wynikiem zbiorowego uszkodzenia przez wirusa różnych tkanek i narządów, w tym łożyska. Jednak w przypadku braku odpowiedzi immunologicznej zmiany w prawie każdym ważnym narządzie są prawdopodobnie wystarczające, aby ostatecznie spowodować śmierć. Jedną z najbardziej uderzających cech dystrybucji wirusa jest rozległe zaangażowanie śródbłonka. Wydaje się to wykluczać dalszy rozwój sieci naczyniowej zarodka. Przygotowanie do mitozy komórkowej (tj. fazy S) powoduje równoczesną replikację wirusa i śmierć komórki. Uszkodzenie układu krążenia płodu objawia się obrzękiem, krwotokiem i nagromadzeniem dużych ilości surowiczo-krwawego płynu w jamach ciała. Martwica śródbłonka jest widoczna mikroskopowo.
Mechanizm infekcji przezłożyskowej został zbadany przy użyciu mikroskopii IF w celu identyfikacji zakażonych komórek w tkankach matki i płodu w coraz dłuższych odstępach czasu po narażeniu matki na kontakt ustno-nosowy. Badanie tkanek sąsiadujących z połączeniem matczyno-płodowym ujawniło obecność antygenu wirusowego w komórkach śródbłonka i mezenchymalnych kosmówki, z rosnącym zaangażowaniem tych tkanek w coraz późniejszych stadiach ciąży. Antygen wirusowy nigdy nie został jednoznacznie wykryty ani w nabłonku macicy, ani w trofektodermie. W związku z tym nie było dowodów na przeniesienie wirusa z matki na płód poprzez replikację w tych tkankach. Nie można jednak wykluczyć tej trasy, ponieważ przebadano tylko niewielką część całego obszaru kontaktu. Rozważano przeniesienie wirusa w obrębie makrofagów. Niezależnie od drogi, wiremia matki wydaje się prawdopodobnym warunkiem wstępnym zakażenia przezłożyskowego.
Uszkodzenia
U nieciężarnych świń nie odnotowano ani makroskopowych, ani mikroskopowych zmian chorobowych. Można sobie wyobrazić, że nacieki komórkowe opisane później dla płodów mogą być wywołane infekcją w okresie okołoporodowym.
U ciężarnych matek nie zgłaszano zmian makroskopowych; jednakże obserwowano mikroskopijne zmiany w tkankach loszek zabitych po zakażeniu ich płodów przez przezmaciczną inokulację wirusa. Loszki, które były seronegatywne, gdy ich płody zostały zakażone w 70 dniu ciąży, miały ogniskowe nagromadzenie komórek jednojądrzastych przylegających do endometrium iw głębszych warstwach blaszki właściwej, gdy zostały zabite 12 i 21 dni później. Ponadto w mózgu, rdzeniu kręgowym i naczyniówce oka znajdowały się okołonaczyniowe mankiety komórek plazmatycznych i limfocytów. Kiedy płody zostały zakażone wcześniej w ciąży (35, 50 i 60 dni), a ich matki zostały zabite 7 i 11 dni później, zmiany były podobne. Jednak zmiany w macicy były cięższe i obejmowały również rozległe zwężenie naczyń mięśniówki macicy i endometrium komórkami jednojądrzastymi. Jedynie ogniskowe nagromadzenie limfocytów obserwowano w macicy loszek, które były seropozytywne, gdy ich płody były zakażone.
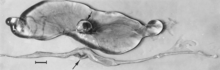
Zmiany makroskopowe zarodków to śmierć, po której następuje resorpcja płynów (ryc. 4), a następnie tkanek miękkich (ryc. 5). Wirus i antygen wirusowy są szeroko rozpowszechnione w tkankach zakażonych zarodków i ich łożysk, i jest prawdopodobne, że mikroskopijne zmiany martwicy i uszkodzenia naczyń, opisane później u płodów, rozwijają się również w zaawansowanych zarodkach.
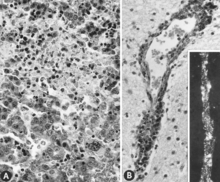
Istnieje wiele zmian makroskopowych u zakażonych płodów, zanim staną się one immunokompetentne (ryc. 6). Obejmują one zmienny stopień zahamowania wzrostu, a czasem wyraźną utratę kondycji, zanim pojawią się inne zewnętrzne zmiany; sporadycznie zwiększone uwypuklenie naczyń krwionośnych na powierzchni płodu z powodu przekrwienia i wycieku krwi do przylegających tkanek; przekrwienie, obrzęk i krwotok z nagromadzeniem płynów surowiczo-krwawych w jamach ciała; krwotoczne przebarwienia stają się stopniowo ciemniejsze po śmierci; i odwodnienie (mumifikacja). Wiele z tych zmian dotyczy również łożyska. Zmiany mikroskopowe składają się głównie z rozległej martwicy komórkowej w wielu różnych tkankach i narządach (ryc. 7A). Opisano również zapalenie i inkluzje wewnątrzjądrowe.

W przeciwieństwie do tego, zmiany makroskopowe nie zostały zgłoszone dla płodów zakażonych po tym, jak stały się immunokompetentne dla PPV. Zmiany mikroskopowe to przede wszystkim przerost śródbłonka i nacieki z komórek jednojądrzastych zgodne z odpowiedzią immunologiczną. W istocie szarej i białej mózgu oraz w oponach mózgowych martwo urodzonych świń zakażonych PPV obserwowano zapalenie opon mózgowo-rdzeniowych charakteryzujące się okołonaczyniowymi mankietami z proliferującymi komórkami przydanowymi, histiocytami i kilkoma komórkami plazmatycznymi. Uważano, że zmiany te są patognomoniczne dla zakażenia PPV. Podobne zmiany obserwowano u żywych płodów zakażonych PPV pobranych w późnym okresie ciąży (ryc. 7B).
Oba ogólne typy zmian mikroskopowych (tj. martwica i naciek komórek jednojądrzastych) mogą rozwinąć się u płodów zakażonych w połowie ciąży, gdy odpowiedź immunologiczna jest niewystarczająca do zapewnienia ochrony.
Diagnoza
PPV należy wziąć pod uwagę w diagnostyce różnicowej niepowodzeń rozrodczych świń, gdy istnieją dowody śmierci zarodka lub płodu lub obu. Opisano patologiczne następstwa infekcji u matki podczas ciąży (patrz część dotycząca objawów klinicznych). Jeśli dotyczy to loszek, ale nie macior, podczas ciąży nie obserwuje się choroby matki, występuje niewiele poronień lub anomalii rozwojowych płodu lub nie ma ich wcale, a inne dowody sugerują chorobę zakaźną, wówczas można postawić wstępną diagnozę niepowodzenia rozrodczego wywołanego przez PPV. Względny brak chorób matek, poronień i wad rozwojowych płodu odróżnia PPV od większości innych zakaźnych przyczyn niepowodzenia reprodukcyjnego. Jednak ostateczna diagnoza wymaga wsparcia laboratoryjnego.
Kilka zmumifikowanych płodów (<16 cm długości) lub płuca z takich płodów, jeśli są wystarczająco rozwinięte, należy przekazać do laboratorium diagnostycznego. Większe zmumifikowane płody (tj. powyżej około 70 dni ciąży), martwo urodzone świnie i nowonarodzone świnie nie są zalecane do składania, chyba że są to jedyne dostępne próbki. W przypadku zakażenia ich tkanki zwykle zawierają przeciwciała, które zakłócają testy laboratoryjne na obecność wirusa lub antygenu wirusowego.

Jeśli samice nie będą rodzić pomimo anestrus i zostaną wysłane do rzeźni, ich macice powinny zostać pobrane i zbadane pod kątem dotkniętych płodów. Czasami pozostają tylko resztki tkanek płodowych, gdy płody umierają na początku środkowej trzeciej części ciąży. Niemniej jednak są to odpowiednie próbki, jeśli są badane pod kątem antygenu wirusowego za pomocą mikroskopii IF. Brak dotkniętych chorobą płodów lub resztek płodowych nie wyklucza niepowodzenia rozrodczego wywołanego przez PPV. Kiedy wszystkie zarodki z miotu umrą i zostaną całkowicie zresorbowane po pierwszych kilku tygodniach ciąży, matka może pozostać w ciąży endokrynologicznej i powrócić do rui dopiero po przewidywanym czasie porodu.
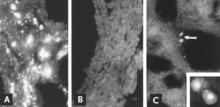
Identyfikacja antygenu wirusowego za pomocą mikroskopii IF jest wiarygodną i czułą procedurą diagnostyczną. Skrawki tkanek płodu są przygotowywane za pomocą mikrotomu kriostatycznego, a następnie poddawane reakcji z wystandaryzowanymi odczynnikami. Test można wykonać w ciągu kilku godzin. W przypadku braku odpowiedzi przeciwciał płodu, antygen jest widoczny w tkankach płodu (ryc. 8A, B); nawet jeśli obecne jest przeciwciało, zainfekowane komórki można zwykle wykryć w płucach płodu (ryc. 8C).
Jako technikę diagnostyczną zaleca się również wykrywanie hemaglutyniny wirusowej. Tkanki rozciera się w rozcieńczalniku, a następnie sedymentuje przez wirowanie. Płyn znad osadu bada się pod kątem aktywności aglutynacji erytrocytów świnki morskiej. Ten test wymaga minimum sprzętu laboratoryjnego i jest skuteczny przy braku przeciwciał.
Izolacja wirusa jest mniej odpowiednia jako rutynowa procedura diagnostyczna niż którykolwiek z wyżej wymienionych testów. Zakaźność jest powoli, ale stopniowo tracona po śmierci płodu; w rezultacie izolacja wirusa ze zmumifikowanych płodów, które zmarły w wyniku infekcji, czasami kończy się niepowodzeniem. Ponadto procedura jest czasochłonna, a zanieczyszczenie stanowi stałe zagrożenie ze względu na stabilność PPV w laboratorium oraz fakt, że hodowle komórkowe są czasami nieświadomie przygotowywane z zakażonych tkanek. Mikroskopia IF jest często używana do określenia, czy PPV został wyizolowany w hodowli komórkowej.
Ogólnie rzecz biorąc, procedury serologiczne są zalecane do diagnozy tylko wtedy, gdy tkanki ze zmumifikowanych płodów nie są dostępne do badań, jak opisano wcześniej. Wyniki z matczynymi surowicami są cenne, jeśli nie wykryto przeciwciał, wykluczając w ten sposób PPV jako przyczynę, i jeśli próbki pobierane w odstępach czasowych wykazują serokonwersję dla PPV zbieżną z niepowodzeniem rozrodu. Ponieważ PPV jest wszechobecne, obecność przeciwciała w pojedynczej próbce jest poza tym bez znaczenia. Jednak określenie względnych ilości przeciwciał obecnych jako immunoglobuliny M i G może wskazywać na świeżość zakażenia. Wykrywanie przeciwciał w surowicach płodów i martwo urodzonych świń oraz w surowicach pobranych od nowo narodzonych prosiąt przed karmieniem świadczy o zakażeniu in utero, ponieważ przeciwciała matczyne nie przenikają przez połączenie matczyno-płodowe. Gdy surowica nie jest dostępna, płyny ustrojowe pobrane od płodów lub ich wnętrzności, które były trzymane w plastikowej torbie przez noc w temperaturze 4°C, zostały z powodzeniem użyte do wykazania przeciwciał.
Leczenie i profilaktyka
Nie ma leczenia zaburzeń rozrodczych wywołanych przez PPV.
Loszki powinny być albo naturalnie zakażone PPV, albo zaszczepione przeciwko PPV przed rozmnażaniem. Aby promować naturalną infekcję, powszechną praktyką jest organizowanie kontaktu między seronegatywnymi loszkami a seropozytywnymi lochami, z oczekiwaniem, że jedna lub więcej loch będzie wydalała wirusa. Można również zalecić przeniesienie loszek na potencjalnie zakażony obszar, obecnie lub niedawno zamieszkany przez seropozytywne świnie. Po rozpoczęciu infekcji wirus szybko rozprzestrzenia się wśród w pełni podatnych świń. Nie wiadomo, jak skuteczne są te procedury w zwiększaniu częstości występowania naturalnych infekcji. Z różnych powodów infekcja jest powszechna i prawdopodobnie ponad połowa wszystkich loszek na obszarach, gdzie PPV jest enzootyczna, jest zarażona, zanim zostaną wyhodowane po raz pierwszy.
Stosowanie szczepionki jest jedynym sposobem zapewnienia, że loszki rozwiną czynną odporność przed poczęciem. Opracowano zarówno inaktywowane, jak i zmodyfikowane szczepionki zawierające żywe wirusy (MLV). Szczepionka inaktywowana została przetestowana w warunkach polowych i oba rodzaje szczepionek okazały się skuteczne w kontrolowanych warunkach laboratoryjnych.
Szczepionki należy podawać kilka tygodni przed zapłodnieniem, aby zapewnić odporność przez cały podatny na zakażenie okres ciąży, ale po zaniku biernie nabytych przeciwciał siarowych, które mogłyby zakłócać rozwój czynnej odporności. Limity te mogą określać bardzo krótki odstęp czasu dla skutecznego szczepienia loszek, które zostały wyhodowane przed ukończeniem 7 miesiąca życia. Chociaż inaktywowana szczepionka zapewnia maksymalne bezpieczeństwo, istnieją dowody eksperymentalne, że PPV może być wystarczająco atenuowany, tak że jest mało prawdopodobne, aby spowodował niepowodzenie rozrodu, nawet jeśli zostanie nieumyślnie podany podczas ciąży. Pozorne bezpieczeństwo szczepionki MLV może wynikać z jej zmniejszonej zdolności do replikacji w tkankach nienaruszonego żywiciela i powodowania poziomu wiremii potrzebnego do zakażenia przez łożysko. Co więcej, wykazano przez transmaciczną inokulację zarówno zjadliwego, jak i atenuowanego wirusa, że do ustalenia zakażenia płodu wymagana jest znacznie większa dawka atenuowanego wirusa. Czas trwania odporności po szczepieniu jest nieznany; jednakże w jednym badaniu miana przeciwciał utrzymywały się przez co najmniej 4 miesiące po podaniu inaktywowanej szczepionki. Niskie poziomy przeciwciał, które okazały się ochronne, pozwalają spekulować, że po pobudzeniu układu odpornościowego PPV, późniejsza ekspozycja na zjadliwego wirusa podczas ciąży raczej nie spowoduje zakażenia przez łożysko, nawet jeśli przeciwciała ze szczepionki nie są już wykrywane.
Szczepienie jest również zalecane dla seronegatywnych loch i knurów. Lochy seronegatywne występują zwykle tylko w stadach wolnych od PPV; w takich przypadkach wskazana jest szczepionka inaktywowana. Doświadczenie pokazuje, że można oczekiwać, że niewiele stad pozostanie wolnych od PPV, nawet jeśli dostęp jest dokładnie kontrolowany. Wprowadzenie PPV do całkowicie podatnego stada może być katastrofalne w skutkach. Szczepienie knurów powinno ograniczyć ich udział w rozprzestrzenianiu się wirusa.
Szczepionki są szeroko stosowane w Stanach Zjednoczonych i kilku innych krajach, w których PPV uznano za ważną ekonomicznie przyczynę niepowodzenia reprodukcyjnego. Wszystkie federalnie licencjonowane szczepionki sprzedawane w Stanach Zjednoczonych są inaktywowane.
Zobacz też
Ten artykuł zawiera tekst z „Choroby świń (8. wydanie)”. Zgodnie z oświadczeniem o prawach autorskich: „Prawa autorskie nie są zgłaszane do rozdziałów 17, 23, 25, 31 i 64, które są własnością publiczną ”.
