Syntaza 1-aminocyklopropano-1-karboksylanu
| Syntaza 1-aminocyklopropano-1-karboksylanu Struktura | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identyfikatorów | |||||||||
 syntazy ACC
| |||||||||
| nr WE | 4.4.1.14 | ||||||||
| nr CAS | 72506-68-4 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Enzym syntaza kwasu aminocyklopropano-1-karboksylowego (syntaza ACC, ACS) (EC 4.4.1.14) katalizuje syntezę kwasu 1-aminocyklopropano-1-karboksylowego (ACC), prekursora etylenu , z S-adenozylometioniny (AdoMet, SAM), półprodukt w cyklu Yang i aktywowanym cyklu metylowym oraz użyteczna cząsteczka do przenoszenia metylu:
- S -adenozylo- L -metionina = 1-aminocyklopropano-1-karboksylan + S -metylo-5′-tioadenozyna
Podobnie jak inne enzymy zależne od PLP, katalizuje reakcję poprzez związek pośredni chinonoidowego jonu obojnaczego i wykorzystuje kofaktor fosforan pirydoksalu (PLP, aktywna postać witaminy B6) do stabilizacji.
Enzym ten należy do rodziny liaz , w szczególności liaz węglowo-siarkowych. Systematyczna nazwa tej klasy enzymów to S -adenozylo- L -metionino- S -metylo-5'-tioadenozyno-liaza (tworząca 1-aminocyklopropano-1-karboksylan) . Inne powszechnie używane nazwy to syntaza 1-aminocyklopropanokarboksylanu , syntaza kwasu 1-aminocyklopropano-1-karboksylowego , syntetaza 1-aminocyklopropano-1-karboksylanu , syntaza kwasu aminocyklopropanokarboksylowego , syntaza aminocyklopropanokarboksylanu , syntaza ACC i metylotioada S -adenozylo - L -metioniny nosin- liaza . Enzym ten bierze udział w metabolizmie propanianu . Wykorzystuje jeden kofaktor , fosforan pirydoksalu .
Mechanizm enzymatyczny
Reakcja katalizowana przez syntazę kwasu 1-aminocyklopropano-1-karboksylowego (ACS) jest zaangażowanym i ograniczającym szybkość etapem biosyntezy etylenu [20] , gazowego hormonu roślinnego odpowiedzialnego za inicjację dojrzewania owoców, pędów i korzeni. wzrost i różnicowanie, opadanie liści i owoców , otwieranie się kwiatów oraz starzenie się kwiatów i liści . (źródło) Jest to eliminacja gamma zależna od fosforanu pirydoksalu (PLP) (?). W eliminacji gamma PLP działa dwukrotnie jako pochłaniacz (pochłaniając elektrony z dwóch deprotonacji).
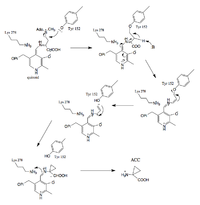
Proponowane etapy mechanizmu reakcji:
- Utworzenie bazy ACS-PLP Schiff
- Wymiana Iminy
- Tworzenie półproduktu chinonoidowego
- Tworzenie pierścienia 3C stabilizowane tyrozyną i PLP
- Utworzenie bazy ACS-PLP Schiff
Aldehyd koenzymu PLP reaguje tworząc wiązanie iminowe ( zasada Schiffa ) z resztą domeny katalitycznej lizyny (278) ACS.
- Wymiana iminy
Następuje wymiana iminy, a azot aminowy substratu, S-adenozylometionina, zastępuje Lys (278) w wiązaniu iminowym. (Stabilizowany przez wiązanie H).
- Tworzenie półproduktu chinonoidowego
PLP działa jak „zlew elektronów”, pochłaniając zdelokalizowaną gęstość elektronów podczas reakcji pośrednich (przeciwdziałając nadmiernej gęstości elektronów na zdeprotonowanym węglu α). PLP ułatwia aktywność enzymu, zwiększając kwasowość węgla alfa poprzez stabilizację sprzężonej zasady. karboanion stabilizowany PLP jest półproduktem chinonoidowym.
- Tworzenie pierścienia 3C stabilizowane tyrozyną i PLP
PLP i tyrozyna stabilizują ładunki ujemne podczas deprotonowania. Tyrozyna atakuje węgiel związany z siarką, pozwalając na odejście S(CH3)(Ado), a podczas tworzenia pierścienia tyrozyna odchodzi .
- Uwaga: inhibitory AVG i AMA wiążą PLP, tworząc odpowiednio ketiminę i oksym (których reakcje odwrotne są znacznie mniej korzystne) i zapobiegają katalizowanej przez syntazę ACC reakcji z SAM.
Rozporządzenie
Syntaza ACC osiąga optymalną aktywność w warunkach pH 8,5 i przy Km = 20 um względem swojego substratu SAM.
Syntaza ACC i biosynteza etylenu są regulowane przez cały szereg bodźców. Stresy, takie jak zranienie, szkodliwe chemikalia, auksyna, zalanie i kwas indolo-3-octowy (IAA) sprzyjają syntezie etylenu, tworząc cykl pozytywnego sprzężenia zwrotnego z syntazą ACC, zwiększając jej aktywność.
Jednak jest również hamowany przez wiele związków. S-Adenozylotionina może wiązać się jako substrat dla syntazy ACC (z wyższym powinowactwem niż SAM), a zatem hamować jakąkolwiek reakcję z SAM. Syntaza ACC jest również kompetycyjnie hamowana przez aminoetoksywinyloglicynę (AVG) i kwas aminooksyoctowy (AOA), inhibitory wielu reakcji enzymatycznych, w których pośredniczy fosforan pirydoksalu. Są to naturalne toksyny, które powodują powolne hamowanie wiązania poprzez zakłócanie koenzymu fosforanu pirydoksalu. Aktywność syntazy ACC jest również hamowana przez produkty pośrednie aktywowanego cyklu metylowego i szlaku recyklingu metioniny: 5′- metylotioadenozyna , kwas α-keto-γ-metylotiomasłowy i S-adenozylohomocysteina.
Struktura
Syntaza ACC ma długość sekwencji 450-516 aminokwasów w zależności od gatunku rośliny, z której jest pozyskiwana. Chociaż jest porównywalny w gatunkach, w których występuje, jego domena końcowa COOH jest bardziej zmienna, co prowadzi do różnic, takich jak oligomeryzacja . Domena końcowa COOH jest odpowiedzialna za oligomeryzację. W większości komórek wytwarzających syntazę ACC, syntaza ACC występuje jako dimer. Jednak w niektórych znajdujemy monomer („który jest bardziej aktywny i wydajny [niż jego dimerowy odpowiednik”).
Struktura ACS została w dużej mierze określona za pomocą krystalografii rentgenowskiej. Konserwacja reszt w domenie katalitycznej ACS i homologia sekwencji sugerują, że ACS katalizuje syntezę ACC w podobny sposób jak inne enzymy, które wymagają PLP jako kofaktora. Jednak w przeciwieństwie do wielu innych enzymów zależnych od PLP, Lys (278) nie jest jedyną resztą, która oddziałuje z substratem. Bliskość elektroujemnego tlenu z Tyr (152) do wiązania C-γ-S sugeruje kluczową rolę w tworzeniu ACC. Krystalografia rentgenowska z aminoetoksywinyloglicyną (AVG), kompetycyjnym inhibitorem, potwierdziła rolę tyrozyny w eliminacji γ.
Pod koniec 2007 roku rozwiązano 6 struktur dla tej klasy enzymów o kodach dostępu PDB 1B8G , 1IAX , 1IAY , 1M4N , 1M7Y i 1YNU .
Domena katalityczna
Głównymi grupami funkcyjnymi w domenach katalitycznych są azot z reszty Lys 278 i tlen z reszty tyrozyny 152.
Funkcja biologiczna i zastosowania
Syntaza ACC jest kluczowym, ograniczającym szybkość etapem syntezy etylenu. Ponieważ regulacja w górę ACC-Synthase jest tym, co indukuje dojrzewanie owoców i często psucie się, przeprowadza się więcej badań nad mechanizmami regulacyjnymi i szlakami biosyntezy etylenu, aby uniknąć psucia się.
Notatki
- Lin, ECC; Kistler, WS; Zwaig, N. (czerwiec 1970). „Kinaza glicerolowa, stymulator dysymilacji glicerolu w Escherichia coli” . Journal of Bacteriology . 102 (3): 753–759. doi : 10.1128/JB.102.3.753-759.1970 . PMC 247623 . PMID 4914079 .
- Nakatsuka, Akira; Murachi, Shiho; Okunishi, Hironori; Shiomi, Shinjiro; Nakano, Ryohei; Kubo, Yasutaka; Inaba, Akitsugu (1998). „Ekspresja różnicowa i regulacja wewnętrznego sprzężenia zwrotnego syntazy 1-aminocyklopropano-1-karboksylanowej, oksydazy 1-aminocyklopropano-1-karboksylanowej i genów receptora etylenowego w owocach pomidora podczas rozwoju i dojrzewania” . Fizjologia roślin . 118 (4): 1295–1305. doi : 10.1104/pp.118.4.1295 . PMC34745 . _ PMID 9847103 .
- Wang, H.; Mei, W.; Qin, Y.; Zhu, Y. (2011). „Syntaza kwasu 1-aminocyklopropano-1-karboksylowego 2 jest fosforylowana przez zależną od wapnia kinazę białkową 1 podczas wydłużania włókien bawełny” . Acta Biochimica et Biophysica Sinica . 43 (8): 654–661. doi : 10.1093/abbs/gmr056 . PMID 21742672 .
- Wang, Long-Chi; Hsu, Jen-Hung; Lin, Lee-Chung (22.10.2010). „Identyfikacja nowych inhibitorów syntazy kwasu 1-aminocyklopropano-1-karboksylowego za pomocą badań chemicznych u Arabidopsis thaliana” . Dziennik Chemii Biologicznej . 285 (43): 33445–33456. doi : 10.1074/jbc.M110.132498 . PMC 2963424 . PMID 20682786 .
- „Biosynteza etylenu i sieci sygnalizacyjne” . Zarchiwizowane od oryginału w dniu 2012-03-07.
- Guido Capitani; Markus Tschopp; Andrew C. Eliota; Jacka F. Kirscha; Markusa G. Grüttera. „Struktura syntazy ACC inaktywowanej przez mechanizm oparty na inhibitorze L-winyloglicynie” (PDF) . www.bioc.uzh.ch . Źródło 2012-03-15 .
- „jxb.oxfordjournals.org” (PDF) . Zarchiwizowane od oryginału (PDF) w dniu 2018-10-30.
- Li, Jian-Feng; Qu, Liang-Hu; Li, Ning (2005). „jxb.oxfordjournals.org” . Dziennik botaniki eksperymentalnej . 56 (418): 2203–2210. doi : 10.1093/jxb/eri220 . PMID 15983009 .
- Koga Y, Katsumi R, You DJ, Matsumura H, Takano K, Kanaya S (maj 2008). „Struktura krystaliczna wysoce termostabilnej kinazy glicerolu z hipertermofilnego archeonu w formie dimerycznej” . FEBS J. 275 (10): 2632–43. doi : 10.1111/j.1742-4658.2008.06410.x . PMID 18422647 . S2CID 205878773 .
- Nakatsuka A, Murachi S, Okunishi H i in. (grudzień 1998). „Różnicowa ekspresja i regulacja wewnętrznego sprzężenia zwrotnego syntazy 1-aminocyklopropano-1-karboksylanu, oksydazy 1-aminocyklopropano-1-karboksylanu i genów receptora etylenu w owocach pomidora podczas rozwoju i dojrzewania” . Fizjol roślinny . 118 (4): 1295–305. doi : 10.1104/pp.118.4.1295 . PMC34745 . _ PMID 9847103 .
- Wang H, Mei W, Qin Y, Zhu Y (sierpień 2011). „Syntaza kwasu 1-aminocyklopropano-1-karboksylowego 2 jest fosforylowana przez zależną od wapnia kinazę białkową 1 podczas wydłużania włókien bawełny” . Acta Biochim. Biofiza. Grzech. (Szanghaj) . 43 (8): 654–61. doi : 10.1093/abbs/gmr056 . PMID 21742672 .
- Capitani G, Tschopp M, Eliot AC, Kirsch JF, Grütter MG (kwiecień 2005). „Struktura syntazy ACC inaktywowanej przez mechanizm oparty na inhibitorze L-winyloglicynie” . FEBS Lett . 579 (11): 2458–62. doi : 10.1016/j.febslet.2005.03.048 . PMID 15848188 . S2CID 24574380 .
- Li JF, Qu LH, Li N (sierpień 2005). „Tyr152 odgrywa kluczową rolę w katalizie syntazy 1-aminocyklopropano-1-karboksylanu” . J. Exp. Bot . 56 (418): 2203–10. doi : 10.1093/jxb/eri220 . PMID 15983009 .
- Capitani G, McCarthy DL, Gut H, Grütter MG, Kirsch JF (grudzień 2002). „Syntaza jabłkowa 1-aminocyklopropano-1-karboksylanu w kompleksie z inhibitorem L-aminoetoksywinyloglicyną. Dowody na związek pośredni ketyminy” . J. Biol. chemia . 277 (51): 49735–42. doi : 10.1074/jbc.M208427200 . PMID 12228256 . S2CID 1019316 .
- Huai Q, Xia Y, Chen Y, Callahan B, Li N, Ke H (październik 2001). „Struktury krystaliczne syntazy 1-aminocyklopropano-1-karboksylanu (ACC) w kompleksie z aminoetoksywinyloglicyną i pirydoksalo-5'-fosforanem zapewniają nowy wgląd w mechanizmy katalityczne” . J. Biol. chemia . 276 (41): 38210–6. doi : 10.1074/jbc.M103840200 . PMID 11431475 .
- Barry CS, Llop-Tous MI, Grierson D (lipiec 2000). „Regulacja ekspresji genu syntazy kwasu 1-aminocyklopropano-1-karboksylowego podczas przejścia z syntezy etylenu w systemie 1 do systemu 2 w pomidorach” . Fizjol roślinny . 123 (3): 979–86. doi : 10.1104/pp.123.3.979 . PMC59060 . _ PMID 10889246 .
- Zhang Z, Ren JS, Clifton IJ, Schofield CJ (październik 2004). „Struktura krystaliczna i implikacje mechanistyczne oksydazy kwasu 1-aminocyklopropano-1-karboksylowego - enzymu tworzącego etylen” . chemia Biol . 11 (10): 1383–94. doi : 10.1016/j.chembiol.2004.08.012 . PMID 15489165 .
- Capitani G, Hohenester E, Feng L, Storici P, Kirsch JF, Jansonius JN (grudzień 1999). „Struktura syntazy 1-aminocyklopropano-1-karboksylanu, kluczowego enzymu w biosyntezie hormonu roślinnego etylenu”. J. Mol. Biol . 294 (3): 745–56. doi : 10.1006/jmbi.1999.3255 . PMID 10610793 .
- Holandia RR (sierpień 1975). „Tabele decyzyjne. Ich wykorzystanie do prezentacji algorytmów klinicznych”. JAMA . 233 (5): 455–7. doi : 10.1001/jama.1975.03260050061028 . PMID 1080212 .
- Kathiresan A, Nagarathna KC, Moloney MM, Reid DM, Chinnappa CC (styczeń 1998). „Różnicowa regulacja rodziny genów syntazy 1-aminocyklopropano-1-karboksylanu i jej rola w plastyczności fenotypowej u stellaria longipes”. Mol roślinny. Biol . 36 (2): 265–74. doi : 10.1023/A:1005994118535 . PMID 9484438 . S2CID 9161137 .
- Yip WK, Moore T, Yang SF (marzec 1992). „Różnicowa akumulacja transkryptów dla czterech homologów syntazy 1-aminocyklopropano-1-karboksylanu pomidora w różnych warunkach” . proc. Natl. Acad. nauka USA . 89 (6): 2475–9. Bibcode : 1992PNAS...89.2475Y . doi : 10.1073/pnas.89.6.2475 . PMC48681 . _ PMID 1549612 .
- Acaster MA, Kende H (maj 1983). „Właściwości i częściowe oczyszczanie syntazy 1-aminocyklopropano-1-karboksylanu” . Fizjol roślinny . 72 (1): 139–45. doi : 10.1104/pp.72.1.139 . PMC 1066183 . PMID 16662947 .
- Lewis DR, Negi S, Sukumar P, Muday GK (sierpień 2011). „Etylen hamuje rozwój korzeni bocznych, zwiększa transport IAA i ekspresję nośników wypływu auksyny PIN3 i PIN7” . Rozwój . 138 (16): 3485–95. doi : 10.1242/dev.065102 . PMID 21771812 . S2CID 7211767 .
- Clausen T, Huber R, Messerschmidt A, Pohlenz HD, Laber B (październik 1997). „Powolne wiązanie hamowanie beta-liazy cystationiny Escherichia coli przez L-aminoetoksywinyloglicynę: badanie kinetyczne i rentgenowskie”. Biochemia . 36 (41): 12633–43. doi : 10.1021/bi970630m . PMID 9376370 .
- Wang KL, Li H, Ecker JR (2002). „Biosynteza etylenu i sieci sygnalizacyjne” . Komórka Roślinna . 14 Dodatek: S131–51. doi : 10.1105/tpc.001768 . PMC 151252 . PMID 12045274 .
- Boller T, Herner RC, Kende H (1979). „Oznaczenie i tworzenie enzymatyczne prekursora etylenu, kwasu 1-aminocyklopropano-1-karboksylowego”. Planta . 145 (3): 293–303. doi : 10.1007/BF00454455 . PMID 24317737 . S2CID 27464828 .
- Yu YB, Adams DO, Yang SF (1979). „Syntaza 1-aminocyklopropanokarboksylanu, kluczowy enzym w biosyntezie etylenu”. Łuk. Biochem. Biofiza . 198 (1): 280-6. doi : 10.1016/0003-9861(79)90420-X . PMID 507845 .