Beta-liaza cystationinowa
| beta-liaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
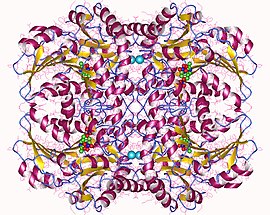 cystationiny tetramer beta-liazy cystationiny,
| |||||||||
| identyfikatory E.Coli | |||||||||
| nr WE | 4.4.1.8 | ||||||||
| nr CAS | 9055-05-4 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Beta-liaza cystationinowa ( EC 4.4.1.8 ), zwana również powszechnie CBL lub β-cystationazą , jest enzymem , który przede wszystkim katalizuje następującą po niej reakcję eliminacji α, β
Zatem substratem tego enzymu jest L-cystationina , podczas gdy jej 3 produktami są homocysteina , pirogronian i amoniak .
Znaleziona w roślinach , bakteriach i drożdżach , beta-liaza cystationiny jest istotną częścią szlaku biosyntezy metioniny , ponieważ homocysteina może być bezpośrednio przekształcana w metioninę przez syntazę metioniny . Enzym należy do rodziny γ enzymów zależnych od PLP ze względu na zastosowanie kofaktora pirydoksalo-5'-fosforanu (PLP) do rozszczepiania cystationiny. Enzym należy również do rodziny liaz , w szczególności do klasy liaz węglowo-siarkowych. Systematyczna nazwa tej klasy enzymów to L-cystationino-L-homocysteino-liaza (deaminująca; tworząca pirogronian) . Enzym ten bierze udział w 5 szlakach metabolicznych : metabolizm metioniny , metabolizm cysteiny , metabolizm selenoaminokwasów, metabolizm azotu i metabolizm siarki .
Struktura
Beta-liaza cystationinowa jest tetramerem złożonym z identycznych podjednostek i jest zbudowana jako dimer dimerów, z których każdy jest związany z jedną cząsteczką PLP związaną z miejscem katalitycznym przez resztę lizyny . Dimer jest tworzony przez dwa monomery połączone przez kilka oddziaływań elektrostatycznych , wiązań wodorowych i hydrofobowych , podczas gdy tetramer jest stabilizowany przez interakcje między domenami N-końcowymi i kluczowymi α-helisami.
Większość reszt miejsc katalitycznych enzymu jest konserwowana wśród enzymów biorących udział w szlaku transsulfuracji . Inni członkowie obejmują gamma-syntazę cystationiny , gamma-liazę cystationiny i gamma-liazę metioniny . Dodatkowo struktury te wykazują fałdowanie typu I i należą do rodziny aminotransferazy asparaginianowej (AAT), charakteryzującej się homodimerami o symetrii dwuściennej i miejscami aktywnymi złożonymi z reszt należących do sąsiednich podjednostek.
Monomer
Monomer beta-liazy cystationiny składa się z trzech funkcjonalnie i strukturalnie odrębnych domen:
Domena N-końcowa
Składa się z trzech α-helis i jednej nici beta , które przyczyniają się do tworzenia struktury czwartorzędowej . Ta domena zawiera reszty, które oddziałują z miejscem aktywnym sąsiedniej podjednostki, ułatwiając wiązanie substratu i kofaktora.
Domena wiążąca PLP
Zawiera większość istotnych katalitycznie reszt enzymu. Składa się z α-helis i β-kartek z wyraźną równoległą siedmioniciową β-kartką. Arkusze te tworzą zakrzywioną strukturę wokół helisy wiążącej PLP. PLP jest kowalencyjnie przyłączony do reszty lizyny na C-końcu arkusza.
Domena C-końcowa
Najmniejsza domena enzymu, która jest połączona z domeną wiążącą PLP długą, załamaną α-helisą. Domena ma strukturę czteroniciowego antyrównoległego arkusza β z sąsiednimi helisami.
Miejsce katalityczne
Oprócz wiązania z resztą lizyny, PLP jest utrwalany w miejscu wiązania substratu enzymu poprzez różne interakcje z resztami katalitycznymi. Reszty zawierające aminy i grupy hydroksylowe znajdują się w odległości wiązań wodorowych od czterech atomów tlenu fosforanowych . Uważa się, że ta grupa fosforanowa jest głównym czynnikiem zabezpieczającym PLP w miejscu aktywnym. Dodatkowo reszty sąsiadujące z azotem pirydyny w PLP pomagają stabilizować jego ładunek dodatni , zwiększając w ten sposób jego charakter elektrofilowy .
Pierścień aromatyczny w PLP jest unieruchomiony przez prawie współpłaszczyznową resztę tyrozyny . Uważa się, że taka konfiguracja zwiększa elektronów przez kofaktor. Te interakcje układania w stosy między PLP a aromatycznymi łańcuchami bocznymi można znaleźć w większości enzymów zależnych od PLP, ponieważ odgrywają one ważną rolę w katalizowaniu reakcji poprzez ułatwianie transaldiminacji.
Mechanizm
Jak pokazano na poniższym mechanizmie , beta-liaza cystationinowa ułatwia rozszczepianie wiązania SC w cystationinie za pomocą kofaktora PLP związanego z katalityczną resztą lizyny. Początkowo do przeprowadzenia reakcji transaldiminacji potrzebna jest deprotonowana grupa aminowa. Biorąc pod uwagę, że optymalne pH dla enzymu wynosi od 8,0 do 9,0, reszta tyrozyny w kieszeni katalitycznej występuje jako fenolan , który odrywa proton od grupy α-aminowej substratu. W następnym etapie zdeprotonowana amina przechodzi nukleofilowy i wypiera lizynę, tworząc zasadę Schiffa , tworząc wewnętrzną aldiminę .
Uwolniona lizyna może teraz oddzielić proton od Cα i utworzyć chinoidalny związek pośredni , co jest ułatwione przez delokalizację ładunku ujemnego nad sprzężonym układem p PLP . Następnie protonowanie S γ indukuje rozszczepienie wiązania C β - S γ , uwalniając w ten sposób homocysteinę
Zewnętrzna aldimina jest wypierana przez nukleofilowy atak lizyny, regenerując aktywną katalitycznie aldiminę wewnętrzną i uwalniając dehydroalaninę . Wreszcie enamina tautomeryzuje do iminy , która ulega hydrolitycznej deaminacji , tworząc pirogronian i amoniak.
Zahamowanie
Roślinne i bakteryjne beta-liazy cystationinowe są hamowane przez przeciwdrobnoustrojowy aminokwas L-aminoetoksybinyloglicynę (AVG) i przeciwbakteryjny aminokwas ryzobitoksyna.
Rośliny
Beta-liaza cystationinowa w roślinach wykazuje dwuetapowy mechanizm inaktywacji z AVG, w którym tworzy się odwracalny kompleks enzym-inhibitor przed nieodwracalną inaktywacją enzymu:
Nadmiar dodatku cystationiny zapobiegał inaktywacji enzymu, co sugeruje, że AVG działa jako konkurencyjny inhibitor w stosunku do cystationiny. Ponadto wykazano, że enzym jest wrażliwy na grupę tiolową , takie jak N-etylomaleimid i idoacetamid .
Bakteria
W przeciwieństwie do roślin, beta-liaza cystationiny u bakterii wykazuje jednoetapowy mechanizm hamowania:
Za pomocą metod kinetycznych i krystalografii rentgenowskiej zaobserwowano zależne od czasu, powolne hamowanie wiązania. Uważa się, że inhibitor wiąże się z enzymem w podobny sposób jak substrat; jednakże po oderwaniu protonu α reakcja przebiega w celu utworzenia nieaktywnej pochodnej PLP ketiminy.
Ewolucja
Beta-liaza cystationinowa Arabidopsis wykazuje 22% homologię ze swoim odpowiednikiem Escherichia coli i nawet wyższą homologię (od 28% do 36%) z γ-syntazą cystationinową ze źródeł roślinnych i bakteryjnych oraz γ-liazą cystationinową z Saccharomyces cerevisiae . Wszystkie te enzymy biorą udział w szlaku biosyntezy Cys/Met i należą do tej samej klasy enzymów zależnych od PLP, co sugeruje, że enzymy te pochodzą od wspólnego przodka.
Znaczenie przemysłowe
Beta-liaza cystationinowa katalizuje produkcję homocysteiny, bezpośredniego prekursora metioniny. Metionina jest niezbędnym aminokwasem dla bakterii, który jest niezbędny do syntezy białek i syntezy S-adenozylometioniny ; w ten sposób aminokwas jest bezpośrednio związany z replikacją DNA . Ze względu na swoją konieczność w replikacji DNA, hamowanie beta-liazy cystationiny jest atrakcyjnym celem dla antybiotyków. Ponadto enzym ten jest nieobecny u ludzi, co zmniejsza ryzyko wystąpienia szkodliwych i niepożądanych skutków ubocznych .
Badania powiązały działanie przeciwgrzybicze kilku środków przeciwgrzybiczych z hamowaniem beta-liazy cystationiny; jednak w innych badaniach nie zaobserwowano hamowania przez nie enzymów. Potrzebne są dalsze badania, aby scharakteryzować pełny zakres hamowania beta-liazy cystationiny na wzrost drobnoustrojów i grzybów.





