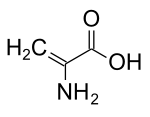
Dehydroalanina
|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Kwas 2-aminoprop-2-enowy |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEBI | |
| ChemSpider | |
| Bank Leków | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 3 H 5 NIE 2 | |
| Masa cząsteczkowa | 87,08 g/mol |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Dehydroalanina ( Cα,β-didehydroalanina , α,β-di-dehydroalanina , 2-aminoakrylan lub 2,3-didehydroalanina ) jest dehydroaminokwasem . Nie występuje w postaci wolnej, ale występuje naturalnie jako pozostałość znajdująca się w peptydach pochodzenia mikrobiologicznego . Jako reszta aminokwasowa jest niezwykła, ponieważ ma nienasycony szkielet.
Struktura i reaktywność
Podobnie jak większość pierwszorzędowych enamin , dehydroalanina jest niestabilna. Dehydroalanina hydrolizuje do pirogronianu .
N -acylowane pochodne dehydroalaniny, takie jak peptydy i związki pokrewne, są trwałe. Na przykład 2-acetamidoakrylan metylu jest N-acetylowaną pochodną estru. Jako reszta w peptydzie jest generowana przez modyfikację potranslacyjną . Wymaganymi prekursorami są seryny lub cysteiny , które ulegają odpowiednio utracie wody i siarkowodoru za pośrednictwem enzymów .
Większość reszt aminokwasowych nie reaguje z nukleofilami , ale wyjątkami są te zawierające dehydroalaninę lub inne dehydroaminokwasy. Są one elektrofilowe z powodu α,β-nienasyconego karbonylu i mogą na przykład alkilować inne aminokwasy. Ta aktywność uczyniła DHA użytecznym syntetycznie do przygotowania lantioniny .
Występowanie
Resztę dehydroalaniny po raz pierwszy wykryto w nizynie , cyklicznym peptydzie o działaniu przeciwdrobnoustrojowym. Dehydroalanina jest również obecna w niektórych lantybiotykach i mikrocystynach .
DHA można wytworzyć z cysteiny lub seryny na drodze prostej katalizy zasadowej bez potrzeby stosowania enzymu, co może się zdarzyć podczas gotowania i zasadowego przygotowywania żywności. Może następnie alkilować inne reszty aminokwasowe, takie jak lizyna , tworząc wiązania poprzeczne lizynoalaniny i racemizację oryginalnej alaniny. Otrzymane białka mają niższą jakość odżywczą dla niektórych gatunków, ale wyższą jakość odżywczą dla innych. Niektóre lizynoalaniny mogą również powodować powiększenie nerek u szczurów.
Wiele peptydów zawierających dehydroalaninę jest toksycznych.

Przez długi czas uważano, że reszta dehydroalaniny jest ważną elektrofilową resztą katalityczną w enzymach liazy amoniaku histydyny i amoniaku fenyloalaniny , ale później odkryto, że aktywną resztą jest inna nienasycona pochodna alaniny — 3,5-dihydro-5-metylodien -4H-imidazol-4-on — czyli jeszcze bardziej elektrofilowy.
- ^ Upadki, DM; Ernst, DC (kwiecień 2015). „Od mikrobiologii do biologii raka: rodzina białek Rid zapobiega uszkodzeniom komórkowym spowodowanym przez endogennie generowane reaktywne formy azotu” . Mikrobiologia Molekularna . 96 (2): 211–9. doi : 10.1111/mmi.12945 . PMC 4974816 . PMID 25620221 .
- ^ a b c d Siodłak, Dawid (2015). „α, β-dehydroaminokwasy w naturalnie występujących peptydach” . Aminokwasy . 47 (1): 1–17. doi : 10.1007/s00726-014-1846-4 . PMC 4282715 . PMID 25323736 .
- ^ Friedman, Mendel (1999). „Lizynoalanina w żywności i białkach przeciwbakteryjnych”. W Jackson, Lauren S.; Knize, Mark G.; Morgan, Jeffrey N. (red.). Wpływ przetwarzania na bezpieczeństwo żywności . Postępy w medycynie eksperymentalnej i biologii . Tom. 459.Springera. s. 145–159. doi : 10.1007/978-1-4615-4853-9_10 . ISBN 978-1-4615-4853-9 . PMID 10335374 .
- ^ Retey, János (2003). „Odkrycie i rola metylidenoimidazolonu, wysoce elektrofilowej grupy protetycznej”. Biochimica et Biophysica Acta (BBA) - Białka i proteomika . 1647 (1–2): 179–184. doi : 10.1016/S1570-9639(03)00091-8 . PMID 12686130 .
- ^ Calabrese JC, Jordan DB, Boodhoo A, Sariaslani S, Vannelli T (wrzesień 2004). „Struktura krystaliczna liazy amoniakalnej fenyloalaniny: dipole wielokrotnej helisy zaangażowane w katalizę”. Biochemia . 43 (36): 11403–16. doi : 10.1021/bi049053+ . PMID 15350127 .