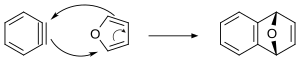Aryne
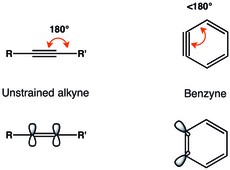
Aryny i benzyny są wysoce reaktywnymi związkami powstałymi z pierścienia aromatycznego przez usunięcie dwóch podstawników . Aryny są przykładami didehydroarenów (w tym przypadku 1,2-didehydroarenów), chociaż znane są również 1,3- i 1,4-didehydroareny. Aryny są przykładami naprężonych alkinów .
Wiązanie w arynach
Alkinowa reprezentacja benzyny jest najczęściej spotykana. Aryny są zwykle opisywane jako mające napięte wiązanie potrójne.
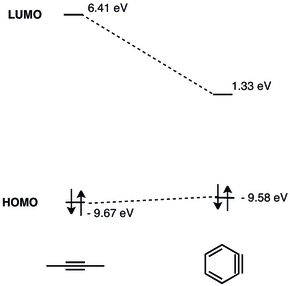
Geometryczne ograniczenia potrójnego wiązania w benzynie skutkują zmniejszonym nakładaniem się orbitali p w płaszczyźnie, a tym samym słabszym potrójnym wiązaniem. Częstotliwość drgań potrójnego wiązania w benzynie Radziszewski określił na 1846 cm −1 , co wskazuje na słabsze wiązanie potrójne niż w nienaprężonym alkinie o częstotliwości drgań około 2150 cm −1 . Niemniej jednak benzyna bardziej przypomina naprężony alkin niż dwurodnik, co widać na podstawie dużej przerwy singlet-tryplet i reaktywności podobnej do alkinu.
LUMO arynu leży znacznie niżej niż LUMO nienaprężonych alkinów, co czyni go lepszym dopasowaniem energetycznym do HOMO nukleofilów . Stąd benzyna ma charakter elektrofilowy i reaguje z nukleofilami. Szczegółowa analiza MO benzyny została przedstawiona w 1968 roku.
Pokolenie arynów
Ze względu na ich ekstremalną reaktywność, aryny muszą być generowane in situ . Typowe dla innych reaktywnych półproduktów , benzyna musi być uwięziona, w przeciwnym razie dimeryzuje do bifenylenu .
Wczesne drogi do benzyny obejmowały odhydrohalogenację halogenków arylowych :
Takie reakcje wymagają mocnej zasady i wysokich temperatur. 1,2-Dwupodstawione areny służą jako prekursory benzyn w łagodniejszych warunkach. Benzyna jest generowana przez dehalogenację 1-bromo-2-fluorobenzenu przez magnez. Kwas antranilowy można przekształcić w 2-diazoniobenzeno-1-karboksylan przez diazowanie i neutralizację. Chociaż wybuchowy, ten obojnaczy jest wygodnym i niedrogim prekursorem benzyny.
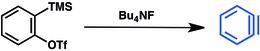
Inna metoda opiera się na triflatach trimetylosililoarylu . Wypieranie fluoru grupy trimetylosililowej indukuje eliminację triflatu i uwalnianie benzyny:
Reakcja heksadehydro Dielsa-Aldera (HDDA) obejmuje cykloaddycję 1,3-diynu i alkinu.
N -aminowanie 1H - benzotriazolu kwasem hydroksyloamino - O -sulfonowym tworzy związek pośredni, który można utlenić do benzynu z prawie ilościową wydajnością za pomocą octanu ołowiu (IV) .
Reakcje arynów
Nawet w niskich temperaturach aryny są niezwykle reaktywne. Ich reaktywność można podzielić na trzy główne klasy: (1) addycje nukleofilowe, (2) reakcje pericykliczne i (3) wstawianie wiązań.
Dodatki nukleofilowe do aryn
Po potraktowaniu zasadowymi nukleofilami halogenki arylu deprotonują alfa do grupy opuszczającej, co powoduje dehydrohalogenację . Badania wymiany izotopów wskazują, że w przypadku fluorków arylu, a czasami chlorków arylu, eliminacja przebiega w dwóch etapach, deprotonacji, po której następuje wydalenie nukleofila. Zatem proces jest formalnie analogiczny do mechanizmu E1cb związków alifatycznych. Bromki i jodki arylu, z drugiej strony, na ogół wydają się podlegać eliminacji przez skoordynowany mechanizm syn-koplanarny E2. Otrzymany benzyn tworzy produkty addycji, zwykle w wyniku addycji nukleofilowej i protonowania. Wytwarzanie półproduktu benzynowego jest powolnym etapem reakcji.
Reakcje „sprzęgania arynowego” pozwalają na generowanie związków bifenylowych, które są cenne w przemyśle farmaceutycznym, rolnictwie oraz jako ligandy w wielu przemianach katalizowanych metalami.
Produkt metal-aren można również dodać do innego arynu, co prowadzi do polimeryzacji wzrostu łańcucha . Użycie cyjanku miedzi (I) jako inicjatora w celu dodania do pierwszego arynu dało polimery zawierające do około 100 jednostek arenowych.
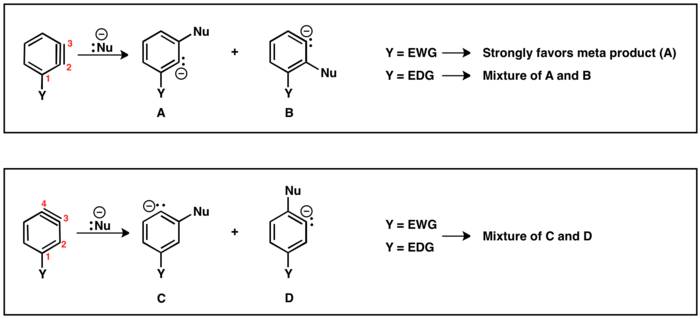
Gdy grupa opuszczająca (LG) i podstawnik (Y) są wzajemnie orto lub para, możliwy jest tylko jeden pośredni benzyn. Jednakże, gdy LG jest meta do Y, możliwe są wyniki regiochemiczne (A i B). Jeśli Y jest odciąganiem elektronów, to H B jest bardziej kwaśny niż HA, co powoduje generowanie regioizomeru B. Analogicznie, jeśli Y jest donorem elektronów, generowany jest regioizomer A, ponieważ teraz HA jest bardziej kwaśnym protonem.
Istnieją dwa możliwe regioizomery benzyny z podstawnikiem (Y): wiązanie potrójne może znajdować się między C2 a C3 lub między C3 a C4. Podstawniki w pozycji orto do grupy opuszczającej będą prowadzić do potrójnego wiązania między C2 i C3. Para Y i LG doprowadzą do regioizomeru z potrójnym wiązaniem między C3 i C4. Podstawnik meta może zapewnić oba regioizomery, jak opisano powyżej. W przypadku wiązania potrójnego znajdującego się między C2 a C3, podstawniki odciągające elektrony (EWG), np. CF3, będą kierować addycję nukleofilową tak, aby karboanion był jak najbliżej EWG. Jednak podstawniki elektronodonorowe (EDG), np. CH3, zapewnią niewielką selektywność między produktami. W regioizomerze, w którym wiązanie potrójne znajduje się między C3 a C4, wpływ podstawnika na addycję nukleofilową jest zmniejszony i często otrzymuje się mieszaniny produktów para i meta.
Reakcje pericykliczne arynów
Benzyna ulega szybkiej dimeryzacji, tworząc bifenylen. Niektóre drogi do benzyny prowadzą do szczególnie szybkiej i wysokiej wydajności tej późniejszej reakcji. Trimeryzacja daje trifenylen .
Benzyny mogą ulegać reakcjom cyklizacji [4+2] . Po wytworzeniu w obecności antracenu powstaje tryptyren . W tej metodzie poniżej pokazano uzgodniony mechanizm reakcji Dielsa-Aldera między benzyną a furanem. Uważa się, że inne cykloaddycje benzyny [4 + 2] zachodzą za pomocą mechanizmu stopniowego.
Klasycznym przykładem jest synteza 1,2,3,4-tetrafenylonaftalenu . Tetrabromobenzen może reagować z butylolitem i furanem , tworząc tetrahydroantracen
[4+2] cykloaddycje arynów były powszechnie stosowane do całkowitej syntezy produktów naturalnych. Głównym ograniczeniem takiego podejścia jest jednak konieczność stosowania ograniczonych dienów, takich jak furan i cyklopentadien. W 2009 roku Buszek i współpracownicy zsyntetyzowali herbindol A przy użyciu [4+2]-cykloaddycji aryny. 6,7-indolin ulega [4+2] cykloaddycji z cyklopentadienem, dając złożony produkt tetracykliczny.
Benzyny ulegają [2+2] cykloaddycji z szeroką gamą alkenów. Ze względu na elektrofilowy charakter benzyny, w tej reakcji najlepiej sprawdzają się alkeny zawierające podstawniki będące elektronodonorami.
Ze względu na powstawanie znacznych produktów ubocznych chemia arynu [2+2] jest rzadko wykorzystywana w całkowitej syntezie produktu naturalnego. Niemniej jednak istnieje kilka przykładów. W 1982 roku Stevens i współpracownicy opisali syntezę taksodionu, w której wykorzystano cykloaddycję [2 + 2] między acetalem arynu i ketenu.
Mori i współpracownicy przeprowadzili katalizowaną palladem [2+2+2]-kocyklizację arynu i diynu w ich całkowitej syntezie tajwanin C.
Reakcje wstawiania wiązań aryn
Pierwszym przykładem reakcji wstawienia wiązania σ arynu jest synteza melleiny w 1973 roku.
Inne dehydrobenzeny
Jeśli benzyne to 1,2-didehydrobenzen, możliwe są dwa dalsze izomery: 1,3-didehydrobenzen i 1,4-didehydrobenzen. Ich energie in silico wynoszą odpowiednio 106, 122 i 138 kcal/mol (444, 510 i 577 kJ/mol). Izomery 1,2- i 1,3- mają singletowe stany podstawowe, podczas gdy dla 1,4-didehydrobenzenu różnica jest mniejsza.
Zbadano interkonwersję 1,2-, 1,3- i 1,4-didehydrobenzenów. Postulowano, że konwersja 1,2- do 1,3-didehydrobenzenu zachodzi podczas pirolizy (900 ° C) prekursorów arynu podstawionego fenylem , jak pokazano poniżej. Do interkonwersji benzyny wymagane są ekstremalnie wysokie temperatury.
1,4-Didehydroareny
W klasycznych doświadczeniach z 1,4-didehydrobenzenem, ogrzewanie do 300°C, [1,6-D2]-A łatwo równoważy się z [3,2-D2]-B , ale nie równoważy się z C lub D. Jednoczesna migracja atomów deuteru w celu utworzenia B i fakt, że nie powstaje żaden z C ani D , można wytłumaczyć jedynie obecnością cyklicznego i symetrycznego związku pośredniego – 1,4-didehydrobenzenu.
Dla 1,4-didehydrobenzenu zaproponowano dwa stany: singletowy i trypletowy, przy czym stan singletowy ma niższą energię. Stan trypletowy reprezentuje dwa nieoddziałujące ze sobą centra rodników, a zatem powinien pobierać wodory z taką samą szybkością jak rodnik fenylowy. Jednak stan singletowy jest bardziej ustabilizowany niż tryplet, dlatego część energii stabilizującej zostanie utracona w celu utworzenia stanu przejściowego do rozszczepienia wodoru, co doprowadzi do wolniejszej absorpcji wodoru. Chen zaproponował zastosowanie analogów 1,4-didehydrobenzenu, które mają duże przerwy energetyczne singlet-tryplet w celu zwiększenia selektywności kandydatów na leki enediyny.
Historia
Pierwsze dowody na istnienie arynów pochodzą z prac Stoermera i Kahlerta. W 1902 roku zaobserwowali, że po potraktowaniu 3-bromobenzofuranu zasadą w etanolu powstaje 2-etoksybenzofuran. Na podstawie tej obserwacji postulowali arynowy związek pośredni.
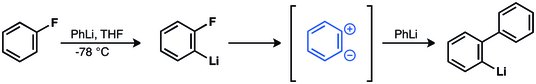
Wittiga i in. wywołał obojnaczy związek pośredni w reakcji fluorobenzenu i fenylolitu z wytworzeniem bifenylu. Hipoteza ta została później potwierdzona.
W 1953 roku eksperymenty z etykietowaniem 14 C dostarczyły silnego wsparcia dla pośrednictwa benzyny. John D. Roberts i in. wykazał, że reakcja chlorobenzenu-1-14 C i amidu potasu dała równe ilości aniliny z włączeniem 14 C w C-1 i C-2.
Wittig i Pohmer stwierdzili, że benzyna uczestniczy w reakcjach cykloaddycji [4+2].
Dodatkowe dowody na istnienie benzyny pochodziły z badań spektroskopowych. Benzynę zaobserwowano w „pojemniku molekularnym”.
STM sfotografowano pojedynczą cząsteczkę arynu .
1,3-Didehydroaren został po raz pierwszy zademonstrowany w latach 90. XX wieku, kiedy został wytworzony z 1,3-dipodstawionych pochodnych benzenu, takich jak peroksyester 1,3-C 6 H 4 (O 2 C(O)CH 3 ) 2 .
Przełom w sprawie 1,4-didehydrobenzenu nastąpił w latach 60. XX wieku, po badaniach nad cyklizacją Bergmana . Temat ten stał się aktualny wraz z odkryciem „cytostatyków” enediyny, takich jak kalicheamycyna , która generuje 1,4-didehydrobenzen.
Przykłady benzyn w syntezie całkowitej
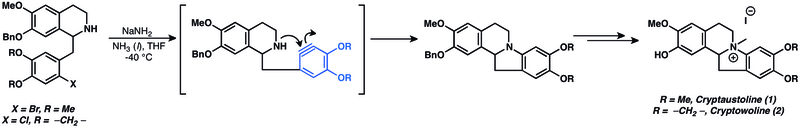
Różnorodne produkty naturalne zostały przygotowane przy użyciu arynów jako półproduktów. Dodatki nukleofilowe do arynów są szeroko stosowane w całkowitej syntezie produktów naturalnych. Rzeczywiście, nukleofilowe dodatki arynów są jednymi z najstarszych znanych zastosowań chemii arynów. Addycja nukleofilowa do aryny została wykorzystana w próbie syntezy kryptoaustoliny (1) i kryptowoliny (2).
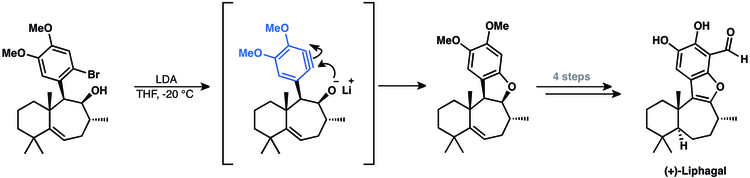
Synteza tetracyklicznego meroterpenoidu (+)-liphagal obejmowała arynowy związek pośredni. Ich podejście polegało na cyklizacji arynu w celu zamknięcia końcowego pierścienia produktu naturalnego.
Wieloskładnikowe reakcje arynów są potężnymi przemianami, które pozwalają na szybkie tworzenie 1,2-dipodstawionych arenów. Pomimo ich potencjalnej użyteczności przykłady wieloskładnikowych reakcji arynowych w syntezie produktów naturalnych są nieliczne. W syntezie dehydroaltenuenu B zastosowano czteroskładnikową reakcję sprzęgania arynów.
Zobacz też
- Więcej przykładów zastosowania chemii arynów: tricyklobutabenzen , in-metylocyklofan , kompleks benzyny metali przejściowych
- Równoważnik pirydyny pirydyna
Linki zewnętrzne
-
 Media związane z Arynes w Wikimedia Commons
Media związane z Arynes w Wikimedia Commons