1,2-dioksygenaza katecholowa
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 1,2-dioksygenazy katecholowej | |||||||||
 | |||||||||
| nr WE | 1.13.11.1 | ||||||||
| nr CAS | 9027-16-1 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
1,2-dioksygenaza katecholowa ( EC 1.13.11.1 , 1,2-CTD , 1,2-oksydoreduktaza katecholowo-tlenowa , 1,2-pirokatechaza , katechaza , 1,2-oksygenaza katecholowa , dioksygenaza katecholowa , pirokatechaza , pirokatechol 1, 2-dioksygenaza , CD I , CD II ) jest enzymem , który katalizuje oksydacyjne rozszczepienie pierścienia katecholu , tworząc kwas cis,cis -mukonowy :
Dokładniej, 1,2-CTD jest dioksygenazą intradiolową , rodziną dioksygenaz katecholowych, która rozszczepia wiązanie między fenolowymi grupami hydroksylowymi katecholu przy użyciu kofaktora Fe3 + .
Dotychczas zaobserwowano występowanie 1,2-CTD w następujących gatunkach bakterii i grzybów glebowych: Pseudomonas sp. , Pseudomonas fluorescens , Aspergillus niger , Brevibacterium fuscum , Acinetobacter calcoaceticus , Trichosporon cutaneum , Rhodococcus erythropolis , Frateuria sp. , Rhizobium trifolii , Pseudomonas putida , Candida tropicalis , Candida maltoza , Rhizobium leguminosarum i Nocardia sp. . Bakterie te następnie wykorzystują 1,2-CTD w ostatnim etapie degradacji związków aromatycznych do produktów alifatycznych.
Historia
Dwie rodziny dioksygenaz zostały odkryte przez Osamu Hayaishi i Kizo Hashimoto w 1950 roku: 1,2-dioksygenaza katecholowa i 2,3-dioksygenaza katecholowa (2,3-CTD). Zidentyfikowano, że te dwa enzymy należą do dwóch oddzielnych rodzin dioksygenaz katecholowych: 1,2-CTD została sklasyfikowana jako dioksygenaza intradiolowa, podczas gdy 2,3-CTD została sklasyfikowana jako dioksygenaza ekstradiolowa . Te dwa enzymy można rozróżnić na podstawie ich produktów reakcji i kofaktorów. 1,2-CTD wykorzystuje Fe 3+ jako kofaktor do rozszczepienia wiązania węgiel-węgiel pomiędzy fenolowymi grupami hydroksylowymi katecholu, dając w ten sposób kwas mukonowy jako produkt. W przeciwieństwie do tego, 2,3-CTD wykorzystuje Fe 2+ jako kofaktor do rozszczepiania wiązania węgiel-węgiel sąsiadującego z fenolowymi grupami hydroksylowymi katecholu, dając w ten sposób 2-hydroksymukonaldehye jako produkt.
Struktura enzymu
Prawie wszyscy członkowie rodziny 1,2-CTD są homodimerami ; Wyjątkiem od tej reguły jest enzym 1,2-CTD wytwarzany przez Pseudomonas arvilla , zawierający dwie wysoce homologiczne podjednostki, które mogą tworzyć homo- lub heterodimer. Enzym przypomina kształtem bumerang i dlatego można go wyraźnie podzielić na trzy domeny: dwie domeny katalityczne znajdujące się na każdym końcu „bumerangu” i domenę łącznikową w środku.
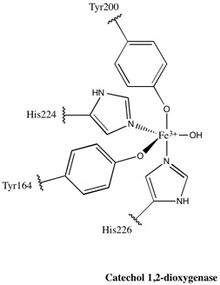
Każda domena katalityczna składa się z dwóch ułożonych w stos arkuszy β o mieszanej topologii i kilku losowych cewek . Te arkusze i cewki obejmują następnie miejsce aktywne: niehemowy kompleks żelaza (III). Bez hemu żelazo musi być zligowane z czterema resztami aminokwasowymi (Tyr200, His226, Tyr164, His224), aby zachować konformację aktywną katalitycznie. Z Tyr200 i His226 działającymi jako ligandy osiowe oraz Tyr164, His224 i cząsteczka rozpuszczalnika wodnego działająca jako ligandy równikowe, kompleks Fe 3+ wykazuje trygonalną geometrię bipiramidalną. Ponieważ miejsca aktywne każdej domeny katalitycznej są oddalone od siebie o 40 Å, nie uważa się, że wpływają one na siebie allosterycznie.
W przeciwieństwie do tego domena łącznikowa składa się z helis α dostarczanych przez dwie domeny katalityczne: każda domena wnosi pięć helis z ich N-końców i jedną z helisy, która obejmuje zarówno domenę katalityczną, jak i domenę łącznikową. W centrum domeny łącznikowej znajduje się hydrofobowy tunel o wymiarach 8 na 35 Å z dwoma fosfolipidami związanymi na każdym końcu. Głowa każdego fosfolipidu jest skierowana na zewnątrz w kierunku roztworu, podczas gdy ogony są osadzone w enzymie. Funkcja tego hydrofobowego tunelu jest nieznana, chociaż postulowano dwie hipotezy dotyczące jego użyteczności. Po pierwsze, wiązanie końcowych fosfolipidów zmienia konformację miejsc aktywnych, co sugeruje, że tunel działa jako efektor, pozwalając enzymowi na aktywność tylko w niektórych obszarach komórki. Druga hipoteza postuluje, że tunel reguluje sztywność błony lipidowej poprzez degradację węglowodorów fenolowych i zdolność wiązania się z innymi lipidami. Badania wykazały, że węglowodory fenolowe wpływają na właściwości funkcjonalne i strukturalne błon komórkowych. 1,2-CTD rozkłada węglowodory fenolowe kluczowe dla syntezy błon lipidowych. Dlatego 1,2-CTD może wiązać się z błoną lipidową komórki poprzez swoje końcowe fosfolipidy, a tym samym mieć większy dostęp do węglowodorów fenolowych niezbędnych w strukturze błony lipidowej.
Mechanizm enzymatyczny
Mechanizm katalityczny 1,2-dioksygenazy katecholowej został wyjaśniony przy użyciu kombinacji eksperymentów znakowania O18 i krystalografii . Po wejściu do miejsca aktywnego grupa hydroksylowa na czwartym węglu (C4) katecholu wiąże się z Fe 3+ ; to wiązanie jest ułatwione przez ligand wodorotlenkowy, który deprotonuje grupę hydroksylową C4. Druga grupa hydroksylowa katecholu na węglu 3 (C3) jest skoordynowana z Fe 3+ po jej deprotonowaniu przez ligand Tyr200. W procesie deprotonowania grupy hydroksylowej C3 Tyr200 dysocjuje z kompleksu katalitycznego.
Tlen jest związany z podłożem poprzez szereg wpływów trans i stabilizujących wiązań wodorowych między substratem a innymi resztami aminokwasowymi w miejscu aktywnym. His226 przyjmuje gęstość elektronów z podłoża, w konsekwencji zmniejszając wiązanie między Fe 3+ a grupą hydroksylową C4. W tym samym czasie wiązanie między grupą hydroksylową C3 i Fe3 + jest zwiększone z powodu efektu odciągania elektronów przez Tyr164. Te zniekształcenia, w połączeniu z wiązaniem wodorowym między Arg221 a grupą hydroksylową C3, indukują ketonizację grupy hydroksylowej C3 i zwiększają charakter karboanionu C4. Nowo utworzony karbanion C4 atakuje O2, wiążąc go w ten sposób z podłożem.
Kolejny wpływ trans następuje po wyżej wspomnianym etapie, prowadząc do rozszczepienia O2 i następnie wstawienia jednej z cząsteczek tlenu między C3 i C4. Po tej reakcji następuje szybka hydroliza, w wyniku której powstaje aktywowane miejsce i produkt.
Linki zewnętrzne
- Katechol + 1,2-dioksygenaza w US National Library of Medicine Medical Subject Headings (MeSH)