Cdc6
| Białko podziału komórkowego Cdc6/18 | |
|---|---|
| Identyfikatory | |
| Symbol | Cdc6 |
| InterPro | IPR016314 |
| Białko replikacyjne DNA typu Orc1/Cdc6, archeony | |
|---|---|
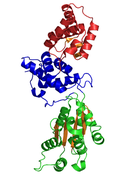 Struktura krystaliczna CDC6 z P. aerophilum (). Domeny zielone i niebieskie to domeny AAA ; czerwona domena to C-terminalna domena HTH Cdc6 (infobox poniżej).
| |
| Identyfikatory | |
| Symbol | Orc1/Cdc6_arc |
| InterPro | IPR014277 |
| Cdc6/Orc1, C-terminalne | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identyfikatory | |||||||||
| Symbol | Cdc6_C | ||||||||
| Pfam | PF09079 | ||||||||
| InterPro | IPR015163 | ||||||||
| CDD | cd08768 | ||||||||
| |||||||||
Cdc6 , czyli cykl podziału komórkowego 6 , jest białkiem w komórkach eukariotycznych . Jest badany głównie w pączkujących drożdżach Saccharomyces cerevisiae (). Jest niezbędnym regulatorem replikacji DNA i odgrywa ważną rolę w aktywacji i utrzymaniu mechanizmów punktów kontrolnych w cyklu komórkowym , które koordynują fazę S i mitozę . Jest częścią kompleksu przedreplikacyjnego (pre-RC) i jest wymagana do ładowania białek podtrzymujących minichromosomy (MCM) do DNA, co jest niezbędnym etapem inicjacji syntezy DNA. Ponadto należy do rodziny ATPaz AAA+ i jest silnie spokrewniony z ORC1 ; oba są tym samym białkiem w archeonach .
Funkcjonować
CDC6 jest białkiem wiążącym ATP i członkiem kompleksu przedreplikacyjnego (pre-RC) wraz z kompleksem rozpoznającym miejsce pochodzenia (ORC) , Cdt1 i kompleksem MCM (zawierającym MCM2-7p). CDC6 składa się po ORC w sposób zależny od ATP i jest wymagany do ładowania białek MCM do DNA. Rekonstrukcja obrazów z mikroskopu elektronowego wykazała, że kompleks ORC-CDC6 tworzy strukturę pierścieniową o wymiarach zbliżonych do pierścieniowej helikazy MCM. Model rozdzielczości prawie atomowej całego kompleksu ORC-Cdc6-Cdt1-Mcm2-7 (OCCM) z DNA został złożony z danych EM w 2017 r. Uważa się, że kompleks CDC6-Cdt1 wykorzystuje hydrolizę ATP do przewlekania DNA przez centralny otwór pączka MCM. Mutacje w motywie wiążącym CDC6 silnie sugerują, że wiązanie ATP i hydroliza są niezbędne dla jego funkcji. Minimalne wymagania dotyczące wiązania DNA zostały zmapowane w jego 47-aminokwasowej sekwencji. Ponadto Cdc6 pośrednio hamuje aktywację kinazy fazy M p34cdc2/CDC28 , w ten sposób tłumiony jest podział jądrowy.
Rozporządzenie
CDC6 jest zwykle obecny na wysokim poziomie podczas fazy G1 cyklu komórkowego . Dzieje się tak częściowo dlatego, że gen CDC6 jest transkrybowany tylko podczas fazy G1. Na początku fazy S CDC6 ulega fosforylacji przez kompleks Cdc28 -Clb5-Clb6 (Cdk2) iw konsekwencji ulega inaktywacji. Zostało to wykazane przez wprowadzenie mutacji w CDC6 w miejscach konsensusowych dla fosforylacji Cdk2 (w pobliżu N-końca), które hamują degradację. Fosforylacja może być ponadto katalizowana przez Cdc28-Cln. ubikwitynylację zależną od SCFCDC4 , a następnie degradowany przez proteasom . Zatem regulacja CDC6 jest ściśle skorelowana z aktywnością Cdk2, a ponieważ aktywność Cdk2 oscyluje raz na cykl komórkowy, akumulacja i degradacja CDC6 również oscyluje.
Można wyróżnić dwa stany. W pierwszym stanie (podczas fazy G1) aktywność Cdk2 jest niska, CDC6 może się gromadzić, stąd pre-RC może powstać, ale nie zostać aktywowany. W drugim stanie aktywność Cdk2 jest wysoka, CDC6 ulega inaktywacji, stąd pre-RC jest aktywowany, ale nie powstaje. Ta zmiana zapewnia, że replikacja DNA jest przeprowadzana tylko raz na cykl komórkowy. Wykazano, że nadekspresja CDC6 nie indukuje ponownej replikacji w pokrewnych komórkach, prawdopodobnie z powodu hamowania przez CDK, który resetuje zegar cyklu komórkowego do G1. Niemniej jednak zasugerowano, że regulacja CDC6 jest jednym z kilku zbędnych mechanizmów, które zapobiegają ponownej replikacji DNA w komórkach eukariotycznych.
Struktura
Struktura krystalograficzna białka pokrewnego Cdc6/Orc1 z archeona Pyrobaculum aerophilum została rozwiązana i zidentyfikowano trzy domeny strukturalne. Domena I i II tworzą miejsce wiązania/hydrolizy ATP i są podobne do innych ATPaz AAA+. Domena III jest strukturalnie spokrewniona z domeną uskrzydlonej helisy, a zatem może wchodzić w interakcje z pierwotnym DNA. Na podstawie badań z kompleksem ładowania klamry γ E. coli zasugerowano, że domena III pośredniczy w interakcjach białko-białko z innymi ATPazami AAA + w pre-RC, co sugeruje, że CDC6 buduje homodimer w swojej natywnej postaci. Domeny I i II tworzą cząsteczkę w kształcie nerkowca, która wiąże ATP w szczelinie i dodatkowo buduje motyw sensoryczny do rozpoznawania ATP/ADP. Uważa się również, że domeny te pośredniczą w późniejszych zmianach konformacyjnych. Niemniej jednak dokładne role funkcjonalne tych domen pozostają niejasne.
Choroba
Wykazano, że CDC6 wykazuje aktywność protoonkogenną . Nadekspresja Cdc6 zakłóca ekspresję supresorowych nowotworów INK4/ARF poprzez mechanizm obejmujący epigenetyczną modyfikację chromatyny w locus INK4/ARF. Ponadto nadekspresja CDC6 w komórkach pierwotnych może sprzyjać hiperreplikacji DNA i indukować starzenia podobną do tej spowodowanej aktywacją onkogenu. Odkrycia te wskazują, że deregulacja ekspresji CDC6 w komórkach ludzkich stwarza poważne ryzyko karcynogenezy. Zaobserwowano obniżenie poziomu CDC6 w raku prostaty i powiązano je z cechami fenotypowymi agresywnego raka prostaty. Ponadto zaobserwowano, że poziom Cdc6 jest znacznie zwiększony w raku szyjki macicy , raku płuc i raku mózgu .

