Chemia gospodarz-gość
W chemii supramolekularnej chemia gospodarz-gość opisuje kompleksy , które składają się z dwóch lub więcej cząsteczek lub jonów , które są utrzymywane razem w unikalnych relacjach strukturalnych siłami innymi niż pełne wiązania kowalencyjne . Chemia gospodarz-gość obejmuje ideę rozpoznawania molekularnego i interakcji poprzez wiązania niekowalencyjne . Wiązanie niekowalencyjne ma kluczowe znaczenie dla utrzymania trójwymiarowej struktury dużych cząsteczek, takich jak białka, i bierze udział w wielu procesach biologicznych, w których duże cząsteczki wiążą się ze sobą specyficznie, ale przejściowo.
Chociaż oddziaływania niekowalencyjne można z grubsza podzielić na te o większym udziale elektrostatycznym lub dyspersyjnym, istnieje kilka powszechnie wymienianych rodzajów oddziaływań niekowalencyjnych: wiązania jonowe , wiązania wodorowe , siły van der Waalsa i oddziaływania hydrofobowe .


Przegląd
Chemia gospodarz-gość to gałąź chemii supramolekularnej , w której cząsteczka gospodarza wiąże tak zwaną cząsteczkę gościa lub jon. Dwa składniki kompleksu oddziałują siłami niekowalencyjnymi, najczęściej przez wiązania wodorowe . Wiązanie między gospodarzem a gościem może być wysoce selektywne, w takim przypadku interakcja nazywana jest rozpoznawaniem molekularnym . Często dynamiczna równowaga między stanem niezwiązanym i związanym:
- H ="gospodarz", G ="gość", HG ="kompleks gospodarz-gość"
Składnik „gospodarza” jest często większą cząsteczką i zawiera mniejszą cząsteczkę „gościa”. W systemach biologicznych analogiczne terminy gospodarza i gościa są powszechnie określane odpowiednio jako enzym i substrat .
Termodynamiczne zasady interakcji gospodarz-gość
Termodynamikę interakcji gospodarza i gościa można ocenić za pomocą spektroskopii NMR, spektroskopii UV/widzialnej i izotermicznej kalorymetrii miareczkowej. Analiza ilościowa wartości stałych wiązania dostarcza przydatnych informacji termodynamicznych.
Stałą asocjacji można zdefiniować wyrażeniem ^
gdzie {HG} jest aktywnością termodynamiczną kompleksu w równowadze. {H} reprezentuje aktywność gospodarza, a {G} aktywność gościa. Ilości są odpowiednimi stężeniami i są ilorazem [ , i współczynników aktywności .
W praktyce stałą równowagi definiuje się zwykle za pomocą stężeń.
Gdy stosuje się tę definicję, zakłada się, że iloraz współczynników aktywności ma wartość liczbową równą jeden. Następnie okazuje się, że równowagi ma wymiar 1/stężenie, ale to być prawdą, ponieważ standardowa zmiana energii swobodnej Gibbsa, jest proporcjonalne do logarytmu K .
rozwiązany, gdy wymiar jest zdefiniowany jako odwrotność wymiaru ilorazu stężeń Wynika z tego, że , że ma stałą wartość we wszystkich odpowiednich warunkach eksperymentalnych. Niemniej jednak powszechną praktyką jest dołączanie wymiaru, takiego jak milimol na litr lub mikromol na litr, do wartości K , która została określona eksperymentalnie.
Duża tworząc kompleks gospodarz-gość.
Wyznaczanie wiążących wartości stałych
Prosta kompleksacja gospodarz-gość
Kiedy cząsteczki gospodarza i gościa łączą się, tworząc pojedynczy kompleks, równowaga jest przedstawiona jako
a stała równowagi K jest zdefiniowana jako
gdzie [X] oznacza stężenie związku chemicznego X (zakłada się, że wszystkie współczynniki aktywności mają wartości liczbowe 1). Równania bilansu masowego w dowolnym punkcie danych
gdzie i reprezentują całkowite stężenia żywiciela i gościa, można sprowadzić do jednego równania kwadratowego w, powiedzmy, [G], a więc T sol {\ rozwiązać analitycznie dla dowolnej danej wartości K. Następnie można wyprowadzić stężenia [H] i [HG].
wartości ilości wielkości obserwowanej . Wtedy sumę kwadratów U, po wszystkich punktach danych, np, można zdefiniować jako
i można to zminimalizować w odniesieniu do wartości stałej stabilności K i parametru, takiego jak przesunięcie chemiczne gatunku HG (dane nmr) lub jego molowa chłonność (dane uv/vis). Minimalizację można przeprowadzić w arkuszu kalkulacyjnym, takim jak EXCEL, za pomocą wbudowanego narzędzia SOLVER.
Ta procedura ma zastosowanie do adduktów 1:1.
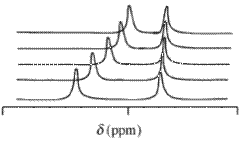
Dane magnetycznego rezonansu jądrowego (NMR).
W widmach magnetycznego rezonansu jądrowego (NMR) obserwowana wartość przesunięcia chemicznego δ wynikająca z danego atomu zawartego w cząsteczce odczynnika i jednego lub większej liczby kompleksów tego odczynnika będzie ważoną stężeniem średnią wszystkich przesunięć tych związków chemicznych. Zakłada się, że wymiana chemiczna jest szybka w skali czasowej NMR. wyrazy ułamków molowych ,
przesunięcie chemiczne i- gatunku chemicznego, który zawiera jądro, a to stężenie / ułamek molowy ( stężenie / mol dm -3 ) tego gatunku. To wyrażenie ma taką samą postać matematyczną jak prawo Beera . Wartości przesunięcia chemicznego można uzyskać dla więcej niż jednego jądra w sposób analogiczny do pomiaru absorbancji przy więcej niż jednej długości fali. Typowymi izotopami, które można zastosować w tym kontekście, są 1H , 13C i 31P . Zwykle do pomiaru wartości przesunięcia chemicznego 1H stosuje się rozpuszczalnik deuterowany .
Dane absorbancji
Zakłada się, że absorbancja każdego gatunku jest proporcjonalna do stężenia tego gatunku, zgodnie z prawem Beera-Lamberta .
jest długością fali, długością drogi optycznej kuwety, która zawiera roztwór N związków ( chromoforów ), jest absorbancją molową (znaną również jako współczynnik ekstynkcji) i- tego związku chemicznego przy długości fali λ, c i jest jego koncentracja. Po obliczeniu stężeń jak powyżej i zmierzeniu absorbancji dla próbek o różnych stężeniach gospodarza i gościa, prawo Beera-Lamberta zapewnia zestaw równań przy danej długości fali, który można rozwiązać za pomocą liniowej metody najmniejszych kwadratów proces dla nieznanych wartości współczynnika ekstynkcji przy tej długości fali.
Dane dotyczące fluorescencji
Traktowanie tego typu danych jest podobne do traktowania danych absorbancji. W rzeczywistości równanie określające zależność między intensywnością fluorescencji a stężeniami poszczególnych cząsteczek jest bardzo podobne.
gdzie gatunku przy stężeniu
Kalorymetria
Ciepło wydzielane po dodaniu porcji roztworu żywiciela do roztworu zawierającego gościa jest sumą wkładów z każdej reakcji
gdzie jest zmierzoną wartością wymiany ciepła (skorygowaną o wszystkie zewnętrzne udziały ciepła) w punkcie danych jot , Delta ilość ciepła pochłoniętego lub wyemitowanego, gdy powstaje 1 mol i- tego produktu reakcji i jest rzeczywistą zmianą liczby moli tego produktu w tym momencie punkt danych. oblicza się, rozwiązując równania bilansu masowego z zadanymi wartościami stałych równowagi. Jeżeli znane są wartości stałej równowagi, standardową zmianę entalpii można obliczyć metodą liniową najmniejszych kwadratów, w przeciwnym razie należy zastosować nieliniową metodę dopasowywania danych.
Izotermiczna kalorymetria miareczkowa jest powszechnie stosowana do określania wartości zarówno stałej równowagi, jak i odpowiedniej standardowej entalpii reakcji. Producenci instrumentów ITC dostarczają oprogramowanie, za pomocą którego można uzyskać te wielkości z wartości danych eksperymentalnych.
Ogólna reakcja kompleksowania
Dla każdej równowagi obejmującej gospodarza H i gościa G
stała równowagi jest zdefiniowana jako
Wartości wolnych stężeń równań bilansu masy ze znanymi lub oszacowanymi stałych
Następnie stężenia każdego złożonego gatunku można również obliczyć jako . Zależność między stężeniem gatunku a zmierzoną wielkością jest specyficzna dla techniki pomiarowej, jak wskazano w każdej sekcji powyżej. Korzystając z tej zależności, zestaw parametrów, wartości stałych stabilności i wartości właściwości, takich jak absorpcja molowa lub określone przesunięcia chemiczne, można udokładnić za pomocą nieliniowego procesu udokładnienia metodą najmniejszych kwadratów . Bardziej szczegółowe omówienie tej teorii można znaleźć w sekcji Wyznaczanie stałych równowagi . Niektóre dedykowane programy komputerowe są wymienione w sekcji Implementacje .
Wyznaczanie standardowych wartości entalpii i zmian entropii
Rozważmy najpierw system, w którym roztwór zawiera pewne ilości żywiciela H i gościa G w równowadze z pojedynczym kompleksem HG .
Załóżmy teraz, że do mieszaniny żywiciela i gościa w stanie równowagi dodaje się niewielką ilość gościa. Zostanie wówczas ustalona nowa równowaga i nastąpi wydzielanie pewnej ilości ciepła Q. Gdy wielkość ta została zmierzona i skorygowana o czynniki instrumentalne, jest ona powiązana ze zmianą ilości złożonego HG obecnego w roztworze.
gdzie Δ H ⊖ jest entalpią tworzenia , znaczy entalpią tworzenia 1 mola kompleksu, HG i zmianą liczby moli gatunku HG w Δ H ⊖ rozwiązanie.
Jeśli znana jest wartość stałej równowagi wielkość można obliczyć, rozwiązując równania bilansu masowego przed i po dodaniu host – kompleks gościa , powyżej). Wówczas wartość Δ H ⊖ można otrzymać metodą liniowego dopasowania metodą najmniejszych kwadratów z szeregiem wartości doświadczalnych Q .
Jeśli wartość K nie jest znana, należy przeprowadzić nieliniowe udoskonalenie metodą najmniejszych kwadratów, aby uzyskać dwa parametry i K. { i Gdy dane są uzyskiwane za pomocą izotermicznej kalorymetrii miareczkowej, oprogramowanie wymagane do obliczeń jest dostarczane przez producenta przyrządu.
Uwaga: stosowanie równania van't Hoffa do obliczania standardowej zmiany entalpii jest przestarzałe, ponieważ wartość uzyskana tą metodą może być obarczona nadmiernym błędem .
Na ogół, gdy tworzy się m kompleksów, ciepło wytwarzane w k -tym punkcie „miareczkowania” jest sumą wkładów wynikających ze zmiany stężenia produktu reakcji.
Należy określić parametr 2m , standardową zmianę entalpii i stałą równowagi dla tworzenia każdego produktu reakcji. Producenci przyrządów ITC dostarczają kilka konkretnych produktów oprogramowania, za pomocą których można obliczyć wiele wartości parametrów. Programy komputerowe dla ogólnego przypadku, takie jak HypΔH . Dostępne są również affinimeter ITC .
Po określeniu wartości każdej standardowej zmiany entalpii i stałej równowagi, wartość odpowiedniej standardowej zmiany entropii można wyprowadzić z wyrażenia
w danej temperaturze T.
Techniki eksperymentalne
Magnetyczny rezonans jądrowy
Jądrowy rezonans magnetyczny (NMR) służy do badania kompleksacji gospodarz-gość w roztworze. Na przykład wiązanie rutenu z kaburbiturilem można zbadać na podstawie przesunięć protonów viologenu .
W wielu przypadkach zdarzenia wiązania są znacznie szybsze niż skala czasowa pozyskiwania danych, w którym to przypadku wyjściem jest uśredniony sygnał dla poszczególnych cząsteczek i kompleksu. Skala czasowa NMR jest rzędu milisekund, co w niektórych przypadkach, gdy reakcja wiązania jest szybka, ogranicza dokładność techniki.
Spektroskopia w zakresie widzialnym i ultrafiolecie
Spektroskopię w świetle widzialnym w ultrafiolecie można wykorzystać do wyjaśnienia stechiometrii i kinetyki zdarzeń wiązania, takich jak interakcja gospodarz-gość. skorzystał z tego wniosku, aby nieznacznie zmodyfikować konwencjonalny wykres Benesiego-Hilderbranda, aby uzyskać kolejność reakcji kompleksowania między chiralnym heterotrijądrowym kompleksem salenu Zn(II) zawierającym bar, zawierającym bar, heterotrijądrowym salenem (gospodarz) z różnymi gośćmi imidazolami i estrami metylowymi aminokwasów wraz z innymi parametrami. Miareczkowali oni stałe stężenie kompleksu cynku z różnymi ilościami imidazoli i estrów metylowych, jednocześnie monitorując zmiany absorbancji pasma przejściowego pi-do-pi* przy 368 nm. Dane pasują do modelu, w którym stosunek gościa do gospodarza wynosi 2 w kompleksie. Następnie przeprowadzili te eksperymenty w różnych temperaturach, co umożliwiło im obliczenie różnych parametrów termodynamicznych za pomocą równania van't Hoffa .
Izotermiczna kalorymetria miareczkowa
Techniki spektroskopowe dostarczają informacji o stałej wiązania energii swobodnej Gibbsa sol . Aby uzyskać pełny zestaw parametrów termodynamicznych, takich jak wymagana analiza van 't Hoffa przy użyciu t Hoffa . Jednak ostatnie pojawienie się technik kalorymetrycznych pozwala na pomiar i w jednym eksperymencie, umożliwiając w ten sposób określenie wszystkich parametrów termodynamicznych za pomocą równania: K za {\ Displaystyle K_ {a}}
pod warunkiem, że doświadczenie przeprowadza się w warunkach izotermicznych; stąd nazwa kalorymetria izotermiczna. Procedura jest podobna do konwencjonalnej procedury miareczkowania, w której żywiciel dodaje się sekwencyjnie do gościa i mierzy się pochłonięte lub wydzielane ciepło w porównaniu z roztworem ślepym. Całkowite uwolnione ciepło, Q , odpowiada asocjacji i przez równanie:
Co można uprościć jako
Gdzie
- = Początkowe stężenie molowe gospodarza
- = Stężenie molowe gościa
- = objętość naczynia
pomocą analizy regresji nieliniowej, aby uzyskać wartość i , a następnie i za tę konkretną reakcję. Zaletą izotermicznej kalorymetrii miareczkowej w porównaniu z innymi powszechnie stosowanymi technikami, oprócz podania całego zestawu parametrów termodynamicznych, jest to, że jest bardziej ogólna i nadaje się do szerokiego zakresu cząsteczek. Do monitorowania procesu wiązania nie jest konieczne posiadanie związków z chromoforami lub grupami funkcyjnymi widocznymi w świetle UV, ponieważ sygnał cieplny jest uniwersalną właściwością reakcji wiązania. Jednocześnie stosunek sygnału do szumu jest dość korzystny, co pozwala na dokładniejsze określenie stałych wiązania, nawet w bardzo rozcieńczonych warunkach. Niedawnym przykładem zastosowania tej techniki było badanie powinowactwa wiązania błony białkowej otaczającej Escherichia coli na kationy lipofilowe stosowane w lekach w różnych środowiskach mimetycznych błon. Motywacją do powyższego badania było to, że membrany te czynią bakterie odpornymi na większość związków opartych na czwartorzędowych kationach amoniowych , które mają działanie przeciwbakteryjne. Zatem zrozumienie zjawisk wiązania umożliwiłoby zaprojektowanie skutecznych antybiotyków dla E. coli . Naukowcy utrzymywali duży nadmiar ligandu nad białkiem, aby umożliwić zakończenie reakcji wiązania. naukowcy przystąpili do obliczenia Δ Δ i dla każdy lek w różnych środowiskach. Dane wskazywały, że stechiometria wiązania leku z membraną wynosiła 1:1 przy wartości . Ujemne wartości , i wskazywały, że proces był napędzany entalpią o wartości 8–12 kcal / mol dla każdego leku.
Współpraca
W kooperatywności początkowe wiązanie ligandu wpływa na powinowactwo gospodarza do kolejnych ligandów. W pozytywnej kooperatywności pierwsze zdarzenie wiązania zwiększa powinowactwo gospodarza do innego ligandu. Przykładami pozytywnej i negatywnej współpracy są hemoglobina i receptor asparaginianu.
W ostatnich latach badano właściwości termodynamiczne kooperatywności w celu określenia parametrów matematycznych, które odróżniają kooperatywność dodatnią lub ujemną. Tradycyjne równanie energii swobodnej Gibbsa stwierdza: . Jednak, aby określić ilościowo współpracę w systemie gospodarz-gość, należy wziąć pod uwagę energię wiązania. Schemat po prawej stronie przedstawia wiązanie A, wiązanie B, dodatnie wiązanie kooperacyjne A – B i wreszcie ujemne wiązanie kooperacyjne A – B. Dlatego byłaby alternatywna postać równania energii swobodnej Gibbsa
Gdzie:
- = energia swobodna wiązania ZA
- = energia swobodna wiązania B
- = energia swobodna wiązania dla A i B na uwięzi
- = suma swobodnych energii wiązania
Uważa się, że jeśli \ A } ^ { jest pozytywnie współpracujący. ∘ {\ Displaystyle \ jest mniejsza, to jest ujemnie współpracująca. Chemia gospodarz-gość nie ogranicza się do interakcji receptor-lingand. Jest to również wykazane w systemach parowania jonów. W ostatnich latach takie interakcje są badane w ośrodkach wodnych z wykorzystaniem syntetycznych gospodarzy metaloorganicznych i organicznych cząsteczek gości. Na przykład receptor polikationowy zawierający miedź (gospodarz) jest skoordynowany z cząsteczkami takimi jak tetrakarboksylany, trikarbolan, asparaginian i octan (goście). To badanie ilustruje tę entropię , a nie entalpię określa energię wiązania układu prowadzącą do ujemnej kooperatywności. Duża zmiana entropii pochodzi z przemieszczenia cząsteczek rozpuszczalnika otaczających ligand i receptor. Gdy wiele octanów wiąże się z receptorem, uwalnia do środowiska więcej cząsteczek wody niż tetrakarboksylan. Doprowadziło to do spadku energii swobodnej, co sugeruje, że system współpracuje negatywnie. W podobnym badaniu, wykorzystującym gości guanidyny i Cu (II) oraz polikarboksylanów, wykazano, że pozytywne współdziałanie jest w dużej mierze determinowane przez entalpię. Oprócz badań termodynamicznych chemia gospodarz-gość ma również zastosowania biologiczne.
Aplikacje
Wyczuwanie
Tradycyjnie do wykrywania chemicznego stosowano system, który zawiera kowalencyjnie związany wskaźnik z receptorem przez łącznik. Gdy analit się zwiąże, wskaźnik zmienia kolor lub zaczyna fluoryzować. Ta technika nazywa się podejściem wskaźnik-przerywnik-receptor (ISR). W przeciwieństwie do ISR, test przemieszczenia wskaźnika (IDA) wykorzystuje niekowalencyjne oddziaływanie między receptorem (gospodarzem), wskaźnikiem i analitem (gościem). Podobnie jak ISR, IDA wykorzystuje również wskaźniki kolorymetryczne (C-IDA) i fluorescencyjne (F-IDA). W teście IDA receptor inkubuje się ze wskaźnikiem. Po dodaniu analitu do mieszaniny wskaźnik jest uwalniany do środowiska. Gdy wskaźnik zostanie uwolniony, zmienia kolor (C-IDA) lub fluoryzuje (F-IDA).
IDA oferuje kilka zalet w porównaniu z tradycyjnym podejściem do wykrywania chemicznego ISR. Po pierwsze, nie wymaga kowalencyjnego wiązania wskaźnika z receptorem. Po drugie, ponieważ nie ma wiązania kowalencyjnego, z tym samym receptorem można stosować różne wskaźniki. Wreszcie, podłoża, w których można zastosować test, są zróżnicowane.
Techniki wykrywania chemicznego, takie jak C-IDA, mają implikacje biologiczne. Na przykład protamina jest koagulantem, który jest rutynowo podawany po operacjach krążeniowo-oddechowych, który przeciwdziała antykoagulacyjnemu działaniu herapiny. W celu ilościowego oznaczenia protaminy w próbkach osocza stosuje się kolorymetryczny test przemieszczenia. Błękit Barwnik jest niebieski, gdy jest niezwiązany, ale gdy jest związany z herapiną, ma kolor fioletowy. Wiązanie między Azure A i heparyną jest słabe i odwracalne. Pozwala to protaminie na wyparcie Azure A. Po uwolnieniu barwnika pojawia się fioletowy kolor. Stopień wyparcia barwnika jest proporcjonalny do ilości protaminy w osoczu.
F-IDA została wykorzystana przez Kwalczykowskiego i współpracowników do monitorowania aktywności helikazy w E.coli . W tym badaniu użyli oranżu tiazolowego jako wskaźnika. Helikaza rozwija dsDNA, tworząc ssDNA. Intensywność fluorescencji oranżu tiazolowego ma większe powinowactwo do dsDNA niż ssDNA, a intensywność fluorescencji wzrasta, gdy jest on związany z dsDNA, niż gdy jest niezwiązany.
Przełączanie konformacyjne
Krystaliczne ciało stałe było tradycyjnie postrzegane jako byt statyczny, w którym ruchy jego składników atomowych są ograniczone do jego równowagi wibracyjnej. Jak widać z przemiany grafitu w diament, przemiana ciała stałego w ciało stałe może zachodzić pod wpływem ciśnienia fizycznego lub chemicznego. Niedawno zaproponowano, że transformacja z jednego układu kryształów do drugiego zachodzi w sposób kooperacyjny. Większość z tych badań koncentrowała się na badaniu struktury organicznej lub metaloorganicznej. Oprócz badań makrocząsteczkowych przemian krystalicznych prowadzone są również badania cząsteczek monokrystalicznych, które mogą zmieniać swoją konformację w obecności rozpuszczalników organicznych. Wykazano, że kompleks metaloorganiczny zmienia się w różne orientacje w zależności od tego, czy jest wystawiony na działanie oparów rozpuszczalnika, czy nie.
Zastosowania środowiskowe
Systemy hosta-gościa zostały wykorzystane do usunięcia niebezpiecznych materiałów ze środowiska. Mogą być wykonane w różnych rozmiarach i różnych kształtach, aby uwięzić różnych chemicznych gości. Jednym z zastosowań jest zdolność p-tert-butykaliksu [4] arenu do wychwytywania jonów cezu. Cez-137 jest radioaktywny i istnieje potrzeba skutecznego usuwania go z odpadów promieniotwórczych. Chemia gospodarz-gość została również wykorzystana do usunięcia rakotwórczych amin aromatycznych i ich N-nitrozopochodnych z wody. Te odpady są wykorzystywane w wielu procesach przemysłowych i znajdują się w różnych produktach, takich jak: pestycydy, leki i kosmetyki.


![{\displaystyle K_{a}^{\ominus }={\frac {\{HG\}}{\{H\}\{G\}}}={\frac {[HG]}{[H][G]}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)

![{\displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)
![{\displaystyle K_{a}={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\displaystyle K={\frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\displaystyle T_{H}=[H]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\displaystyle T_{G}=[G]+K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\displaystyle [H]=T_{H}-T_{G}+[G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\displaystyle [HG]=K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)




















![{\displaystyle \beta _{pq}={\frac {[H_{p}G_{q}]}{[H]^{p}[G]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\displaystyle T_{H}=[H]+\sum p\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\displaystyle T_{G}=[G]+\sum q\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\displaystyle [H_{p}G_{q}]=\beta _{pq}[H]^{p}[G]^{q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)













![{\displaystyle Q={V\Delta H_{0}[H.G]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\displaystyle Q={\frac {V\Delta H_{0}K_{a}[H_{0}][G]}{1+K_{a}[G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\displaystyle [H_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)











