Chlorek tris(etylenodiamino)kobaltu(III).

|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
nazwa IUPAC
chlorek tris(etylenodiaminy) kobaltu
|
|||
| Inne nazwy chlorek tris(etylenodiamino)kobaltu(III).
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|
||
| ChemSpider | |||
|
Identyfikator klienta PubChem
|
|||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
||
|
|||
|
|||
| Nieruchomości | |||
| C6H24N6Cl3 Co _ _ _ _ _ _ _ | |||
| Masa cząsteczkowa | 345,59 | ||
| Wygląd | żółto-pomarańczowe ciało stałe | ||
| Temperatura topnienia | 275 ° C (527 ° F; 548 K) (rozkłada się) | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|||
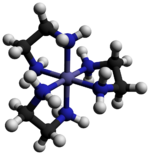
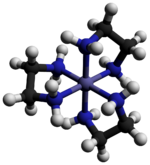
Chlorek tris(etylenodiaminy)kobaltu(III) jest związkiem nieorganicznym o wzorze [Co(en) 3 ]Cl 3 (gdzie „en” to skrót oznaczający etylenodiaminę ). Jest to sól chlorkowa kompleksu koordynacyjnego [Co(en) 3 ] 3+ . Ta trikacja była ważna w historii chemii koordynacyjnej ze względu na jej stabilność i stereochemię . Opisano wiele różnych soli. Kompleks został po raz pierwszy opisany przez Alfreda Wernera który wyizolował tę sól w postaci żółto-złotych igiełkowatych kryształów.
Synteza i struktura
Związek jest przygotowywany z wodnego roztworu etylenodiaminy i praktycznie dowolnej soli kobaltu (II), takiej jak chlorek kobaltu (II) . Roztwór przedmuchuje się powietrzem w celu utlenienia kompleksów kobaltu(II)-etylenodiaminy do kobaltu(III). Reakcja przebiega z wydajnością 95%, a trikation można wydzielić za pomocą różnych anionów. Szczegółowa analiza produktu syntezy na dużą skalę wykazała, że jednym z drugorzędnych produktów ubocznych był [Co(en) 2 Cl(H 2 NCH 2 CH 2 NH 3 )]Cl 3 , który zawiera rzadki jednokleszczowy ligand etylenodiaminy (protonowany).
Kation [Co(en) 3 ] 3+ jest oktaedryczny z odległościami Co-N w zakresie 1,947–1,981 Å . Kąty N-Co-N wynoszą 85° w pierścieniach chelatowych i 90° między atomami azotu w sąsiednich pierścieniach.
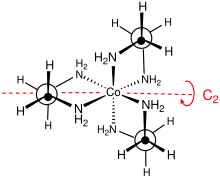
Stereochemia
Grupa punktowa tego kompleksu to D 3 . Kompleks można rozłożyć na enancjomery , które są opisane jako Δ i Λ. Zwykle rozdzielczość wymaga zastosowania winianowych . Rozdzielczość optyczna jest standardowym elementem kursów syntezy nieorganicznej. Ze względu na swoją nieplanarność pierścienie MN 2 C 2 mogą przyjąć jedną z dwóch konformacji , które są opisane symbolami λ i δ. Rejestracja między tymi konformacjami pierścienia a absolutną konfiguracją centrów metali jest opisana przez nazewnictwo lel (kiedy szkielet en leży równolegle do osi symetrii C3) lub ob (kiedy szkielet en jest przeciwny do tej samej osi C3 ) . W ten sposób można zidentyfikować następujące konformacje diastereomeryczne : Δ-( lel ) 3 , Δ-(lel) 2 (ob), Δ-(lel)(ob) 2 i Δ-( ob ) 3 . Oczywiście istnieją również lustrzane odbicia tych gatunków.
Nawilża
Kationowe kompleksy koordynacyjne amoniaku i alkiloamin zwykle krystalizują z wodą w sieci krystalicznej , a stechiometria może zależeć od warunków krystalizacji oraz, w przypadku kompleksów chiralnych, od optycznej czystości kationu. Racemiczny [Co(en) 3 ]Cl 3 najczęściej otrzymuje się w postaci di- lub trihydratu. Dla optycznie czystej soli (+)-[Co(en) 3 ]Cl 3 ·1,5H 2O , (+)-[Co(en) 3 ]Cl 3 ·0,5NaCl·3H 2O oraz (+)- [Co(pl) 3 ]Cl3 · H2O są również znane.