Cyfrowa reakcja łańcuchowa polimerazy
Cyfrowa reakcja łańcuchowa polimerazy ( digital PCR , DigitalPCR , dPCR lub dePCR ) to biotechnologiczne udoskonalenie konwencjonalnych metod reakcji łańcuchowej polimerazy , które można wykorzystać do bezpośredniego oznaczania ilościowego i klonowania nici kwasów nukleinowych, w tym DNA , cDNA lub RNA . Kluczowa różnica między dPCR a tradycyjnym PCR polega na metodzie pomiaru ilości kwasów nukleinowych, przy czym ta pierwsza metoda jest bardziej precyzyjna niż PCR, choć także bardziej podatna na błędy w rękach niedoświadczonych użytkowników. Pomiar „cyfrowy” mierzy ilościowo i dyskretnie pewną zmienną, podczas gdy pomiar „analogowy” ekstrapoluje pewne pomiary na podstawie zmierzonych wzorców. PCR przeprowadza jedną reakcję na pojedynczą próbkę. dPCR przeprowadza również pojedynczą reakcję w próbce, jednak próbka jest dzielona na dużą liczbę partycji, a reakcja jest przeprowadzana w każdej partycji osobno. Ta separacja umożliwia bardziej wiarygodne zbieranie i czuły pomiar ilości kwasu nukleinowego. Wykazano, że metoda ta jest przydatna do badania zmian w sekwencjach genów — takich jak warianty liczby kopii i mutacje punktowe — i jest rutynowo stosowana do klonalnej amplifikacji próbek do sekwencjonowania nowej generacji .
Zasady
Metoda reakcji łańcuchowej polimerazy jest stosowana do ilościowego oznaczania kwasów nukleinowych poprzez amplifikację cząsteczki kwasu nukleinowego za pomocą enzymu polimerazy DNA . Konwencjonalny PCR opiera się na teorii, że amplifikacja jest wykładnicza. W związku z tym kwasy nukleinowe można określić ilościowo, porównując liczbę cykli amplifikacji i ilość produktu końcowego PCR z próbką referencyjną. Jednak wiele czynników komplikuje te obliczenia, powodując niepewność i nieścisłości. Czynniki te obejmują: początkowe cykle amplifikacji mogą nie być wykładnicze; Amplifikacja PCR ostatecznie osiąga plateau po niepewnej liczbie cykli; a niskie początkowe stężenia docelowych cząsteczek kwasu nukleinowego mogą nie ulec amplifikacji do wykrywalnych poziomów. Jednak najbardziej znaczącym ograniczeniem PCR jest to, że wydajność amplifikacji PCR w próbce będącej przedmiotem zainteresowania może być inna niż w przypadku próbek referencyjnych.
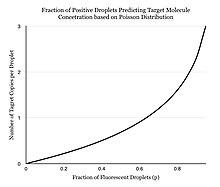
Zamiast przeprowadzać jedną reakcję na studzienkę, dPCR polega na podzieleniu roztworu PCR na dziesiątki tysięcy nanolitrowych kropelek, z których w każdej z nich zachodzi oddzielna reakcja PCR. Roztwór PCR przygotowuje się podobnie do TaqMan , który składa się z matrycy DNA (lub RNA), sond wygaszających fluorescencję, starterów i mieszaniny głównej PCR , która zawiera polimerazę DNA , dNTP , MgCl2 i bufory reakcyjne w optymalnych stężeniach . Do rozdzielania próbek można zastosować kilka różnych metod, w tym płytki z mikrostudzienkami, kapilary, emulsje olejowe i macierze zminiaturyzowanych komór z powierzchniami wiążącymi kwasy nukleinowe. Roztwór PCR jest dzielony na mniejsze reakcje, a następnie przygotowywany do indywidualnej reakcji PCR. Po wielu cyklach amplifikacji PCR próbki są sprawdzane pod kątem fluorescencji z binarnym odczytem „0” lub „1”. Rejestruje się frakcję fluoryzujących kropelek. Podział próbki pozwala oszacować liczbę różnych cząsteczek przy założeniu, że populacja cząsteczek jest zgodna z rozkładem Poissona , co uwzględnia możliwość zamieszkiwania wielu cząsteczek docelowych w jednej kropli. Korzystając z prawa małych liczb Poissona, rozkład docelowej cząsteczki w próbce można dokładnie przybliżyć, co pozwala na ilościową ocenę docelowej nici w produkcie PCR. Ten model po prostu przewiduje, że wraz ze wzrostem liczby próbek zawierających co najmniej jedną cząsteczkę docelową wzrasta prawdopodobieństwo, że próbki zawierają więcej niż jedną cząsteczkę docelową. W konwencjonalnym PCR liczba cykli amplifikacji PCR jest proporcjonalna do początkowej liczby kopii. W odróżnieniu od przekonania wielu ludzi, że dPCR zapewnia bezwzględną kwantyfikację, cyfrowa PCR wykorzystuje moc statystyczną, aby zapewnić względną kwantyfikację. Na przykład, jeśli Próbka A, gdy jest testowana na 1 milion partycji, daje jedną pozytywną reakcję, nie oznacza to, że Próbka A ma jedną cząsteczkę wyjściową. [ potrzebne źródło ]
Korzyści dPCR obejmują zwiększoną precyzję dzięki masowemu podziałowi próbki, co zapewnia wiarygodne pomiary w pożądanej sekwencji DNA dzięki powtarzalności. Poziomy błędów są większe przy wykrywaniu niewielkich różnic w zmianach za pomocą podstawowego PCR, podczas gdy poziomy błędów są mniejsze w przypadku dPCR ze względu na mniejsze różnice w zmianach, które można wykryć w sekwencji DNA. Sama technika ogranicza zużycie większej ilości potrzebnego odczynnika, co nieuchronnie obniży koszty eksperymentu. Ponadto dPCR jest wysoce ilościowy, ponieważ nie opiera się na względnej fluorescencji roztworu w celu określenia ilości zamplifikowanego docelowego DNA.
Porównanie dPCR i PCR w czasie rzeczywistym (qPCR)
dPCR mierzy rzeczywistą liczbę cząsteczek (docelowego DNA), ponieważ każda cząsteczka znajduje się w jednej kropli, dzięki czemu jest to dyskretny pomiar „cyfrowy”. Zapewnia bezwzględną ocenę ilościową, ponieważ dPCR mierzy dodatnią frakcję próbek, czyli liczbę kropelek, które wykazują fluorescencję w wyniku prawidłowej amplifikacji. Ta dodatnia frakcja dokładnie wskazuje początkową ilość matrycowego kwasu nukleinowego. Podobnie qPCR wykorzystuje fluorescencję; jednakże mierzy intensywność fluorescencji w określonych momentach (zwykle po każdym cyklu amplifikacji) w celu określenia względnej ilości cząsteczki docelowej (DNA), ale nie może określić dokładnej ilości bez skonstruowania krzywej wzorcowej przy użyciu różnych ilości określonego wzorca. Daje próg na cykl (CT), a różnica w CT jest wykorzystywana do obliczenia ilości początkowego kwasu nukleinowego. Jako taki, qPCR jest pomiarem analogowym, który może nie być tak precyzyjny ze względu na ekstrapolację wymaganą do uzyskania pomiaru.
dPCR mierzy ilość DNA po zakończeniu amplifikacji, a następnie określa frakcję powtórzeń. Jest to reprezentatywne dla pomiaru punktu końcowego, ponieważ wymaga obserwacji danych po zakończeniu eksperymentu. Natomiast qPCR rejestruje względną fluorescencję DNA w określonych punktach podczas procesu amplifikacji, co wymaga przerw w procesie eksperymentalnym. Ten aspekt qPCR „w czasie rzeczywistym” może teoretycznie wpłynąć na wyniki z powodu zatrzymania eksperymentu. [ potrzebne źródło ] W praktyce jednak większość termocyklerów qPCR bardzo szybko odczytuje fluorescencję każdej próbki na końcu etapu wyżarzania/wydłużenia przed przejściem do następnego etapu topienia, co oznacza, że ta hipotetyczna obawa nie jest w rzeczywistości istotna ani odpowiednia dla zdecydowanej większości naukowców. dPCR mierzy amplifikację poprzez pomiar produktów cyklu PCR w punkcie końcowym i dlatego jest mniej podatny na artefakty wynikające z upośledzonej wydajności amplifikacji z powodu obecności inhibitorów PCR lub niedopasowania matrycy starterów.
qPCR nie jest w stanie rozróżnić różnic w ekspresji genów lub zmian liczby kopii, które są mniejsze niż dwukrotne. Z drugiej strony dPCR ma wyższą precyzję i wykazano, że wykrywa różnice w ekspresji genów mniejsze niż 30%, rozróżnia odmiany liczby kopii, które różnią się tylko o 1 kopię, i identyfikuje allele, które występują z częstotliwościami mniejszymi niż 0,1%.
Aplikacje
Cyfrowy PCR ma wiele zastosowań w badaniach podstawowych , diagnostyce klinicznej i badaniach środowiskowych. Jego zastosowania obejmują patogenów i analizę zdrowia układu pokarmowego ; płynna biopsja do monitorowania nowotworów , monitorowanie odrzucania przeszczepów narządów i nieinwazyjne badania prenatalne pod kątem poważnych nieprawidłowości genetycznych ; analiza zmienności liczby kopii , analiza ekspresji pojedynczych genów, wykrywanie rzadkich sekwencji, profilowanie ekspresji genów i analiza pojedynczych komórek ; wykrywanie DNA w procesach biologicznych, walidacja edycji genów i wykrywanie specyficznych zmian metylacji w DNA jako biomarkerów nowotworów . dPCR jest również często stosowana jako metoda ortogonalna do potwierdzania rzadkich mutacji wykrytych za pomocą sekwencjonowania nowej generacji (NGS) oraz do walidacji bibliotek NGS .
Kwantyfikacja bezwzględna
dPCR umożliwia bezwzględną i powtarzalną ocenę ilościową docelowych kwasów nukleinowych z rozdzielczością pojedynczych cząsteczek. Jednak w przeciwieństwie do analogowej ilościowej PCR (qPCR), bezwzględna ocena ilościowa za pomocą dPCR nie wymaga krzywej wzorcowej ). dPCR ma również większą tolerancję na substancje hamujące i testy PCR, które amplifikują nieefektywnie w porównaniu z qPCR.
dPCR może określić ilościowo, na przykład, obecność określonych sekwencji pochodzących z zanieczyszczających genetycznie zmodyfikowanych organizmów w artykułach spożywczych, miano wirusa we krwi, PBMC , próbki surowicy, tkanki kosmków kosmówki, biomarkery chorób neurodegeneracyjnych w płynie mózgowo-rdzeniowym oraz zanieczyszczenie kałem wody pitnej .
Kopiuj odmianę numeru
Zmiana stanu liczby kopii w odniesieniu do locus referencyjnego pojedynczej kopii jest określana jako „ zmiana liczby kopii ” (CNV), jeśli pojawia się w komórkach linii zarodkowej, lub zmiana liczby kopii (CNA), jeśli pojawia się w komórkach somatycznych. CNV lub CNA może być spowodowane delecją lub amplifikacją locus w odniesieniu do liczby kopii locus referencyjnego obecnego w komórce i razem są głównymi czynnikami przyczyniającymi się do zmienności ludzkiego genomu . Zostały one powiązane z nowotworami; choroby neurologiczne, psychiatryczne i autoimmunologiczne; i niepożądane reakcje na leki. Jednak trudno jest zmierzyć te zmiany alleliczne z dużą precyzją przy użyciu innych metod, takich jak qPCR, co utrudnia powiązania fenotypowe i chorobowe ze zmienionym stanem CNV.
Duża liczba „zdigitalizowanych” pomiarów punktów końcowych, które są możliwe dzięki podziałowi próbek, umożliwia dPCR rozwiązywanie niewielkich różnic w liczbie kopii z lepszą dokładnością i precyzją w porównaniu z innymi metodami, takimi jak mikromacierze oparte na SNP lub qPCR. qPCR ma ograniczone możliwości precyzyjnego ilościowego określania amplifikacji genów w kilku chorobach, w tym w chorobie Leśniowskiego-Crohna, zakażeniu HIV-1 i otyłości.
dPCR zaprojektowano do pomiaru stężenia docelowego kwasu nukleinowego w kopiach na jednostkę objętości próbki. Podczas pracy w rozcieńczonych reakcjach, w których mniej niż ~10% partycji zawiera pożądany cel (określane jako „ograniczone rozcieńczenie”), liczbę kopii można oszacować, porównując liczbę kropelek fluorescencyjnych powstających z docelowej CNV z liczbą fluorescencyjnych kropelek kropelki powstające z niezmiennego locus referencyjnego pojedynczej kopii. W rzeczywistości, zarówno przy tych niższych stężeniach docelowych, jak i przy wyższych, gdzie wiele kopii tego samego celu może znajdować się w jednej partycji, statystyki Poissona są wykorzystywane do korygowania tych wielokrotnych zajętości, aby uzyskać dokładniejszą wartość dla każdego stężenia docelowego.
Cyfrowy PCR został wykorzystany do odkrycia zmienności płciowej i somatycznej w liczbie kopii genów między ludźmi oraz do zbadania związku między amplifikacją HER2 (ERBB2) a progresją raka piersi .
Rzadkie wykrywanie mutacji i rzadkich alleli
Podział w cyfrowym PCR zwiększa czułość i umożliwia wykrywanie rzadkich zdarzeń, zwłaszcza wariantów pojedynczych nukleotydów (SNV), poprzez izolację lub znaczne zmniejszenie sygnału docelowego biomarkera z potencjalnie konkurencyjnego tła. Zdarzenia te można podzielić na dwie klasy: wykrywanie rzadkich mutacji i wykrywanie rzadkich sekwencji.
Wykrywanie rzadkich mutacji
Wykrywanie rzadkich mutacji ma miejsce, gdy biomarker istnieje na tle bardzo licznego odpowiednika, który różni się tylko jednym wariantem nukleotydu (SNV). Wykazano, że cyfrowy PCR jest w stanie wykryć zmutowany DNA w obecności 200 000-krotnego nadmiaru tła typu dzikiego , co jest 2000 razy bardziej czułe niż osiągalne przy użyciu konwencjonalnego qPCR.
Wykrywanie rzadkich sekwencji
Cyfrowy PCR może wykrywać rzadkie sekwencje, takie jak DNA HIV u pacjentów z HIV oraz DNA bakterii kałowych w oceanach i innych próbkach wody w celu oceny jakości wody. dPCR może wykryć sekwencje tak rzadkie jak 1 na 1 250 000 komórek.
Płynna biopsja
Zdolność dPCR do wykrywania rzadkich mutacji może być szczególnie korzystna w klinice dzięki zastosowaniu płynnej biopsji , ogólnie nieinwazyjnej strategii wykrywania i monitorowania choroby za pomocą płynów ustrojowych. Naukowcy wykorzystali płynną biopsję do monitorowania obciążenia guza, odpowiedzi na leczenie i postępu choroby u z rakiem , mierząc rzadkie mutacje w krążącym DNA nowotworu (ctDNA) w różnych płynach biologicznych pochodzących od pacjentów, w tym we krwi , moczu i płynie mózgowo-rdzeniowym . Wczesne wykrycie ctDNA (podobnie jak w przypadku nawrotu molekularnego ) może prowadzić do wcześniejszego zastosowania immunoterapii lub terapii celowanej swoistej dla sygnatury mutacji pacjenta, potencjalnie zwiększając szanse na skuteczność leczenia zamiast czekania na kliniczny nawrót choroby przed zmianą leczenia. Czas realizacji biopsji płynnych może wynosić kilka dni, w porównaniu do dwóch do czterech tygodni lub dłużej w przypadku testów tkankowych. Ten skrócony czas uzyskania wyników został wykorzystany przez lekarzy do przyspieszenia leczenia dostosowanego do biopsji .
W 2016 r. prospektywne badanie z użyciem metody dPCR przeprowadzone w Dana-Farber Cancer Institute potwierdziło kliniczną korzyść płynnej biopsji jako predykcyjnego narzędzia diagnostycznego dla pacjentów z niedrobnokomórkowym rakiem płuca . Zastosowanie płynnych testów biopsyjnych badano również u pacjentów z rakiem piersi , jelita grubego , ginekologicznym i pęcherza moczowego w celu monitorowania zarówno obciążenia chorobą, jak i odpowiedzi guza na leczenie.
Ekspresja genów i kwantyfikacja RNA
Ekspresja genów i badania ilościowe RNA odniosły korzyści ze zwiększonej precyzji i bezwzględnej oceny ilościowej dPCR. Oznaczenie ilościowe RNA można przeprowadzić za pomocą RT-PCR , w którym RNA poddaje się odwrotnej transkrypcji do cDNA w samej reakcji podziału, a liczbę cząsteczek RNA pochodzących z każdego transkryptu (lub transkryptu allelicznego) określa się ilościowo za pomocą dPCR.
Często można osiągnąć większą czułość i precyzję, stosując dPCR zamiast qPCR do ilościowego określania cząsteczek RNA, po części dlatego, że nie wymaga to użycia krzywej standardowej do oznaczania ilościowego. dPCR jest również bardziej odporny na inhibitory PCR do ilościowego oznaczania RNA niż qPCR.
dPCR może wykryć i określić ilościowo więcej pojedynczych gatunków docelowych na kanał detekcji niż qPCR dzięki możliwości rozróżnienia celów na podstawie ich różnicowej amplitudy fluorescencji lub dzięki zastosowaniu charakterystycznych kombinacji kolorów do ich wykrywania. Jako przykład zastosowano 2-kanałowy system dPCR do wykrycia w pojedynczej studzience ekspresji czterech różnych wariantów splicingu ludzkiej odwrotnej transkryptazy telomerazy , białka, które jest bardziej aktywne w większości komórek nowotworowych niż w zdrowych komórkach.
Alternatywne zastosowania partycjonowania
Wykorzystując możliwości dynamicznego podziału stosowane w dPCR, można uzyskać ulepszone sekwencjonowanie NGS poprzez podział złożonych reakcji PCR przed amplifikacją, aby uzyskać bardziej jednolitą amplifikację w wielu różnych amplikonach do analizy NGS . Ponadto wykazano, że ulepszona specyficzność złożonych reakcji amplifikacji PCR w kropelkach znacznie zmniejsza liczbę iteracji wymaganych do selekcji aptamerów o wysokim powinowactwie w metodzie SELEX . Podział może również pozwolić na bardziej wiarygodne pomiary aktywności telomerazy z lizatów komórkowych. Możliwości dynamicznego podziału dPCR można również wykorzystać do podziału tysięcy jąder lub całych komórek na pojedyncze kropelki, aby ułatwić przygotowanie biblioteki do testu pojedynczej komórki pod kątem chromatyny dostępnej dla transpozazy przy użyciu sekwencjonowania (scATAC-seq).
Kroplowy cyfrowy PCR
Droplet Digital PCR (ddPCR) to metoda dPCR, w której 20-mikrolitrowa próbka reakcyjna zawierająca startery testowe i sondy Taqman lub barwnik interkalujący jest dzielona na około 20 000 kropelek oleju wielkości nanolitra za pomocą techniki emulsji woda-olej, poddawana termocyklingowi do punkt końcowy w 96-dołkowej płytce do PCR i odczyt amplitudy fluorescencji dla wszystkich kropelek w każdym dołku próbki w kropelkowym cytometrze przepływowym.
Cyfrowy PCR oparty na chipie
Chip-based Digital PCR (dPCR) to również metoda dPCR, w której mieszanina reakcyjna (również stosowana w qPCR) jest dzielona na ~10 000 do ~45 000 partycji na chipie, a następnie amplifikowana za pomocą maszyny do termocyklingu punktu końcowego PCR i jest odczytać za pomocą czytnika kamery o dużej mocy z filtrem fluorescencyjnym (HEX, FAM, Cy5, Cy5.5 i Texas Red) dla wszystkich partycji na każdym chipie.
Historia
dPCR wywodzi się z podejścia opublikowanego po raz pierwszy w 1988 roku przez Cetus Corporation , kiedy naukowcy wykazali, że pojedyncza kopia genu β-globiny może zostać wykryta i zamplifikowana metodą PCR. Osiągnięto to przez rozcieńczanie próbek DNA z normalnej linii komórkowej człowieka DNA z linii zmutowanej mającej homozygotyczną delecję genu β-globiny, aż nie był on już obecny w reakcji. W 1989 roku Peter Simmonds, AJ Brown i in. użył tej koncepcji do ilościowego określenia cząsteczki po raz pierwszy. Alex Morley i Pamela Sykes formalnie ustanowili tę metodę jako technikę ilościową w 1992 roku.
W 1999 roku Bert Vogelstein i Kenneth Kinzler ukuli termin „cyfrowy PCR” i wykazali, że technika ta może być wykorzystana do znalezienia rzadkich mutacji nowotworowych. Jednak dPCR było trudne do wykonania; było to pracochłonne, wymagało wielu szkoleń, aby wykonać je prawidłowo i było trudne do wykonania w dużych ilościach. W 2003 roku Kinzler i Vogelstein kontynuowali udoskonalanie dPCR i stworzyli ulepszoną metodę, którą nazwali BEAMing , co jest skrótem od „beads, emulsion, amplifikacja i magnetyzm”. Nowy protokół wykorzystywał emulsję do podziału reakcji amplifikacji w jednej probówce. Ta zmiana umożliwiła naukowcom skalowanie metody do tysięcy reakcji w jednym przebiegu.
Firmy opracowujące komercyjne systemy dPCR mają zintegrowane technologie, takie jak automatyczne dzielenie próbek, cyfrowe zliczanie docelowych kwasów nukleinowych i zwiększanie liczby kropel, które mogą pomóc w zwiększeniu wydajności procesu. W ostatnich latach naukowcy opracowali i skomercjalizowali diagnostykę opartą na dPCR dla kilku schorzeń, w tym niedrobnokomórkowego raka płuc i zespołu Downa . Pierwszy system dPCR do użytku klinicznego został oznaczony znakiem CE w 2017 r. i zatwierdzony przez amerykańską Agencję ds. Żywności i Leków w 2019 r. do diagnozowania przewlekłej białaczki szpikowej .