Analiza pojedynczej komórki
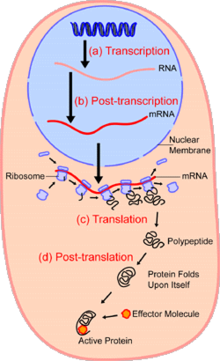
W dziedzinie biologii komórkowej analiza pojedynczych komórek to badanie genomiki , transkryptomiki , proteomiki , metabolomiki i interakcji między komórkami na poziomie pojedynczej komórki. Koncepcja analizy pojedynczych komórek powstała w latach 70. XX wieku. Przed odkryciem heterogeniczności analiza pojedynczych komórek odnosiła się głównie do analizy lub manipulacji pojedynczą komórką w masowej populacji komórek w określonych warunkach przy użyciu mikroskopu optycznego lub elektronicznego. Do tej pory, ze względu na heterogeniczność obserwowaną zarówno w populacjach komórek eukariotycznych, jak i prokariotycznych, analiza pojedynczej komórki umożliwia odkrycie mechanizmów nieobserwowanych podczas badania masowej populacji komórek. Technologie takie jak sortowanie komórek aktywowane fluorescencją (FACS) umożliwia precyzyjną izolację wybranych pojedynczych komórek ze złożonych próbek, podczas gdy wysokowydajne technologie podziału pojedynczych komórek umożliwiają jednoczesną analizę molekularną setek lub tysięcy pojedynczych nieposortowanych komórek; jest to szczególnie przydatne do analizy zmienności transkryptomu w komórkach identycznych genotypowo, umożliwiając zdefiniowanie niewykrywalnych w inny sposób podtypów komórek. Rozwój nowych technologii zwiększa nasze możliwości analizy genomu i transkryptomu pojedynczych komórek, a także ilościowego określania ich proteomu i metabolomu . Techniki spektrometrii mas stały się ważnymi narzędziami analitycznymi do analizy proteomicznej i metabolomicznej pojedynczych komórek. Ostatnie postępy umożliwiły ilościowe określenie tysięcy białek w setkach pojedynczych komórek, a tym samym umożliwiły nowe typy analiz. Sekwencjonowanie in situ i fluorescencyjna hybrydyzacja in situ (FISH) nie wymagają izolowania komórek i są coraz częściej wykorzystywane do analizy tkanek.
Izolacja jednokomórkowa
Wiele technik analizy pojedynczych komórek wymaga izolacji poszczególnych komórek. Metody stosowane obecnie do izolacji pojedynczych komórek obejmują: cyfrowe sortowanie dielektroforetyczne, trawienie enzymatyczne, FACS , pułapki hydrodynamiczne, mikrodysekcję z przechwytywaniem laserowym , ręczne zbieranie, mikroprzepływy , mikromanipulacja , seryjne rozcieńczanie i pęsety ramanowskie.
Ręczne pobieranie pojedynczych komórek to metoda, w której komórki w zawiesinie są oglądane pod mikroskopem i indywidualnie zbierane za pomocą mikropipety . Pęseta ramanowska to technika, w której spektroskopia ramanowska jest połączona z pęsetą optyczną , która wykorzystuje wiązkę laserową do pułapkowania i manipulowania komórkami.
Cyfrowa metoda sortowania metodą dielektroforetyczną wykorzystuje sterowany półprzewodnikowo układ elektrod w chipie mikroprzepływowym do wychwytywania pojedynczych komórek w klatkach dielektroforetycznych (DEP). Identyfikację komórek zapewnia połączenie markerów fluorescencyjnych z obserwacją obrazu. Precyzyjne podawanie jest zapewnione przez kontrolowany półprzewodnikowo ruch klatek DEP w celi przepływowej.
Rozwój biochipów mikroprzepływowych opartych na hydrodynamice wzrasta z biegiem lat. W tej technice komórki lub cząstki są uwięzione w określonym regionie w celu analizy pojedynczej komórki (SCA), zwykle bez stosowania zewnętrznych pól siłowych, takich jak optyczne, elektryczne, magnetyczne lub akustyczne. Istnieje potrzeba zbadania spostrzeżeń SCA w naturalnym stanie komórki, a rozwój tych technik jest bardzo ważny dla tych badań. Badacze zwrócili uwagę na ogromny potencjał, który należy zbadać, aby opracować urządzenia biochipowe spełniające wymagania rynku/badaczy. Mikroprzepływy hydrodynamiczne ułatwiają opracowywanie pasywnych aplikacji typu lab-on-chip. Najnowszy przegląd przedstawia najnowsze postępy w tej dziedzinie, wraz z ich mechanizmami, metodami i zastosowaniami.
Powiązane technologie
Cyfrowa metoda sortowania dielektroforetycznego wykorzystuje sterowany półprzewodnikowo układ elektrod w chipie mikroprzepływowym do wychwytywania pojedynczych komórek w klatkach dielektroforetycznych (DEP). Identyfikację komórek zapewnia połączenie markerów fluorescencyjnych z obserwacją obrazu. Precyzyjne podawanie jest zapewnione przez kontrolowany półprzewodnikowo ruch klatek DEP w celi przepływowej.
Pułapki hydrodynamiczne pozwalają na izolację pojedynczej komórki w „pułapce” w jednym określonym czasie poprzez pasywny transport mikroprzepływowy. Liczbą izolowanych komórek można manipulować w oparciu o liczbę pułapek w systemie.
Technika Laser Capture Microdissection wykorzystuje laser do preparowania i oddzielania pojedynczych komórek lub skrawków z próbek tkanek będących przedmiotem zainteresowania. Metody obejmują obserwację komórki pod mikroskopem, aby można było zidentyfikować i oznaczyć fragment do analizy, aby laser mógł przeciąć komórkę. Następnie komórkę można pobrać do analizy.
Ręczne pobieranie pojedynczych komórek to metoda, w której komórki w zawiesinie są oglądane pod mikroskopem i indywidualnie wybierane za pomocą mikropipety .
Mikrofluidyka pozwala na izolację pojedynczych komórek do dalszych analiz. Poniższe zasady opisują różne procesy mikroprzepływowe do separacji pojedynczych komórek: izolacja oparta na kroplach w oleju, pneumatyczne zawory membranowe i hydrodynamiczne pułapki komórkowe. Mikrofluidyka oparta na kroplach w oleju wykorzystuje wypełnione olejem kanały do utrzymywania oddzielonych kropelek wody. Pozwala to na zamknięcie i odizolowanie pojedynczej komórki od wnętrza kanałów na bazie oleju. Pneumatyczne zawory membranowe wykorzystują manipulację ciśnieniem powietrza do izolowania poszczególnych komórek poprzez odchylenie membrany. Manipulowanie źródłem ciśnienia umożliwia otwieranie lub zamykanie kanałów w sieci mikroprzepływowej. Zazwyczaj system wymaga operatora i ma ograniczoną przepustowość.
Technika pęsety ramanowskiej łączy zastosowanie spektroskopii ramanowskiej i pęsety optycznej , która wykorzystuje wiązkę laserową do pułapkowania i manipulowania komórkami.
Rozwój biochipów mikroprzepływowych opartych na hydrodynamice wzrasta z biegiem lat. W tej technice komórki są uwięzione w określonym regionie w celu analizy pojedynczej komórki (SCA). Zwykle dzieje się to bez zastosowania zewnętrznych pól siłowych, takich jak optyczne, elektryczne, magnetyczne lub akustyczne. Istnieje potrzeba zbadania spostrzeżeń SCA w naturalnym stanie komórki, a rozwój tych technik jest bardzo ważny dla tych badań. Badacze zwrócili uwagę na potrzebę opracowania biochipów odpowiadających wymaganiom rynku i badaczy. Mikroprzepływy hydrodynamiczne ułatwiają rozwój pasywnych aplikacji typu lab-on-chip.
Genomika
Techniki
Genomika pojedynczych komórek jest silnie uzależniona od zwiększania liczby kopii DNA znajdujących się w komórce, więc jest ich wystarczająco dużo do sekwencjonowania. Doprowadziło to do opracowania strategii amplifikacji całego genomu (WGA). Obecnie strategie WGA można podzielić na trzy kategorie:
- Kontrolowane priming i amplifikacja PCR: Adapter-Linker PCR WGA
- Losowe primingi i amplifikacja PCR: DOP-PCR, MALBAC
- Losowe primowanie i amplifikacja izotermiczna: MDA
W wielu badaniach porównawczych stwierdzono, że Adapter Linker PCR WGA najlepiej sprawdza się w analizie diploidalnych mutacji pojedynczych komórek, dzięki bardzo niskiemu efektowi odrzucania alleli, oraz w profilowaniu zmienności liczby kopii ze względu na niski poziom szumów, zarówno w przypadku niskiego poziomu aCGH, jak i NGS Sekwencjonowanie przejść. Ta metoda ma zastosowanie wyłącznie do komórek ludzkich, zarówno utrwalonych, jak i nieutrwalonych.
Jedna z powszechnie przyjętych technik WGA nazywa się zdegenerowaną reakcją łańcuchową polimerazy aktywowaną oligonukleotydem (DOP-PCR). Ta metoda wykorzystuje dobrze znaną metodę amplifikacji DNA PCR w celu próby amplifikacji całego genomu przy użyciu dużego zestawu starterów . Chociaż metoda ta jest prosta, wykazano, że ma bardzo niski zasięg genomu. Ulepszeniem DOP-PCR jest amplifikacja wielokrotnego przemieszczenia (MDA), która wykorzystuje losowe startery i enzym o wysokiej wierności , zwykle polimerazę DNA Φ29 , aby osiągnąć amplifikację większych fragmentów i większe pokrycie genomu niż DOP-PCR. Pomimo tych ulepszeń, MDA nadal ma błąd zależny od sekwencji (niektóre części genomu są amplifikowane bardziej niż inne ze względu na ich sekwencję). Wykazano, że metoda, która w dużej mierze pozwala uniknąć błędu systematycznego obserwowanego w DOP-PCR i MDA, to wielokrotne wyżarzanie i cykle amplifikacji oparte na pętli (MALBAC). Odchylenie w tym systemie jest redukowane przez kopiowanie tylko oryginalnej nici DNA zamiast robienia kopii kopii. Główną wadą stosowania MALBA jest mniejsza dokładność w porównaniu z DOP-PCR i MDA ze względu na enzym używany do kopiowania DNA. Po amplifikacji przy użyciu dowolnej z powyższych technik DNA można sekwencjonować przy użyciu sekwencjonowania Sangera lub sekwencjonowania nowej generacji (NGS).
Zamiar
Istnieją dwa główne zastosowania do badania genomu na poziomie pojedynczej komórki. Jednym z zastosowań jest śledzenie zmian zachodzących w populacjach bakterii, w których często obserwuje się różnice fenotypowe. Różnice te są pomijane przy masowym sekwencjonowaniu populacji, ale można je zaobserwować w sekwencjonowaniu pojedynczych komórek. Drugim ważnym zastosowaniem jest badanie genetycznej ewolucji raka. Ponieważ komórki nowotworowe nieustannie mutują, bardzo interesujące jest obserwowanie, jak nowotwory ewoluują na poziomie genetycznym. Te wzorce mutacji somatycznych i aberracji liczby kopii można zaobserwować za pomocą sekwencjonowania pojedynczych komórek.
Transkryptomika
Techniki
Transkryptomika pojedynczych komórek wykorzystuje techniki sekwencjonowania podobne do genomiki pojedynczych komórek lub bezpośrednie wykrywanie za pomocą fluorescencyjnej hybrydyzacji in situ . Pierwszym krokiem w ilościowym określeniu transkryptomu jest przekształcenie RNA w cDNA przy użyciu odwrotnej transkryptazy tak, że zawartość komórki może być zsekwencjonowana przy użyciu metod NGS, tak jak to zrobiono w genomice. Po konwersji nie ma wystarczającej ilości cDNA do sekwencjonowania, więc te same techniki amplifikacji DNA omówione w genomice pojedynczej komórki są stosowane do cDNA, aby umożliwić sekwencjonowanie. Alternatywnie, związki fluorescencyjne przyłączone do sond do hybrydyzacji RNA są używane do identyfikacji określonych sekwencji, a kolejne zastosowanie różnych sond RNA zbuduje kompleksowy transkryptom.
Zamiar
Celem transkryptomiki pojedynczej komórki jest określenie, jakie geny ulegają ekspresji w każdej komórce. Transkryptom jest często używany do ilościowego określania ekspresji genów zamiast proteomu ze względu na trudności związane obecnie ze wzmacnianiem poziomów białek.
Istnieją trzy główne powody, dla których badano ekspresję genów przy użyciu tej techniki: badanie dynamiki genów, składania RNA i typowania komórek. Dynamika genów jest zwykle badana w celu określenia, jakie zmiany w ekspresji genów wpływają na różne cechy komórek. Na przykład ten rodzaj analizy transkryptomicznej był często używany do badania rozwoju embrionalnego. Badania splicingu RNA koncentrują się na zrozumieniu regulacji różnych izoform transkryptu . Transkryptomika pojedynczych komórek została również wykorzystana do typowania komórek, gdzie geny ulegające ekspresji w komórce są wykorzystywane do identyfikacji typów komórek. Głównym celem typowania komórek jest znalezienie sposobu na określenie tożsamości komórek, które nie mają znanych markerów genetycznych .
Proteomika
Techniki
Istnieją trzy główne podejścia do proteomiki pojedynczych komórek: metody oparte na przeciwciałach, metody oparte na białkach fluorescencyjnych i metody oparte na spektroskopii masowej.
Metody oparte na przeciwciałach
Sposoby oparte na przeciwciałach wykorzystują zaprojektowane przeciwciała do wiązania się z białkami będącymi przedmiotem zainteresowania, umożliwiając identyfikację względnej obfitości wielu indywidualnych celów za pomocą jednej z kilku różnych technik.
Obrazowanie: przeciwciała można wiązać z cząsteczkami fluorescencyjnymi, takimi jak kropki kwantowe , lub znakować organicznymi fluoroforami w celu wykrycia za pomocą mikroskopii fluorescencyjnej . Ponieważ do każdego przeciwciała przyłączone są różnokolorowe kropki kwantowe lub unikalne fluorofory, możliwa jest identyfikacja wielu różnych białek w jednej komórce. Kropki kwantowe można zmyć z przeciwciał bez uszkadzania próbki, co umożliwia wykonanie wielu rund oznaczania ilościowego białka przy użyciu tej metody na tej samej próbce. W przypadku metod opartych na organicznych fluoroforach znaczniki fluorescencyjne są przyłączane za pomocą odwracalnego wiązania, takiego jak hybryda DNA (która może ulec stopieniu/dysocjacji w warunkach niskiej zawartości soli) lub chemicznie inaktywowane, co pozwala na wiele cykli analizy, z 3-5 cele określone ilościowo na cykl. Podejścia te zastosowano do ilościowego określania ilości białka w próbkach biopsyjnych pacjentów (np. raka) w celu mapowania zmiennej ekspresji białek w tkankach i/lub nowotworach oraz do mierzenia zmian w ekspresji białek i sygnalizacji komórkowej w odpowiedzi na leczenie raka.
Cytometria masowa : izotopy metali rzadkich, które normalnie nie występują w komórkach lub tkankach, mogą być przyłączane do poszczególnych przeciwciał i wykrywane za pomocą spektrometrii masowej w celu jednoczesnej i czułej identyfikacji białek. Techniki te mogą być wysoce multipleksowane w celu jednoczesnego oznaczania ilościowego wielu celów (paneli do 38 markerów) w pojedynczych komórkach.
Kwantyfikacja przeciwciała-DNA: inna metoda oparta na przeciwciałach przekształca poziomy białka w poziomy DNA. Konwersja do DNA umożliwia amplifikację poziomów białek i wykorzystanie NGS do ilościowego oznaczania białek. W jednym takim podejściu wybiera się dwa przeciwciała dla każdego białka potrzebnego do oznaczenia ilościowego. Dwa przeciwciała są następnie modyfikowane tak, aby miały połączone z nimi jednoniciowe DNA, które są komplementarne. Kiedy dwa przeciwciała wiążą się z białkiem, komplementarne nici łączą się i tworzą dwuniciowy segment DNA, który można następnie amplifikować za pomocą PCR. Każda para przeciwciał zaprojektowanych dla jednego białka jest znakowana inną sekwencją DNA. DNA zamplifikowane z PCR można następnie zsekwencjonować i określić ilościowo poziomy białka.
Metody oparte na spektroskopii masowej
W proteomice opartej na spektroskopii masowej do identyfikacji peptydów potrzebne są trzy główne etapy: przygotowanie próbki, rozdzielenie peptydów i identyfikacja peptydów. Kilka grup skupiło się na oocytach lub komórkach na bardzo wczesnym etapie rozszczepienia, ponieważ komórki te są niezwykle duże i dostarczają wystarczającej ilości materiału do analizy. Inne podejście, proteomika pojedynczych komórek za pomocą spektrometrii mas (SCoPE-MS), pozwoliło określić ilościowo tysiące białek w komórkach ssaków o typowych rozmiarach komórek (średnica 10-15 μm) poprzez połączenie komórek nośnikowych i kodów kreskowych pojedynczych komórek. Druga generacja, SCoPE2, zwiększyła przepustowość dzięki zautomatyzowanemu i zminiaturyzowanemu przygotowaniu próbek; Poprawiła również wiarygodność ilościową i pokrycie proteomem poprzez opartą na danych optymalizację LC-MS/MS i identyfikację peptydów. Czułość i spójność tych metod zostały dodatkowo ulepszone poprzez ustalenie priorytetów i masowo równoległe przygotowanie próbek w kropelkach wielkości nanolitra. Inny kierunek analizy białek jednokomórkowych opiera się na skalowalnej strukturze multipleksowanej akwizycji niezależnej od danych (plexDIA), która umożliwia oszczędność czasu dzięki równoległej analizie zarówno jonów peptydów, jak i próbek białek, dzięki czemu uzyskuje się multiplikatywny wzrost przepustowości.
Rozdzielenie białek o różnej wielkości można przeprowadzić za pomocą elektroforezy kapilarnej (CE) lub chromatografii cieczowej (LC) (stosowanie chromatografii cieczowej ze spektroskopią mas jest również znane jako LC-MS). Ten etap porządkuje peptydy przed oznaczeniem ilościowym przy użyciu tandemowej spektroskopii masowej (MS/MS). Główną różnicą między metodami oznaczania ilościowego są niektóre znaczniki stosowane na peptydach, takie jak tandemowe znaczniki masowe (TMT) lub znaczniki dimetylowe które są używane do określenia, z której komórki pochodzi określone białko (białka pochodzące z każdej komórki mają inną etykietę), podczas gdy inne nie używają etykiet (oceniają ilościowo komórki indywidualnie). Dane ze spektroskopii mas są następnie analizowane przez przepuszczanie danych przez bazy danych, które przekształcają informacje o zidentyfikowanych peptydach na ilościowe oznaczenie poziomów białek. Metody te są bardzo podobne do metod stosowanych do ilościowego oznaczania proteomu komórek masowych , z modyfikacjami mającymi na celu uwzględnienie bardzo małej objętości próbki.
Techniki jonizacji stosowane w analizie pojedynczych komórek opartej na spektrometrii mas
Do analizy pojedynczych komórek można zastosować ogromną różnorodność technik jonizacji. Wybór metody jonizacji ma kluczowe znaczenie dla detekcji analitu. Decydować może o tym, jakie rodzaje związków ulegają jonizacji iw jakim stanie się pojawiają, np. ładunek i ewentualna fragmentacja jonów. Kilka przykładów jonizacji wymieniono w poniższych akapitach.
Nano-DESI
Jednym z możliwych sposobów pomiaru zawartości pojedynczych komórek jest nano-DESI (nanospray desorption electrospray ionization). W przeciwieństwie do desorpcyjnej jonizacji przez elektrorozpylanie , która jest techniką desorpcji, nano-DESI jest techniką ekstrakcji cieczą , która umożliwia pobieranie próbek z małych powierzchni, dlatego nadaje się do analizy pojedynczych komórek. W nano-DESI dwie kapilary ze stopionej krzemionki ułożone są w kształcie litery V, zamykającej się pod kątem ok. 85 stopni. Dwie kapilary stykają się, dzięki czemu między nimi może powstać płynny mostek, który umożliwia pobieranie próbek z powierzchni tak małych, jak pojedyncza komórka. Kapilara pierwotna dostarcza rozpuszczalnik na powierzchnię próbki, gdzie następuje ekstrakcja, a kapilara wtórna kieruje rozpuszczalnik z wyekstrahowanymi cząsteczkami do wlotu MS. Spektrometria mas nano-DESI (MS) umożliwia czułe profilowanie molekularne i kwantyfikację gatunków endogennych o wielkości zaledwie kilkuset fmol-s w pojedynczych komórkach z większą przepustowością. Lanekoff i in. zidentyfikowali 14 aminokwasów, 6 metabolitów i kilka cząsteczek lipidów z komórek pojedynczego policzka za pomocą nano-DESI MS.
LAESI
W ablacji laserowej jonizacji przez elektrorozpylanie (LAESI) do ablacji powierzchni próbki stosuje się laser, a emitowane cząsteczki są jonizowane w fazie gazowej przez naładowane kropelki z elektrorozpylania. Podobnie jak w DESI jonizacja zachodzi w warunkach otoczenia . Andertona i in . wykorzystali tę technikę jonizacji połączoną ze spektrometrem mas z transformacją Fouriera do analizy 200 pojedynczych komórek Allium cepa (czerwona cebula) w wysokiej rozdzielczości przestrzennej.
SIMS
Spektrometria masowa jonów wtórnych (SIMS) jest techniką podobną do DESI, ale podczas gdy DESI jest techniką jonizacji otoczenia, SIMS zachodzi w próżni . Stała powierzchnia próbki jest bombardowana silnie skupioną wiązką jonów pierwotnych . Kiedy uderzają w powierzchnię, cząsteczki są emitowane z powierzchni i jonizowane. Wybór jonów pierwotnych determinuje wielkość wiązki, a także stopień jonizacji i fragmentacji. Parek i in. przeprowadzili metabolomikę, aby prześledzić, w jaki sposób puryny są syntetyzowane w purinosomach i wykorzystali znakowanie izotopowe i obrazowanie SIMS, aby bezpośrednio obserwować gorące punkty aktywności metabolicznej w zamrożonych komórkach HeLa.
MALDI
W desorpcji i jonizacji laserowej wspomaganej matrycą (MALDI) próbka jest umieszczana w matrycy chemicznej , która jest zdolna do absorbowania energii z lasera. Podobnie jak w przypadku SIMS, jonizacja zachodzi w próżni. Promieniowanie laserowe usuwa materiał matrycy z powierzchni i powoduje naładowane cząstki matrycy w fazie gazowej, cząsteczki analitu są jonizowane z tej naładowanej matrycy chemicznej. Liu i in. użył MALDI-MS do wykrycia ośmiu fosfolipidów z pojedynczych komórek A549.
Zamiar
Celem badania proteomu jest lepsze poznanie aktywności komórek na poziomie pojedynczych komórek. Ponieważ białka są odpowiedzialne za określenie, jak działa komórka, poznanie proteomu pojedynczej komórki daje najlepsze zrozumienie, jak działa komórka i jak zmienia się ekspresja genów w komórce pod wpływem różnych bodźców środowiskowych. Chociaż transkryptomika ma ten sam cel co proteomika, nie jest tak dokładna w określaniu ekspresji genów w komórkach, ponieważ nie uwzględnia regulacji potranskrypcyjnej . Transkryptomika jest nadal ważna, ponieważ badanie różnicy między poziomami RNA a poziomami białek może dać wgląd w to, które geny są regulowane potranskrypcyjnie.
Metabolomika
Techniki
Istnieją cztery główne metody stosowane do ilościowego określania metabolomu pojedynczych komórek, są to: detekcja oparta na fluorescencji, biosensory fluorescencyjne, biosensory FRET i spektroskopia mas. Pierwsze trzy wymienione metody wykorzystują mikroskopię fluorescencyjną do wykrywania cząsteczek w komórce. Zwykle testy te wykorzystują małe znaczniki fluorescencyjne przyłączone do cząsteczek będących przedmiotem zainteresowania, jednak wykazano, że jest to zbyt inwazyjne dla metabolomiki pojedynczych komórek i zmienia aktywność metabolitów. Obecnym rozwiązaniem tego problemu jest użycie białek fluorescencyjnych, które będą działać jako detektory metabolitów, fluoryzując, gdy tylko zwiążą się z interesującym metabolitem.
Spektroskopia masowa staje się najczęściej stosowaną metodą metabolomiki pojedynczych komórek. Jego zaletą jest to, że nie ma potrzeby opracowywania białek fluorescencyjnych dla wszystkich interesujących cząsteczek i jest w stanie wykryć metabolity w femtomole zakres. Podobnie jak w przypadku metod omawianych w proteomice, udało się również połączyć spektroskopię mas z technikami rozdzielania, takimi jak elektroforeza kapilarna, w celu ilościowego określenia metabolitów. Ta metoda jest również zdolna do wykrywania metabolitów obecnych w stężeniach femtomoli. Wykazano, że inna metoda wykorzystująca mikropróbkowanie kapilarne w połączeniu ze spektrometrią mas z separacją ruchliwości jonów zwiększa pokrycie molekularne i separację jonów w metabolomice pojedynczych komórek. Badacze próbują opracować technikę, która może wypełnić braki obecnych technik: wysoką przepustowość, wyższą czułość dla metabolitów, których jest mniej lub które mają niską wydajność jonizacji, dobrą powtarzalność i która umożliwia ilościową ocenę metabolitów.
Zamiar
Celem metabolomiki pojedynczych komórek jest lepsze zrozumienie na poziomie molekularnym głównych zagadnień biologicznych, takich jak: rak, komórki macierzyste, starzenie się, a także rozwój lekooporności. Ogólnie rzecz biorąc, metabolomika koncentruje się głównie na zrozumieniu, w jaki sposób komórki radzą sobie ze stresami środowiskowymi na poziomie molekularnym, oraz na bardziej dynamicznym zrozumieniu funkcji komórkowych.
Rekonstrukcja trajektorii rozwojowych
Testy transkryptomiczne pojedynczych komórek umożliwiły trajektorie rozwoju rekonstrukcji. Rozgałęzienie tych trajektorii opisuje różnicowanie komórek. Opracowano różne metody rekonstrukcji rozgałęzionych trajektorii rozwojowych z danych transkryptomicznych pojedynczych komórek. Wykorzystują różne zaawansowane koncepcje matematyczne, od transportu optymalnego po grafy główne. Niektóre biblioteki oprogramowania do rekonstrukcji i wizualizacji trajektorii różnicowania linii są dostępne bezpłatnie w Internecie.
Interakcja komórka-komórka
Interakcje komórka-komórka charakteryzują się interakcjami stabilnymi i przejściowymi.
Zobacz też
Dalsza lektura
- Lim SB, Lim CT, Lim WT (październik 2019). „Analiza pojedynczych komórek krążących komórek nowotworowych: dlaczego heterogeniczność ma znaczenie” . Nowotwory . 11 (10): 1595. doi : 10.3390/cancers11101595 . PMC 6826423 . PMID 31635038 .
- Zhou WM, Yan YY, Guo QR, Ji H, Wang H, Xu TT i in. (październik 2021). „Aplikacje mikrofluidyki do wysokowydajnego sekwencjonowania pojedynczych komórek” . Journal of Nanobiotechnology . 19 (1): 312. doi : 10.1186/s12951-021-01045-6 . PMC 8507141 . PMID 34635104 .
- Ding L, Radfar P, Rezaei M, Warkiani ME (lipiec 2021). „Łatwa w obsłudze metoda izolacji i odzyskiwania pojedynczych komórek przy użyciu mikroprzepływowej statycznej macierzy kropel”. Mikrochimica Acta . 188 (8): 242. doi : 10.1007/s00604-021-04897-9 . PMID 34226955 . S2CID 235738076 .
- Luo C, Liu H, Xie F, Armand EJ, Siletti K, Bakken TE i in. (marzec 2022). „Multiomika pojedynczego jądra identyfikuje różnorodność genomu regulacyjnego ludzkich komórek korowych” . Genomika komórki . 2 (3): 100107. doi : 10.1016/j.xgen.2022.100107 . PMC 9004682 . PMID 35419551 .
- Descamps L, Le Roy D, Deman AL (luty 2022). „Technologie oparte na mikroprzepływach do izolacji CTC: przegląd 10 lat intensywnych wysiłków na rzecz płynnej biopsji” . Międzynarodowy Dziennik Nauk Molekularnych . 23 (4): 1981. doi : 10.3390/ijms23041981 . PMC 8875744 . PMID 35216097 .