Eleksakaftor/tezakaftor/iwakaftor
| Kombinacja | |
|---|---|
| eleksakaftor | regulatora przewodnictwa przezbłonowego mukowiscydozy (CFTR). |
| Tezakaftor | Korektor CFTR |
| Iwakaftor | Otwieracz kanałów chlorkowych |
| Dane kliniczne | |
| Nazwy handlowe | Trikafta, Kaftrio |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a619061 |
| Dane licencyjne | |
| Kategoria ciąży |
|
Drogi podania |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Identyfikatory | |
| Numer CAS | |
| KEGG | |
Elexacaftor/tezacaftor/ivacaftor , sprzedawany pod markami Trikafta (USA) i Kaftrio (UE), to złożony lek o ustalonej dawce stosowany w leczeniu mukowiscydozy . Eleksakaftor/tezakaftor/iwakaftor składa się z kombinacji iwakaftoru , substancji otwierającej kanały chlorkowe, oraz eleksakaftoru i tezakaftoru , modulatorów CFTR.
Jest zatwierdzony do użytku w Stanach Zjednoczonych dla osób w wieku sześciu lat i starszych, które mają mukowiscydozę z mutacją F508del lub innymi mutacjami w genie CFTR. Jest również dopuszczony do użytku w Kanadzie, Unii Europejskiej i Australii. Cena katalogowa rocznego leczenia w USA wynosi 311 000 USD .
Zastosowania medyczne
Połączenie jest wskazane w leczeniu osób w wieku sześciu lat i starszych z mukowiscydozą z mutacją F508del lub innymi mutacjami w genie CFTR.
Skutki uboczne
Najczęstsze działania niepożądane występujące u ponad 5% pacjentów to ból głowy, infekcja górnych dróg oddechowych, ból brzucha, biegunka , wysypka , zwiększenie aktywności aminotransferazy alaninowej , przekrwienie błony śluzowej nosa , zwiększenie aktywności fosfokinazy kreatynowej we krwi, zwiększenie aktywności aminotransferazy asparaginianowej, wyciek z nosa , nieżyt nosa , grypa , zapalenie zatok i wzrost bilirubiny we krwi.
Interakcje
Nie zaleca się jednoczesnego stosowania z induktorami CYP3A . Dawkowanie należy dostosować za pomocą umiarkowanych lub silnych inhibitorów CYP3A .
Inne leki, które mogą wchodzić w interakcje to: warfaryna , digoksyna , statyny , gliburyd , nateglinid , repaglinid .
Farmakologia
Mukowiscydoza i CFTR
Mukowiscydoza jest autosomalnym recesywnym zaburzeniem genetycznym białka CFTR, które zmniejsza transport jonów chlorkowych i sodowych przez błonę komórkową, powodując gęstsze niż normalnie wydzielanie śluzu. Białko CFTR znajduje się w komórkach nabłonkowych płuc, wątroby, trzustki, przewodu pokarmowego i dróg rodnych. CFTR odgrywa rolę w produkcji śluzu, potu i płynów trawiennych. Zagęszczony śluz może prowadzić do stanów zapalnych, infekcji dróg oddechowych i zatkania przewodów.
Mechanizm akcji
Eleksakaftor/tezakaftor/iwakaftor jest lekiem trójlekowym, w którym leki współpracują ze sobą w celu zwiększenia transportu jonów chlorkowych i sodowych oraz prawidłowego przesunięcia płynów, które są rozregulowane w mukowiscydozie.
Wzmacniacz kanału CFTR
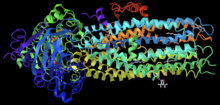
Iwakaftor jest selektywnym małocząsteczkowym wzmacniaczem białka CFTR , które zwiększa zdolność białka do otwierania kanałów chlorkowych. Jego skuteczność w dużym stopniu zależy od ilości białka CFTR na powierzchni komórki i reaktywności zmutowanego białka CFTR. Głównym celem iwakaftoru jest leczenie mutacji bramkowania CFTR klasy III, takich jak G551D, a także innych, mniej powszechnych mutacji. Na krystalicznej figurze widać iwakaftor, pokazany jako szary model kuli i sztyftu w prawym dolnym rogu, związany z CFTR zadokowanym w szczelinie utworzonej przez transbłonowe helisy na granicy faz białko-lipid.
Korektory CFTR
Eleksakaftor i Tezakaftor działają jako korektory CFTR w celu naprawy przetwarzania F508del poprzez wiązanie się z białkiem CFTR w celu zwiększenia dostępności białka CFTR na powierzchni komórki. Działają poprzez modulację pozycji białka CFTR do właściwej pozycji na powierzchni komórki.
Połączenie zwiększonej ilości białka CFTR w prawidłowej pozycji na powierzchni komórki ze wzmocnieniem otwierania kanałów chlorkowych przez iwakaftor skutkuje zwiększonym transportem chlorków i rozrzedzeniem wydzielin śluzu.
Farmakokinetyka
Eleksakaftor/tezakaftor/iwakaftor jest metabolizowany głównie przez CYP3A4 /5 . Ten lek należy przyjmować z posiłkiem o wysokiej zawartości tłuszczu, aby poprawić wchłanianie przez jelita. Jest wydalany w postaci metabolitów lub niezmienionej głównie z kałem iw mniejszym stopniu z moczem. Średni efektywny okres półtrwania eleksakaftoru, tezakaftoru i iwakaftoru wynosi odpowiednio 27,4 godziny, 25,1 godziny i 15 godzin.
Historia
Badanie III fazy wykazało, że osoby leczone eleksakaftorem/tezakaftorem/iwakaftorem poprawiły FEV1 po czterech tygodniach z trwałą poprawą po 24 tygodniach. Częstość zaostrzeń płucnych była o 63% mniejsza, a stężenie chlorków w pocie o 41,8 mmol/l. Jego skuteczność zależy od rodzaju mutacji mukowiscydozy u pacjenta.
Społeczeństwo i kultura
Status prawny
Stany Zjednoczone
Kombinacja została dopuszczona do użytku w Stanach Zjednoczonych w 2019 roku dla osób w wieku 12 lat i starszych z mukowiscydozą, które mają co najmniej jedną mutację F508del w genie regulatora przewodnictwa przezbłonowego mukowiscydozy (CFTR), która, jak się szacuje, stanowi 90% populacja mukowiscydozy. W grudniu 2020 r., po zakończeniu dodatkowego badania klinicznego i rozszerzeniu zatwierdzenia przez FDA na 177 innych mutacji mukowiscydozy. Zatwierdzenie przez FDA dla dzieci w wieku 6–11 lat zostało dodane w styczniu 2021 r., Po zakończeniu trzeciego badania klinicznego.
Amerykańska Agencja ds. Żywności i Leków (FDA) przyznała aplikacji priorytetową ocenę , oprócz przyspieszonej ścieżki , przełomowej terapii i oznaczeń leków sierocych . Producent leku, firma Vertex Pharmaceuticals, otrzyma za opracowanie tej terapii priorytetowy kupon przeglądowy dotyczący rzadkich chorób pediatrycznych.
Australia
W marcu 2021 roku organy regulacyjne ds. Zdrowia w Australii zatwierdziły tę kombinację dla osób w wieku 12 lat i starszych z co najmniej jedną kopią mutacji F508del. Pod koniec kwietnia 2022 roku została umieszczona w Programie Świadczeń Farmaceutycznych , obniżając tym samym koszt z kilkudziesięciu tysięcy dolarów miesięcznie do kilkudziesięciu dolarów miesięcznie.
Kanada
W czerwcu 2020 r. Health Canada zatwierdziła to połączenie dla osób w wieku 12 lat i starszych. We wrześniu 2021 roku prowincje Alberta i Saskatchewan ogłosiły, że dołączą do Ontario w finansowaniu leku. Będą ustalać zasięg indywidualnie dla każdego przypadku, stosując kryteria, które nie zostały jeszcze ogłoszone.
Unia Europejska
W czerwcu 2020 roku Komitet ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP) Europejskiej Agencji Leków (EMA) zarekomendował dopuszczenie kombinacji do leczenia mukowiscydozy. Został dopuszczony do użytku medycznego w Unii Europejskiej w sierpniu 2020 roku.
Norwegia
W dniu 25 kwietnia 2022 r. Beslutningsforum for nye metoder zatwierdziło połączenie do leczenia mukowiscydozy.
Nowa Zelandia
W lutym 2022 r. Pharmac zarekomendował, ze średnim priorytetem, dofinansowanie dla osób w wieku 12 lat i starszych. W grudniu 2022 r. firma Pharmac ogłosiła, że osiągnęła wstępne porozumienie z firmą Vertex finansującą Trikafta od 1 kwietnia 2023 r. dla pacjentów w wieku sześciu lat lub starszych.
Hiszpania
W listopadzie 2021 r. hiszpański rząd zatwierdził refundację kombinacji dla osób w wieku 12 lat i starszych z co najmniej jedną kopią mutacji F508del.
Ekonomia
Stany Zjednoczone
Cena katalogowa rocznego leczenia w USA wynosi 311 000 USD . Jednak raport Institute for Clinical and Economic Review z 2020 r. Wykazał, że cena sprawiła, że leczenie nie jest opłacalne, a „odpowiednia cena za korzyści zdrowotne wahałaby się od 67 900 do 85 500 USD rocznie”.
Australia
Po umieszczeniu kombinacji w programie świadczeń farmaceutycznych w 2022 r. Koszt dla pacjentów z mukowiscydozą w wieku 12 lat lub starszych, którzy mają co najmniej jedną mutację F508del w genie regulującym przewodnictwo przezbłonowe mukowiscydozy, wynosi 42,50 USD miesięcznie lub 6,80 USD za kartę zniżkową posiadacze.
Spór
Vertex odmawia udostępnienia kombinacji w krajach rozwijających się i pracuje nad zablokowaniem generycznych alternatyw.
Badania
| Test | Typ | Główny punkt końcowy | Wiek docelowy | Docelowe mutacje | Wyniki | Bibliografia |
|---|---|---|---|---|---|---|
| Próba 1 | Badanie kontrolowane placebo u pacjentów heterozygotycznych pod względem mutacji F508del i innej specyficznej mutacji | Bezwzględna zmiana ppFEV1 w stosunku do wartości początkowej w tygodniu 4 | Osoby w wieku 12 lat i starsze | • Heterozygota pod względem mutacji F508del i jednej z około 200 innych mutacji w genie CFTR, w wyniku której: 90% podczas badania przesiewowego | procent przewidywanego FEV1, który był o 13,8 punktu wyższy po 4 tygodniach i o 14,3 punktu wyższy przez 24 tygodnie | |
| Próba 2 | Badanie fazy 3 z podwójnie ślepą próbą i aktywną kontrolą | Bezwzględna zmiana ppFEV1 w stosunku do wartości początkowej w tygodniu 4 | Osoby w wieku 12 lat i starsze | Homozygota pod względem mutacji F508del | Eleksakaftor/tezakaftor/iwakaftor wykazały poprawę w procentach przewidywanej natężonej objętości wydechowej (ppFEV1 ) w porównaniu z pacjentami otrzymującymi tezakaftor/iwakaftor | |
| Próba 3 | Badanie otwarte bez kontroli placebo | Bezpieczeństwo, farmakokinetyka i skuteczność | Dzieci w wieku 6–11 lat | Homozygota pod względem mutacji F508del LUB - Heterozygota pod względem mutacji F508del i jednej z ~200 innych mutacji w gen CFTR, który spowodował: • Brak białka CFTR • Białko CFTR, które nie ma podstawowej aktywności i nie reaguje na iwakaftor oraz tezakaftor/iwakaftor |
profile bezpieczeństwa i farmakokinetyczne były na ogół zgodne z profilami obserwowanymi u starszych pacjentów |
Mutacje CFTR, które reagują na eleksakaftor/tezakaftor/iwakaftor, określono w badaniu in vitro komórek tarczycy szczura Fischera (FRT), w których zachodzi ekspresja zmutowanego CFTR. Eleksakaftor/tezakaftor/iwakaftor wykazały skuteczność w przypadku mutacji, w których białko CFTR było skutecznie dostarczane na powierzchnię komórki.
Linki zewnętrzne
- „Eleksakaftor” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.
- „Schemat iwakaftoru z tezakaftorem” . Portal informacyjny o lekach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.