Glutaminian – aminotransferaza prefenianowa
| Identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| aminotransferazy glutaminianowo-prefenianowej | |||||||||
| nr WE | 2.6.1.79 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| |||||||||
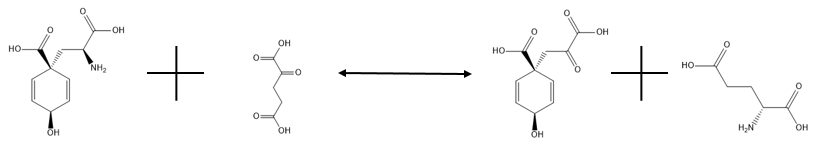
W enzymologii aminotransferaza glutaminianowo-prefenianowa ( EC 2.6.1.79 , znana również jako transaminaza prefenianowa, PAT i L-glutaminian:aminotransferaza prefenianowa) jest enzymem , który katalizuje reakcję chemiczną
- L-arogenian + 2-oksoglutaran prefenian + L-glutaminian
Zatem dwoma substratami tego enzymu są L-arogenian i 2-oksoglutaran , podczas gdy jego dwoma produktami są prefenian i L-glutaminian . Jednak u większości gatunków roślin wykorzystujących ten enzym silnie faworyzowana jest lewa strona reakcji. Dlatego glutaminian jest używany jako donor grup aminowych do przekształcania prefenynianu w arogenian.
Nomenklatura
Enzym ten należy do rodziny transferaz , w szczególności transaminaz , które przenoszą grupy azotowe. Systematyczna nazwa tej klasy enzymów to L-arogenian:aminotransferaza 2-oksoglutaranowa . Inne powszechnie używane nazwy to transaminaza prefenianowa (niejednoznaczna) , PAT (niejednoznaczna) i L-glutaminian:aminotransferaza prefenianowa . Działa na fenyloalaniny i tyrozyny .
Rozmieszczenie gatunków
Gen kodujący ten enzym został ostatnio zidentyfikowany w różnych gatunkach roślin i mikroorganizmach, co oznacza, że wszystkie geny w szlaku zostały już zidentyfikowane i uwzględnione. Szlak ten występuje u wielu różnych gatunków roślin. Ponieważ fenyloalanina jest niezbędnym aminokwasem , ludzie (i inne zwierzęta) utracili zdolność do jej samodzielnego wytwarzania i dlatego muszą ją uzyskiwać z pożywienia. W związku z tym aktywność tego enzymu w różnych gatunkach roślin wpływa również na przeżywalność zwierząt. U tych zwierząt tyrozyna jest syntetyzowana z fenyloalaniny przez enzym hydroksylazę fenyloalaniny , podczas gdy rośliny mają własną metodę syntezy tyrozyny.
Funkcjonować
Aminotransferaza glutaminianowo-prefanianowa katalizuje odwracalną reakcję pokazaną poniżej:
a jego głównym celem jest przekształcenie prefenynianu w arogenian poprzez transaminację, przy użyciu glutaminianu jako donora grupy aminowej. Jak wspomniano wcześniej, lewa strona reakcji jest silnie uprzywilejowana. Jest to niezbędny proces dla każdego organizmu, który musi przekształcić arogenian w fenyloalaninę lub tyrozynę, ponieważ arogenian jest półproduktem w reakcjach syntetyzujących te aminokwasy, alternatywną drogą do tej obejmującej fenylopirogronian i hydroksyfenylopirogronian. W przypadku braku glutaminianu asparaginian może działać jako donor grup aminowych w reakcji bez potrzeby stosowania innego enzymu, ale reakcja ta przebiega wolniej. Szczegóły działania tego enzymu są wciąż nieco tajemnicą.
Struktura
Niewiele wiadomo na temat struktury aminotransferazy glutaminianowo-prefenianowej. Jednak niektóre dane wskazują, że enzym może mieć α2 - β2 .
Referencje i dalsze czytanie
- Bonner CA, Jensen RA (1985). „Nowe cechy aminotransferazy prefenianowej z kultur komórkowych Nicotiana silvestris”. Łuk. Biochem. Biofiza . 238 (1): 237–46. CiteSeerX 10.1.1.410.8500 . doi : 10.1016/0003-9861(85)90161-4 . PMID 3985619 .
- Bonner C, Jensen R (1987). Aminotransferaza prefenianowa . Metody Enzymol . Metody w enzymologii. Tom. 142. s. 479–87. doi : 10.1016/S0076-6879(87)42059-4 . ISBN 9780121820428 . PMID 3298985 .
- Siehl DL, Connelly JA, Conn EE (1986). „Biosynteza tyrozyny w Sorghum bicolor: charakterystyka aminotransferazy prefenianowej” . Z. Naturforscha. C. _ 41 (1–2): 79–86. doi : 10.1515/znc-1986-1-213 . PMID 2939644 . S2CID 9370252 .
- Graindorge M, Giustini C, Jacomin AC, Kraut A, Curien G, Matringe M (2010). „Identyfikacja genu roślinnego kodującego aminotransferazę glutaminianową / asparaginianowo-prefenianową: ostatni bezdomny enzym biosyntezy aminokwasów aromatycznych”. FEBS Lett . 584 (20): 4357–60. doi : 10.1016/j.febslet.2010.09.037 . PMID 20883697 . S2CID 13591470 .
- Maeda H, Yoo H, Dudareva N (2011). „Aminotransferaza prefenianowa kieruje roślinną biosyntezą fenyloalaniny poprzez arogenian”. Nat. chemia Biol . 7 (1): 19–21. doi : 10.1038/nchembio.485 . PMID 21102469 .
- De-Eknamkul W, Ellis BE (1988). „Oczyszczanie i charakterystyka aminotransferazy prefenianowej z kultur komórkowych Anchusa officinalis”. Łuk. Biochem. Biofiza . 267 (1): 87–94. doi : 10.1016/0003-9861(88)90011-2 . PMID 3196038 .
- Dal Cin V, Tieman DM, Tohge T, McQuinn R, de Vos RC, Osorio S, Schmelz EA, Taylor MG, Smits-Kroon MT, Schuurink RC, Haring MA, Giovannoni J, Fernie AR, Klee HJ (2011). „Identyfikacja genów szlaku metabolicznego fenyloalaniny przez ektopową ekspresję czynnika transkrypcyjnego MYB w owocach pomidora” . Komórka Roślinna . 23 (7): 2738–53. doi : 10.1105/tpc.111.086975 . PMC 3226207 . PMID 21750236 .
- Graindorge M, Giustini C, Kraut A, Moyet L, Curien G, Matringe M (2014). „Trzy różne klasy aminotransferaz wyewoluowały funkcjonalność aminotransferazy prefenianowej w mikroorganizmach kompetentnych w stosunku do arogenianów” . J. Biol. chemia . 289 (6): 3198–208. doi : 10.1074/jbc.M113.486480 . PMC 3916524 . PMID 24302739 .
- „Ortologia: K15849” . Zintegrowany system wyszukiwania baz danych DBGET . Źródło 25 października 2020 r .