dehydrogenaza glutaminianowa 1
| GLUD1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory | |||||||||||||||||||||||||||||||||||||||||||||||
| , GDH, GDH1, GLUD, dehydrogenaza glutaminianowa 1, hGDH1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikatory zewnętrzne | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidane | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
GLUD1 ( dehydrogenaza glutaminianowa 1 ) jest enzymem macierzy mitochondrialnej , należącym do rodziny dehydrogenaz glutaminianowych wszechobecnych w życiu , odgrywającym kluczową rolę w metabolizmie azotu i glutaminianu (Glu) oraz homeostazie energetycznej . Ta dehydrogenaza jest wyrażana na wysokim poziomie w wątrobie , mózgu , trzustce i nerkach , ale nie w mięśniach . Uważa się, że w komórkach trzustki GLUD1 bierze udział w mechanizmach wydzielania insuliny . W tkance nerwowej, gdzie glutaminian występuje w stężeniach wyższych niż w innych tkankach, GLUD1 wydaje się działać zarówno w syntezie, jak i katabolizmie glutaminianu i być może w detoksykacji amoniaku .
Struktura
Gen
Ludzki GLUD1 zawiera 13 egzonów i znajduje się na 10. chromosomie .
Istnieją dowody na to, że GLUD1 został przeniesiony wstecz do chromosomu X, gdzie dał początek pozbawionemu intronów GLUD2 poprzez przypadkowe mutacje i dobór naturalny. GLUD2 dostosował się do szczególnych potrzeb układu nerwowego, w którym jest on szczególnie wyrażany.
Białko

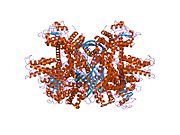
Struktura domeny GLUD1 Każda domena ma inny kolor - Glu-BD , NAD(P)-BD , antena , helisa obrotowa . Regulatory allosteryczne są pokazane jako modele sferyczne. Ta szczególna struktura GLUD1 jest połączeniem dwóch struktur rentgenowskich - jednej ze związanym GTP ( 1HWZ ) i drugiej ze związanym ADP ( 1NQT , 8AR8 ). Chociaż nie jest to rzeczywiste, ta struktura pokazuje względną pozycję allosterycznych efektorów po związaniu z GLUD1. Pokazano również NADPH i Glu.
GLUD1 jest heksamerem. Jednostka monomeru ma:
- N-końcowa Glu-BD (domena wiążąca), która składa się głównie z nici β.
- NAD-BD - może wiązać NAD + lub NADP + .
- 48-resztkowa wypustka podobna do anteny, która rozciąga się od góry każdego NAD-BD. Antena składa się ze wznoszącej się helisy i zstępującej spirali losowej, która zawiera małą helisę α w kierunku C-końcowego końca nici.
NAD-BD znajduje się na górze Glu-BD. NAD-BD i Glu-BD tworzą szczelinę katalityczną. Podczas wiązania substratu NAD-BD porusza się znacząco. Ruch ten składa się z dwóch elementów, obracających się wzdłuż długiej osi spirali z tyłu NAD-BD, zwanej „spiralą obrotową” i obracającej się wokół anteny zgodnie z ruchem wskazówek zegara. Porównanie otwartej i zamkniętej konformacji GLUD1 ujawnia zmiany w małej helisie zstępującego pasma anteny, która wydaje się cofać, gdy otwiera się szczelina katalityczna. Zamknięcie jednej podjednostki wiąże się z odkształceniem małej helisy nici zstępującej, która jest wpychana w antenę sąsiedniej podjednostki. R496 znajduje się na tej małej helisie (patrz Mutacje).
Podstawową strukturą heksameru jest ułożony w stos dimer trimerów. Glu-BD monomerów są głównie odpowiedzialne za tworzenie się rdzenia. Względne położenie monomerów jest takie, że obrót wokół osi obrotowej w każdym monomerze nie jest ograniczony. Anteny z trzech podjednostek w trymerach owijają się wokół siebie i przechodzą zmiany konformacyjne, gdy szczelina katalityczna otwiera się i zamyka. Antena służy jako kanał komunikacyjny między podjednostkami podczas ujemnej współpracy i regulacji allosterycznej.
Dopasowanie GLUD1 z różnych źródeł pokazuje, że antena prawdopodobnie wyewoluowała w protista przed utworzeniem purynowych miejsc regulacyjnych . Sugeruje to, że istnieje pewna selektywna przewaga samej anteny i że zwierzęta rozwinęły nowe funkcje dla GLUD1 poprzez dodanie regulacji allosterycznej .
GLUD1 może tworzyć długie włókna przez połączenie heksamerów od końca do końca. Polimeryzacja nie jest związana z aktywnością katalityczną, ale prawdopodobnie odgrywa ważną rolę, taką jak tworzenie kompleksów multienzymatycznych.
GLUD1 ma dwa miejsca wiązania koenzymu: jedno w NAD-BD, które jest zdolne do wiązania eteru NAD+ lub NADP + i jest bezpośrednio zaangażowane w proces katalityczny, oraz drugie, pełniące funkcję regulatorową, leżące bezpośrednio pod osią helisy , który może wiązać ADP, NAD + lub NADH, ale nie wiąże się dobrze z NADPH.
Funkcjonować
GLUD1 katalizuje oksydacyjną deaminację Glu do 2-oksoglutaranu i wolnego NH 4 + przy użyciu NAD + lub NADP + jako kofaktora. Reakcja zachodzi z przeniesieniem jonu wodorkowego z Glu's Cα na NAD(P) + , tworząc w ten sposób 2-iminoglutaran, który jest hydrolizowany do 2-oksoglutaranu i NH 4 + . Równowaga reakcji w standardowych warunkach znacznie sprzyja tworzeniu się Glu w stosunku do NH 4 + (Go' ~ 30 kJ.mol-1). Z tego powodu sądzono, że enzym ten odgrywa ważną rolę w detoksykacji amoniaku, ponieważ ponieważ wysokie [NH4 + ] są toksyczne, ta równowaga byłaby ważna z fizjologicznego punktu widzenia; pomogłoby to w utrzymaniu niskiego poziomu [NH 4 + ]. Jednak u osób z pewną postacią hiperamonemii wynikającą z postaci hiperinsulinizmu , aktywność enzymu jest zwiększona z powodu zmniejszonej wrażliwości na GTP, negatywny regulator. Poziomy amoniaku we krwi tych osobników są znacznie podwyższone, czego nie można by się spodziewać, gdyby enzym rzeczywiście działał w równowadze.
Interakcje
Wiążący partnerzy
ADP
ADP wiąże się za NAD-BD, tuż pod helisą obrotową - w specjalnym allosterycznym miejscu ADP. Ugrupowanie adenozyny wiąże się z hydrofobową kieszenią, z grupami fosforanowymi rybozy skierowanymi na zewnątrz w kierunku miejsca allosterycznego GTP.
NADH może również wiązać się z miejscem ADP, gdy występuje w wysokich stężeniach, zwykle powodując hamowanie enzymu.
GTP
Wiązanie GTP jest antagonizowane przez Pi i ADP, ale jest synergistyczne z NADH związanym w niekatalitycznym miejscu allosterycznym. Większość kontaktów między GTP a enzymem odbywa się przez ugrupowanie trifosforanowe. Miejsce wiązania GTP jest uważane za „czujnik”, który wyłącza enzym, gdy komórka znajduje się w stanie wysokiej energii. GTP wiąże się na połączeniu między NAD-BD a anteną.
Podczas gdy większość interakcji GLUD1-GTP odbywa się poprzez interakcje β- i γ-fosforanowe, istnieją specyficzne interakcje z E346 i K343, które faworyzują guanozynę nad adenozyną.
W otwartej konformacji miejsce wiązania GTP jest zniekształcone tak, że nie może już wiązać GTP.
Rozporządzenie
Kiedy GLUD1 jest silnie nasycony ligandami miejsca aktywnego (substratami), w miejscu aktywnym tworzy się hamujący nieudany kompleks: NAD(P)H.Glu w reakcji deaminacji oksydacyjnej przy wysokim pH i NAD(P) + .2 - oksoglutaran w reakcji aminowania redukcyjnego przy niskim pH. GLUD1 przyjmuje swoją konfigurację stanu podstawowego przy braku efektorów allosterycznych, niezależnie od tego, czy miejsca allosteryczne są funkcjonalne. Allosteryczne regulatory GLUD1 - ADP, GTP, Leu, NAD + i NADH - wywierają swoje działanie poprzez zmianę energii wymaganej do otwarcia i zamknięcia szczeliny katalitycznej podczas obrotu enzymatycznego, innymi słowy odpowiednio przez destabilizację lub stabilizację nieudanych kompleksów. Aktywatory nie są konieczne do katalitycznej funkcji GLUD1, ponieważ jest on aktywny pod nieobecność tych związków (stan podstawowy). Sugerowano, że GLUD1 przyjmuje w swoim stanie podstawowym konfigurację (otwarta szczelina katalityczna), która umożliwia aktywność katalityczną niezależnie od tego, czy miejsca allosteryczne są funkcjonalne. Regulacja GLUD ma szczególne znaczenie biologiczne, czego przykładem są obserwacje pokazujące, że mutacje regulacyjne GLUD1 są związane z objawami klinicznymi u dzieci.
ADP
ADP będąc jednym z dwóch głównych aktywatorów (NAD + jest drugim), działa destabilizując nieudane kompleksy i znosząc negatywną kooperatywność. W przypadku braku substratów i ze związanym ADP, szczelina katalityczna jest w konformacji otwartej, a heksamery GLUD1 tworzą długie polimery w komórce kryształu z większą liczbą interakcji niż w nieudanych złożonych kryształach ( 8AR8 ). Jest to zgodne z faktem, że ADP promuje agregację w rozwiązaniu. Kiedy szczelina katalityczna się otwiera, R516 jest obracany w dół do fosforanów ADP. Otwarcie szczeliny katalitycznej jest z grubsza skorelowane z odległością między R516 a fosforanami ADP. W ten sposób ADP aktywuje GLUD1, ułatwiając otwarcie szczeliny katalitycznej, co zmniejsza powinowactwo produktu i ułatwia uwalnianie produktu. umożliwiając w ten sposób GLUD1 pogodzenie niekatalitycznych nieudanych kompleksów.
Sugerowano wcześniej, że hamowanie przez wysoki [ADP] jest spowodowane współzawodnictwem między ADP a ugrupowaniem adenozynowym koenzymu w miejscu aktywnym1. Przynajmniej wiadomo, że H507Y lub R516A nie mają wpływu na efekt.
ATP
ATP ma złożony wpływ zależny od stężenia na aktywność GLUD1:
- Niski [ATP] - hamowanie, w którym pośredniczy miejsce wiązania GTP, ponieważ jest eliminowane przez H507Y. Powinowactwo ATP do miejsca GTP wydaje się być 1000-krotnie mniejsze niż do GTP, ponieważ oddziaływania β- i γ-fosforanowe są głównym wyznacznikiem wiązania w miejscu GTP.
- Pośredni [ATP] - aktywacja, za pośrednictwem miejsca efektorowego ADP, ponieważ jest prawie całkowicie eliminowana przez R516A. W tym miejscu grupa nukleotydowa jest głównym wyznacznikiem wiązania.
- Wysoki [ATP] - hamowanie, w którym pośredniczy słabe wiązanie w trzecim miejscu, które jest stosunkowo specyficzne dla nukleotydów adeninowych. Na ten efekt stosunkowo nie ma wpływu ani H507Y, ani R516A. Jak zasugerowano w przypadku ADP, może to wynikać z rywalizacji między ATP a ugrupowaniem adenozynowym koenzymu w miejscu aktywnym.
GTP
GTP hamuje obrót enzymu w szerokim zakresie warunków poprzez zwiększenie powinowactwa GLUD1 do produktu reakcji, ograniczając szybkość uwalniania produktu we wszystkich warunkach w obecności GTP. GTP działa poprzez utrzymywanie szczeliny katalitycznej w zamkniętej konformacji, stabilizując w ten sposób nieudane kompleksy. Wpływ GTP na GLUD1 nie jest zlokalizowany wyłącznie w podjednostce, z którą się wiąże, i że antena odgrywa ważną rolę w przekazywaniu tego hamowania innym podjednostkom.
Leja
Leu aktywuje GLUD1 niezależnie od ADP, posiadając specjalne miejsce allosteryczne w obszarze styku podjednostek 8AR7 . Wzmocnione odpowiedzi pacjentów z HI/HA (patrz zespół HI/HA) na stymulację Leu uwalniania INS3, które wynikają z ich upośledzonej wrażliwości na hamowanie GTP, podkreślają fizjologiczne znaczenie kontroli hamowania GLUD1.
NAD +
NAD(P)(H) może wiązać się z drugim miejscem na każdej podjednostce. To miejsce wiąże NAD(H) ~10-krotnie lepiej niż NADP(H) z formami zredukowanymi lepiej niż formy utlenione. Chociaż sugerowano, że wiązanie zredukowanego koenzymu w tym miejscu hamuje reakcję, podczas gdy wiązanie utlenionego koenzymu powoduje aktywację, efekt jest nadal niejasny.
NADH
NADH jest kolejnym głównym allosterycznym inhibitorem GLUD1.
Fosforan
Fosforan i inne dwuwartościowe aniony stabilizują GLUD1. Ostatnie badania strukturalne wykazały, że cząsteczki fosforanu wiążą się z miejscem GTP.
Znaczenie kliniczne
Rodzinny hiperinsulinizm, związany z mutacjami w GLUD1, charakteryzuje się hipoglikemią, która waha się od ciężkiej, trudnej do opanowania choroby noworodkowej do choroby rozpoczynającej się w dzieciństwie z łagodnymi objawami i trudną do zdiagnozowania hipoglikemią . Choroba rozpoczynająca się w okresie noworodkowym objawia się w ciągu kilku godzin do dwóch dni po urodzeniu. Choroba rozpoczynająca się w dzieciństwie objawia się w pierwszych miesiącach lub latach życia. W okresie noworodkowym objawy mogą być niespecyficzne, w tym drgawki, hipotonia, złe karmienie i bezdech. W ciężkich przypadkach stężenie glukozy w surowicy jest zazwyczaj bardzo niskie, a zatem łatwe do rozpoznania, podczas gdy w łagodniejszych przypadkach zmienna i łagodna hipoglikemia może utrudniać rozpoznanie. Nawet w tej samej rodzinie objawy choroby mogą wahać się od łagodnego do ciężkiego. Osoby z autosomalnym recesywnym rodzinnym hiperinsulinizmem, spowodowanym mutacjami w jednym z nich ABCC8 lub KCNJ11 (FHI-KATP) są zwykle duże jak na wiek ciążowy i zwykle objawiają się ciężką, oporną na leczenie hipoglikemią w pierwszych 48 godzinach życia; dotknięte chorobą niemowlęta zwykle reagują tylko częściowo na dietę lub postępowanie medyczne (tj. terapię diazoksydem), a zatem mogą wymagać resekcji trzustki. Osoby z autosomalnie dominującym FHI- KATP wydają się być odpowiednie do wieku ciążowego w chwili urodzenia, do wieku około jednego roku (zakres: 2 dni do 30 lat) i reagują na dietę i terapię diazoksydem. Zgłoszono wyjątki od obu tych ogólników. FHI-GCK, spowodowane mutacjami w GCK , może być znacznie łagodniejszy niż FHI-KATP; jednak u niektórych osób występuje ciężka hipoglikemia niereagująca na diazoksyd. FHI-HADH, spowodowane mutacjami w HADH, ma zwykle stosunkowo łagodny przebieg, chociaż zgłaszano ciężkie przypadki. Osoby z FHI-HNF4A, spowodowane mutacjami w HNF4A, zwykle rodzą się duże jak na wiek ciążowy i mają łagodne cechy, które reagują na diazoksyd leczenie. FHI-UCP2, spowodowane mutacjami w UCP2, jest rzadką przyczyną FH1 reagującego na diazoksyd. Hiperamonemia/hiperinsulinizm (HA/HI) jest związany z łagodną do umiarkowanej hiperamonemią i stosunkowo łagodną hipoglikemią o późnym początku; większość, ale nie wszystkie osoby dotknięte chorobą mają mutacje w GLUD1.
Charakterystyka kliniczna
FHI charakteryzuje się hipoglikemią, która waha się od ciężkiej, trudnej do opanowania choroby noworodkowej do choroby rozpoczynającej się w dzieciństwie z łagodnymi objawami i trudną do zdiagnozowania hipoglikemią. Choroba rozpoczynająca się w okresie noworodkowym objawia się w ciągu kilku godzin do dwóch dni po urodzeniu. Choroba rozpoczynająca się w dzieciństwie objawia się w pierwszych miesiącach lub latach życia. W okresie noworodkowym objawy mogą być niespecyficzne, w tym drgawki, hipotonia, złe karmienie i bezdech. W ciężkich przypadkach stężenie glukozy w surowicy jest zazwyczaj bardzo niskie, a zatem łatwe do rozpoznania, podczas gdy w łagodniejszych przypadkach zmienna i łagodna hipoglikemia może utrudniać rozpoznanie. Nawet w tej samej rodzinie objawy choroby mogą wahać się od łagodnego do ciężkiego.
Diagnoza/testowanie
Około 45% osób dotkniętych chorobą ma mutacje albo w ABCC8, który koduje białko SUR1, albo w KCNJ11, który koduje białko Kir6.2. W populacji Żydów aszkenazyjskich dwie mutacje założycielskie ABCC8 są odpowiedzialne za około 97% FHI. Inne mutacje założycielskie ABCC8 są obecne w populacji fińskiej (p. Val187Asp i p.Asp1506Lys). Mutacje w GLUD1 i HNF4A odpowiadają za około 5% osób z FHI. Mutacje aktywujące w GCK lub mutacje inaktywujące w HADH występują u mniej niż 1% osób z FHI. Do tej pory mutacje w UCP2 odnotowano tylko w dwóch rodzinach. Około 40% osób z FHI nie ma możliwej do zidentyfikowania mutacji w żadnym z genów, o których wiadomo, że są związane z FHI.
Kierownictwo
Przy wstępnym rozpoznaniu hipoglikemię koryguje się dożylnym podaniem glukozy w celu normalizacji stężenia glukozy w osoczu i zapobieżenia uszkodzeniu mózgu. Długoterminowe postępowanie medyczne obejmuje stosowanie diazoksydu, analogów somatostatyny, nifedypiny, glukagonu, rekombinowanego IGF-I, glikokortykosteroidów, ludzkiego hormonu wzrostu, interwencje dietetyczne lub kombinacje tych terapii. U osób, u których agresywne postępowanie medyczne nie pozwala na utrzymanie stężenia glukozy w osoczu w bezpiecznych granicach lub u których takie leczenie nie może być bezpiecznie utrzymane przez dłuższy czas, rozważa się resekcję trzustki.
Linki zewnętrzne
- Wpis GeneReviews/NCBI/NIH/UW dotyczący rodzinnego hiperinsulinizmu
- Glutaminian + dehydrogenaza w US National Library of Medicine Medical Subject Headings (MeSH)
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : P00367 (dehydrogenaza glutaminianowa 1, mitochondrialna) w PDBe-KB .
Ten artykuł zawiera tekst z Narodowej Biblioteki Medycznej Stanów Zjednoczonych , która jest własnością publiczną .