Jony metali w roztworze wodnym
Jon metalu w roztworze wodnym lub jon wodny to rozpuszczony w wodzie kation o wzorze chemicznym [M(H 2 O) n ] z+ . Liczba solwatacji , n , wyznaczona różnymi metodami doświadczalnymi, wynosi 4 dla Li + i Be 2+ oraz 6 dla większości pierwiastków w 3 i 4 okresie układu okresowego pierwiastków . Lantanowce i aktynowce jony wodne mają wyższe liczby solwatacji (często od 8 do 9), przy czym najwyższa znana to 11 dla Ac 3+ . Siła wiązań między jonem metalu a cząsteczkami wody w pierwotnej powłoce solwatacyjnej wzrasta wraz z ładunkiem elektrycznym z jonu metalu i maleje wraz ze wzrostem jego promienia jonowego r . Jony wodne ulegają hydrolizie. Logarytm pierwszej stałej hydrolizy jest proporcjonalny do z 2 / r dla większości jonów wodnych.
Jon wodny jest związany poprzez wiązania wodorowe z innymi cząsteczkami wody w wtórnej powłoce solwatacyjnej. Cząsteczki wody w pierwszej powłoce hydratacyjnej wymieniają się z cząsteczkami w drugiej powłoce solwatacyjnej i cząsteczkami w cieczy objętościowej. Czas przebywania cząsteczki w pierwszej powłoce waha się w zależności od pierwiastków chemicznych od około 100 pikosekund do ponad 200 lat. Jony wodne są widoczne w elektrochemii .
Wprowadzenie do wodnych jonów metali
Pierwiastki tworzące jony wodne H On Li Być B C N O F Nie Na Mg Glin Si P S Kl Ar k ok Sc Ti V Kr Mn Fe Współ Ni Cu zn Ga Ge* Jak Se br Kr Rb Sr Y Zr Uwaga pn Tc ru Rh Pd Ag Płyta CD W Sn Sb* Te I Xe Cs Ba La Ce Pr Nd Po południu sm ue Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Odnośnie Os Ir cz Au Hg Tl Pb Bi Po* Na Rn Pt* Ra* Ak Cz Rocznie u np Pu Jestem Cm Bk por Es* fm* Md* NIE* Lr* Rf db sierż Bh Hs góra Ds Rg Cn Nh Fl Mc poz Ts Og
- * Brak informacji eksperymentalnych dotyczących struktur wodnych jonów
Większość pierwiastków chemicznych to metale . Związki pierwiastków metalicznych tworzą zwykle proste jony wodne o wzorze [M(H 2 O) n ] z+ na niskich stopniach utlenienia . Na wyższych stopniach utlenienia proste jony wodne dysocjują, tracąc jony wodoru , tworząc kompleksy zawierające zarówno cząsteczki wody, jak i jony wodorotlenkowe lub tlenkowe, takie jak związki wanadu (IV) [VO(H 2 O) 5 ] 2+ . Na najwyższych stopniach utlenienia znane są tylko oksyaniony , takie jak nadmanganian (VII), MnO
− 4 . Nie wiadomo , czy kilka pierwiastków metalicznych, które powszechnie występują tylko na wysokich stopniach utlenienia, takich jak niob i tantal , tworzy kationy wodne; w pobliżu granicy metal-niemetal arsen i tellur są znane tylko jako związki hydrolizowane. Niektóre elementy, takie jak cyna i antymon , są wyraźnie metalami, ale tworzą tylko związki kowalencyjne na najwyższych stopniach utlenienia: ich kationy wodne są ograniczone do niższych stopni utlenienia. German jest raczej półprzewodnikiem niż metalem, ale wydaje się, że tworzy kation wodny; podobnie wodór tworzy wodny kation jak metale, mimo że jest gazem. Transaktynowce powodu braku danych eksperymentalnych; podobny problem dotyczy astatyny , który tworzy gatunek kationowy, ale nie wiadomo, czy jest to kation wodny, a niewiele dowodów sugeruje, że może nim nie być. W przypadku niektórych wysoce radioaktywnych pierwiastków przeprowadzono chemię eksperymentalną i okresowość sugeruje, że powstały jony wodne; ale nie są dostępne żadne informacje eksperymentalne dotyczące struktury tych przypuszczalnych jonów wodnych.

Mówi się, że w roztworze wodnym cząsteczki wody bezpośrednio przyłączone do jonu metalu należą do pierwszej sfery koordynacyjnej , znanej również jako pierwsza lub pierwotna powłoka solwatacyjna. Wiązanie między cząsteczką wody a jonem metalu jest wiązaniem kowalencyjnym celownika , w którym atom tlenu przekazuje oba elektrony do wiązania. Każda skoordynowana cząsteczka wody może być połączona wiązaniami wodorowymi do innych cząsteczek wody. Mówi się, że te ostatnie znajdują się w drugiej sferze koordynacyjnej. Druga sfera koordynacyjna nie jest dobrze zdefiniowaną jednostką dla jonów o ładunku 1 lub 2. W rozcieńczonych roztworach wtapia się w strukturę wody, w której występuje nieregularna sieć wiązań wodorowych między cząsteczkami wody. W przypadku jonów trójdodatnich wysoki ładunek kationu polaryzuje cząsteczki wody w pierwszej powłoce solwatacyjnej do takiego stopnia, że tworzą one wystarczająco silne wiązania wodorowe z cząsteczkami w drugiej powłoce, tworząc bardziej stabilną całość.
Siłę wiązania metal-tlen można oszacować na różne sposoby. Entalpia hydratacji, choć oparta pośrednio na pomiarach eksperymentalnych, jest najbardziej wiarygodną miarą. Skala wartości opiera się na dowolnie wybranym zera, ale nie wpływa to na różnice między wartościami dla dwóch metali. Inne miary obejmują częstotliwość drgań M – O i długość wiązania M – O. Siła wiązania MO ma tendencję do zwiększania się wraz ze wzrostem ładunku i zmniejszania się wraz ze wzrostem wielkości jonu metalu. W rzeczywistości istnieje bardzo dobra korelacja liniowa między entalpią hydratacji a stosunkiem ładunku do kwadratu do promienia jonowego, z 2 /R. W przypadku jonów w roztworze najczęściej stosowaną miarą jest „efektywny promień jonowy” Shannona.
Cząsteczki wody w pierwszej i drugiej powłoce solwatacyjnej mogą zamieniać się miejscami. Kurs wymiany zmienia się ogromnie, w zależności od metalu i jego stopnia utlenienia. W roztworze wodnym jonom metali zawsze towarzyszą solwatowane aniony, ale o solwatacji anionów wiadomo znacznie mniej niż o solwatacji kationów.
rozpuszczalnikach niewodnych , takich jak ciekły amoniak , metanol , dimetyloformamid i sulfotlenek dimetylu, by wymienić tylko kilka.
Występowanie w przyrodzie
Jony wodne są obecne w większości wód naturalnych. Na + , K + , Mg 2+ i Ca 2+ są głównymi składnikami wody morskiej .
Jony wodne w wodzie morskiej ( zasolenie = 35) Jon Na +
K +
Mg 2+
około 2+
Stężenie (mol kg −1 )0,469 0,0102 0,0528 0,0103
Wiele innych jonów wodnych występuje w wodzie morskiej w stężeniach od ppm do ppt . Stężenia sodu, potasu, magnezu i wapnia we krwi są zbliżone do tych w wodzie morskiej. Krew ma również niższe stężenia niezbędnych pierwiastków, takich jak żelazo i cynk. Napój sportowy ma być izotoniczny i zawiera również minerały, które są tracone wraz z potem .
Jony magnezu i wapnia są powszechnymi składnikami wody pitnej i są odpowiedzialne odpowiednio za twardość stałą i przejściową . Często występują w wodach mineralnych .
metody eksperymentalne
Uzyskane informacje na temat charakteru jonów w roztworze różnią się w zależności od rodzaju zastosowanej metody eksperymentalnej. Niektóre metody ujawniają właściwości kationu bezpośrednio, inne ujawniają właściwości zależne zarówno od kationu, jak i anionu. Niektóre metody dostarczają informacji o charakterze statycznym, swego rodzaju migawki średnich właściwości, inne dostarczają informacji o dynamice rozwiązania.
Jądrowy rezonans magnetyczny (NMR)
Jony, dla których szybkość wymiany wody jest niska w skali czasu NMR, dają oddzielne piki dla cząsteczek w pierwszej powłoce solwatacyjnej i dla innych cząsteczek wody. Liczbę solwatacji uzyskuje się jako stosunek powierzchni pików. Tutaj odnosi się do liczby cząsteczek wody w pierwszej powłoce solwatacyjnej. Cząsteczki w drugiej powłoce solwatacyjnej szybko wymieniają się z cząsteczkami rozpuszczalnika, powodując niewielką zmianę wartości przesunięcia chemicznego nieskoordynowanych cząsteczek wody w stosunku do samej wody. Główną wadą tej metody jest to, że wymaga dość stężonych roztworów, co wiąże się z ryzykiem powstawania par jonowych tworzenie z anionem.
| Jon | Bądź 2+ | Mg 2+ | Al 3+ | Ga 3+ | w 3+ | Fe 2+ | Co 2+ | Ni 2+ | Zn2 + | 4+ _ |
|---|---|---|---|---|---|---|---|---|---|---|
| Numer | 4 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 9 |
| Jądro | 1 H 17 O | 1 H | 1 H | 1 H 17 O | 1 H | 17 o | 1 H | 1 H 17 O | 1 H | 1 H |
Dyfrakcja rentgenowska (XRD)
Roztwór zawierający jon wodny nie ma porządku dalekiego zasięgu, który byłby obecny w krysztale zawierającym ten sam jon, ale istnieje porządek krótkiego zasięgu. Dyfrakcja rentgenowska na roztworach daje funkcję rozkładu promieniowego , z której można wyprowadzić liczbę koordynacyjną jonu metalu i odległość metal-tlen. W przypadku jonów wodnych o wysokim ładunku uzyskuje się pewne informacje o drugiej powłoce solwatacyjnej.
Ta technika wymaga użycia stosunkowo stężonych roztworów. Promienie rentgenowskie są rozpraszane przez elektrony, więc moc rozpraszania wzrasta wraz z liczbą atomową. To sprawia, że atomy wodoru są prawie niewidoczne dla rozpraszania promieniowania rentgenowskiego.
3+ i Rh 3+ , zastosowano rozpraszanie promieni rentgenowskich pod dużymi kątami . Stwierdzono , że druga powłoka hydratacyjna Cr 3+ zawiera 13 ± 1 cząsteczek w średniej odległości 402 ± 20 pm . Oznacza to, że każda cząsteczka w pierwszej powłoce hydratacyjnej jest związana wodorem z dwiema cząsteczkami w drugiej powłoce.
Dyfrakcja neutronów
Dyfrakcja na neutronach daje również funkcję rozkładu radialnego . W przeciwieństwie do dyfrakcji rentgenowskiej, neutrony są rozpraszane przez jądra i nie ma związku z liczbą atomową. Rzeczywiście, można wykorzystać fakt, że różne izotopy tego samego pierwiastka mogą mieć bardzo różne moce rozpraszania. W klasycznym eksperymencie wykonano pomiary na czterech chlorku niklu przy użyciu kombinacji 58 Ni, 60 Ni, 35 Cl i 37 Izotopy Cl dają bardzo szczegółowy obraz solwatacji kationów i anionów. Dane dla wielu soli metali wykazują pewną zależność od stężenia soli.
| Sól | LiCl | CaCl 2 | NiCl 2 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Molarność soli | 27.77 | 9,95 | 3,57 | 4.49 | 2,80 | 1.0 | 3.05 | 0,85 | 0,46 | 0,086 |
| Liczba hydratacji kationu † | 2.3 (2) | 3,0 (5) | 5,5 (3) | 6.4 (3) | 7.2 (2) | 10,0 (6) | 5.8 (2) | 6.6 (5) | 6.8 (8) | 6.8 (8) |
| θ / stopień ‡ | 75 (5) | 52 (5) | 40 (5) | 34 (9) | 34 (9) | 38 (9) | 42 (8) | 27 (10) | 17 (10) | 0 (20) |
| Sól | Ni( ClO4 ) 2 | Cu( ClO4 ) 2 | Fe(NO 3 ) 3 | NdCl 3 | DyCl 3 |
|---|---|---|---|---|---|
| Molarność soli | 3,80 | 2.00 | 2.0 | 2,85 | 2.38 |
| Liczba hydratacji kationu † | 5.8 (2) | 4,9 (3) | 5,0 (2) | 8,5 (2) | 7.4 (5) |
| θ / stopień ‡ | 42 (8) | 38 (6) | 22 (4) | 24 (4) | 17 (3) |
- † Liczby w nawiasach to odchylenia standardowe ostatniej znaczącej cyfry wartości. ‡ kąt między wiązaniem M-OH 2 a płaszczyzną cząsteczki wody.
Większość tych danych odnosi się do stężonych roztworów, w których jest bardzo mało cząsteczek wody, które nie znajdują się w pierwszorzędowych sferach hydratacji kationu lub anionu, co może wyjaśniać pewne zmiany liczby solwatacji ze stężeniem, nawet jeśli nie ma jonu kontaktowego łączenie w pary. Kąt θ określa kąt nachylenia cząsteczek wody względem płaszczyzny jonu wodnego. Na ten kąt wpływają wiązania wodorowe utworzone między cząsteczkami wody w pierwotnej i wtórnej powłoce solwatacyjnej.
Zmierzona liczba solwatacji jest wartością uśrednioną w czasie dla rozwiązania jako całości. Gdy zmierzona liczba solwatacji pierwotnej jest ułamkowa, istnieją dwa lub więcej gatunków o całkowitych liczbach solwatacji znajdujących się w równowadze ze sobą. Dotyczy to również liczb solwatacyjnych, które są liczbami całkowitymi, w granicach błędu eksperymentalnego. Na przykład liczbę solwatacji 5,5 dla chlorku litu można zinterpretować jako wynikającą z obecności dwóch różnych jonów wodnych o równych stężeniach.
- [Li(H 2 O) 6 ] + ⇌ [Li(H 2 O) 5 ] + + H 2 O
Inną możliwością jest to, że istnieje interakcja między solwatowanym kationem a anionem, tworząc parę jonową . Jest to szczególnie istotne, gdy pomiary są wykonywane na stężonych roztworach soli. Na przykład liczba solwatacji 3 dla roztworu chlorku litu może być interpretowana jako wynikająca z równowagi
- [Li(H 2O ) 4 ] + + Cl − ⇌ [Li(H 2 O) 3 Cl] + H 2 O
całkowicie na korzyść pary jonowej.
Widma wibracyjne
Widma w podczerwieni i widma Ramana można wykorzystać do pomiaru częstotliwości rozciągania MO w wodnych jonach metali. Spektroskopia Ramana jest szczególnie przydatna, ponieważ widmo Ramana wody jest słabe, podczas gdy widmo wody w podczerwieni jest intensywne. Interpretację częstotliwości drgań nieco komplikuje obecność w jonach oktaedrycznych i tetraedrycznych dwóch drgań, symetrycznej mierzonej w widmie Ramana i antysymetrycznej mierzonej w widmie w podczerwieni.
| jon metalu | Bądź 2+ | Mg 2+ | Mn2 + | Fe 2+ | Ni 2+ | Cu 2+ | Zn2 + | Hg 2+ | Al 3+ | Ga 3+ | w 3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|
| liczba falowa / cm −1 | 530-543 | 360-365 | 395 | 389 | 405 | 440 | 385-400 | 380 | 520-526 | 475 | 400 |
Chociaż związek między częstotliwością drgań a stałą siły nie jest prosty, ogólny wniosek, jaki można wyciągnąć z tych danych, jest taki, że siła wiązania MO rośnie wraz ze wzrostem ładunku jonowego i malejącym rozmiarem jonu. Częstotliwość rozciągania MO wodnego jonu w roztworze można porównać z jego odpowiednikiem w krysztale o znanej strukturze. Jeśli częstotliwości są bardzo podobne, można stwierdzić, że liczba koordynacyjna jonu metalu jest taka sama w roztworze, jak w związku w stanie stałym.
Metody dynamiczne
Dane takie jak przewodnictwo , mobilność elektryczna i dyfuzja odnoszą się do ruchu jonów w roztworze. Kiedy jon przechodzi przez roztwór, ma tendencję do zabierania ze sobą zarówno pierwszej, jak i drugiej powłoki solwatacyjnej. Stąd liczby solwatacji mierzone na podstawie właściwości dynamicznych są zwykle znacznie wyższe niż te uzyskane na podstawie właściwości statycznych.
Liczby nawodnienia mierzone metodami dynamicznymi Li + Na + Cs + Mg 2+ około 2+ Ba 2+ Zn2 + Cr 3+ Al 3+ Numer transportu jonów 13-22 7-13 4 12-14 8-12 3-5 10-13 Ruchliwość jonów 3-21 2-10 10-13 7-11 5-9 10-13 Dyfuzja 5 3 1 9 9 8 11 17 13
Liczby i struktury solwatacji
Wodór
Wodór nie jest metalem, ale podobnie jak one ma tendencję do utraty elektronu walencyjnego w reakcjach chemicznych, tworząc kation H + . W roztworze wodnym natychmiast łączy się z cząsteczką wody, tworząc formę ogólnie symbolizowaną jako H 3 O + (czasami luźno zapisywane jako H + ). Takie uwodnienie tworzy kationy, które zasadniczo można uznać za [H(OH 2 ) n ] + .
Solwatacja H + w wodzie nie jest w pełni scharakteryzowana i zaproponowano wiele różnych struktur. Dwie dobrze znane struktury to kation Zundela i kation Eigen . Struktura solwatacji Eigena ma jon hydroniowy w centrum H 9 O + 4 , w którym hydron jest silnie związany wiązaniami wodorowymi z trzema sąsiednimi cząsteczkami wody. W kompleksie Zundel H 5 O + 2 proton jest dzielony równo przez dwie cząsteczki wody w a symetryczne wiązanie wodorowe .
Metale alkaliczne
Uwodniony kation litu w wodzie jest prawdopodobnie czworościenny i czterokoordynacyjny. W pierwotnej sferze solwatacyjnej oktaedrycznego jonu sodu jest najprawdopodobniej sześć cząsteczek wody . Potas ma siedem współrzędnych, a rubid i cez są prawdopodobnie antypryzmatycznymi kwadratami o ośmiu współrzędnych. Brak danych dla franka .
Metale ziem alkalicznych
| [Be( H2O ) 4 ] 2+ | [Mg( H20 ) 6 ] 2+ | Ca 2+ (wodny) | Sr 2+ (aq) | Ba 2+ (woda) | |
|---|---|---|---|---|---|
| Odległość MO (pm) | 167 | 209 | 242 § | 263 § | 281 § |
| solwatacja (kJ mol -1 ) | 2494 | 1921 | 1577 | 1443 | 1305 |
- § Wartości ekstrapolowane z danych dla struktur kryształów w stanie stałym
Kation berylu [Be(H 2 O) 4 ] 2+ ma bardzo dobrze zdefiniowaną pierwotną powłokę solwatacyjną z czworościennym rdzeniem BeO 4 . W przypadku magnezu [Mg(H 2 O) 6 ] 2+ jest również dobrze scharakteryzowaną formą, z ośmiościennym rdzeniem MgO 6 . Sytuacja z wapniem jest bardziej skomplikowana. Dane z dyfrakcji neutronów dały liczbę solwatacji chlorku wapnia, CaCl2 , która jest silnie zależna od stężenia: 10,0 ± 0,6 przy 1 mol·dm −3 , zmniejszając się do 6,4 ± 0,3 przy 2,8 mol·dm −3 . Entalpia solwatacji maleje wraz ze wzrostem promienia jonowego. Znane są różne stałe hydraty z koordynacją 8 w kwadratowym antygraniastosłupie i geometrii dwunastościennej . W wodzie wapń i stront są najprawdopodobniej kwadratowymi antygraniastosłupami o ośmiu współrzędnych (chociaż obecnie nie można wykluczyć siedmiu współrzędnych dla wapnia). Bar nie jest tak dobrze zbadany: wydaje się, że ma liczbę koordynacyjną 8 lub 9. Teoretyczna symulacja radu sugeruje, że jego uwodnienie ma dziesięć współrzędnych.
Metale grupy 3, lantanowce i aktynowce
Skand (III) i itr (III) mają osiem współrzędnych, ale mają różne struktury: skand ma niezwykłą trójkątną pryzmatyczną strukturę z dwoma czapeczkami (z jednym pustym miejscem na czapkę), podczas gdy itr jest kwadratowy antypryzmatyczny. Lutet (III) jest pryzmatycznym trójkątnym trójkątem, ale ma znaczny deficyt wody: jedna z cząsteczek wody pokrywającej jest znacznie bliżej lutetu niż pozostałe, a średnia liczba koordynacyjna wynosi tylko 8,2 zamiast 9. Opierając się na promieniu jonowym, lawrencium (III) jest prawdopodobnie trójgraniastym pryzmatem o dziewięciu współrzędnych i trójkątnym bez deficytu wody.
Trójwartościowe jony lantanowców stale zmniejszają swoją wielkość od lantanu do lutetu , efekt znany jako skurcz lantanowca . Od lantanu do dysprozu , liczba koordynacyjna jest utrzymywana na poziomie 9 z trygonalną strukturą pryzmatyczną z trigonami, chociaż począwszy od samaru cząsteczki wody nie są już równie silnie związane. Deficyt wody pojawia się wtedy dla holmu przez lutet ze średnią liczbą koordynacyjną spadającą do 8,2 przy lutecie (III). Konfiguracja jest zachowana pomimo niewielkich rozmiarów kationów i deficytu wody, prawdopodobnie z powodu silnych wiązań wodorowych. Europ (II) ma siedem współrzędnych, a cer (IV) jest hydrolizowany do dimeru z mostkiem tlenowym [(H 2 O) 7 Ce–O–Ce(OH 2 ) 7 ] 6+ .
Aktyn (III) ma jedenaście współrzędnych w roztworze wodnym. Tor (IV) jest trygonalnym pryzmatycznym o dziewięciu współrzędnych z trzema końcówkami i zakłada się, że to samo dotyczy innych kationów aktynowców (IV) w roztworach wodnych (ponieważ jest to również ich konfiguracja w stanie stałym). Dotychczasowe badania nad liczbą koordynacyjną i/lub strukturą aktynowców(III) obejmują tylko kaliforn . Jednakże, ponieważ lawren (III) ma podobny promień jonowy do dysprozu (III), jest prawdopodobne, że uran (III) do lawrenu (III) to wszystkie trójkątne graniastosłupy o dziewięciu współrzędnych i trójkątnych, z całkowicie zajętymi pozycjami czapek. Brak danych dla fermu (II), mendelewium (II) lub nobelu (II).
Metale grupy 4-12
Jony tych metali na stopniach utlenienia +2 i +3 mają liczbę solwatacji równą 6. Wszystkie mają regularną strukturę oktaedryczną, z wyjątkiem wodnych jonów chromu ( II) i miedzi (II), które podlegają zniekształceniu Jahna-Tellera . W przypadku miedzi dwie osiowe odległości Cu-O wynoszą 238 pm, podczas gdy cztery równikowe odległości Cu-O wynoszą 195 pm w stanie stałym. Jednak nie jest jasne, czy Cu 2+ ma liczbę solwatacji 5 czy 6 w roztworze wodnym, ze sprzecznymi raportami eksperymentalnymi. Struktura kobaltu (III) w roztworze wodnym nie został określony. Szacuje się, że miedź (I) ma cztery współrzędne czworościenne.
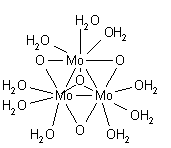
Liczba solwatacji 6 ze strukturą oktaedryczną jest dobrze ustalona dla cynku (II) i kadmu (II) w rozcieńczonych roztworach. W stężonych roztworach jon Zn 2+ może przyjmować czworościenną strukturę o współrzędnych 4, ale dowody nie są rozstrzygające ze względu na możliwość parowania jonów i/lub hydrolizy. Liczba solwatacji rtęci (II) najprawdopodobniej wyniesie 6. Cynk (II) ma ośmiościenny układ o sześciu współrzędnych, ale kadm (II) może znajdować się w równowadze między sześcio- a siedmioma koordynacjami. Rtęć (II) jest zniekształconym ośmiościanem pseudo-Jahna-Tellera. Bis wodna struktura jonu rtęci(I), [(H 2 O)-Hg-Hg-(OH 2 )] + , występującego w związkach stałych, nie jest taka sama jak w roztworze, który obejmuje trzy skoordynowane cząsteczki wody do każdej rtęci uzupełniającej zniekształcony układ czworościenny. Innym gatunkiem wodnym, w którym występuje wiązanie metal-metal, jest molibdenu (II) sformułowany jako [(H 2 O) 4 Mo≣Mo(H 2 O) 4 ] 4+ . Każdy molibden jest otoczony czterema cząsteczkami wody w układzie kwadrat-płaszczyzna, w strukturze podobnej do znanej struktury kompleksu chloru [Mo 2 Cl 8 ] 4− .
Istnieje kilka dwuwartościowych i trójwartościowych wodnych jonów metali przejściowych w drugiej i trzeciej serii przejściowej: ruten (II) i (III), rod (III) i iryd (III), wszystkie oktaedryczne. (Struktury rutenu i irydu zostały zbadane tylko w stanie stałym, ale zakłada się, że są takie same w roztworze wodnym). Molibden (III) jest wątpliwy (i może być silnie hydrolizowany w roztworze wodnym), a molibden (II) dimeryzuje z każdym molibdenem wiążącym cztery cząsteczki wody. Pallad (II) i platyna (II) jony wody były pierwotnie uważane za kwadratowe, ale w rzeczywistości są silnie wydłużone tetragonalnie w kształcie piramidy kwadratowej lub ośmiościennej z dodatkową jedną lub dwiema cząsteczkami wody wyjątkowo luźno związanymi. Struktura srebra (I) jest kwestionowana: może mieć dwie współrzędne lub cztery współrzędne z dwiema bardzo luźno związanymi cząsteczkami wody. Złoto (III) jest kwadratem o czterech współrzędnych w stanie stałym i zakłada się, że ma taką samą strukturę w roztworze wodnym. Zniekształcenie występuje w przypadku metali o niskich współrzędnych z silnymi tendencjami kowalencyjnymi z powodu efektu Jahna-Tellera drugiego rzędu. Jednak na stopniu utlenienia 4 jedynymi niezhydrolizowanymi formami są kwadratowy antypryzmatyczny cyrkon (IV), [Zr(H 2 O) 8 ] 4+ i hafn (IV), [Hf(H 2 O) 8 ] 4+ , a nawet one są wyjątkowo podatne na hydrolizę: taki kation cyrkonu powstaje tylko w rozcieńczonych roztworach Zr IV w mocnym kwasie. W praktyce spotykane formy kationowe cyrkonu i hafnu są wielopierścieniowe.
Metale grupy 13-17
Wodny jon glinu (III), [Al(H 2 O) 6 ] 3+ , jest bardzo dobrze scharakteryzowany w roztworze iw stanie stałym. Rdzeń AlO 6 ma symetrię oktaedryczną, grupę punktową Oh . Jony wodne galu (III), indu (III) i talu (III) są również ośmiościennymi sześciorzędowymi. Geometria koordynacyjna talu (I) nie jest znana eksperymentalnie, ale prawdopodobnie jest skierowana do połowy z dużą przerwą w sferze koordynacyjnej.
Cyna (II) ma 3 współrzędne skierowane do połowy z bardzo dużą przerwą w sferze koordynacyjnej cyny (II). Liczba hydratacji ołowiu (II) nie jest dobrze ustalona i może wynosić od pięciu do siedmiu. W praktyce kationy te są zwykle wielopierścieniowe. Bizmut (III) jest kwadratowym antypryzmatem o ośmiu współrzędnych w roztworze wodnym, chociaż w stanie stałym jest trójgraniastym pryzmatem o dziewięciu współrzędnych.
Jony wodne pierwiastków w pobliżu linii podziału metal-niemetal są bardzo łatwo hydrolizowane i nie można ich łatwo zbadać eksperymentalnie. Istnieją pewne dowody na to, że wodne jony germanu (II) mogą tworzyć się w środowisku kwasu nadchlorowego . Jednak jest to łatwo utleniane do germanu (IV). Antymon (III) wodne jony mogą również występować w rozcieńczonych roztworach antymonu (III) w stężonych kwasach, ale nie ma na to bezpośrednich dowodów. Obliczenia mechaniki kwantowej sugerują, że jony wodne germanu (II) i antymonu (III) powinny istnieć i wykazywałyby ekstremalne zniekształcenie pierwszej sfery koordynacyjnej z powodu dużej gęstości ładunku i stereochemicznie aktywnych wolnych par. W przypadku germanu (II) oblicza się, że pierwsza powłoka ma zwykle liczbę solwatacji równą 6, ale możliwe są również liczby 4–7, a powłoka dzieli się na dwie części w różnych odległościach od centralnego Ge 2+ . Podobne badania antymonu (III) ujawniły liczbę solwatacji równą 8, przy czym pierwsza sfera koordynacyjna podzieliła się na dwie półkule hydratacyjne, z których każda zawiera 4 cząsteczki wody. Obliczenia dla polonu (IV) wskazują liczbę solwatacji między 8 a 9.
że arsen (III) tworzy tylko związki hydrolizowane. Stabilne kationowe formy arsenu(III) w wodzie oblicza się jako [As(OH) 2 ] + . Na stopniu utlenienia +4 oczekuje się tylko związków hydrolizowanych dla germanu (IV), cyny (IV) i ołowiu (IV). kationowy tellur (IV) to [Te(OH) 3 ] + .
Kationowy gatunek astatyny (I) wywnioskowano z eksperymentów w skali śladowej w roztworach kwaśnych, ale nie jest jasne, czy jest to kation wodny, czy nie. Niektórzy autorzy sugerowali, że może to być symetryczny kompleks diakwa [At(H 2 O) 2 ] + , ale dowody elektromigracji sugerują, że zamiast tego jest to protonowany kwas hipoastatyczny [H 2 OAt] + , wykazujący analogię do jodu.
Chociaż pojedyncze pary wpływają na struktury talu (I), germanu (II), cyny (II), ołowiu (II) i antymonu (III), to nie dotyczy to bizmutu (III).
Oxo-woda-kationy
Niektóre pierwiastki na stopniach utlenienia wyższych niż 3 tworzą stabilne, uwodnione jony okso. Dobrze znanymi przykładami są wanadylu (IV) i uranylu (VI). Można je postrzegać jako szczególnie trwałe produkty hydrolizy w hipotetycznej reakcji, takiej jak np
- [V(H 2 O) 6 ] 4+ → [VO(H 2 O) 5 ] 2+ + 2H +
Wanad ma zniekształcone środowisko oktaedryczne ( grupa punktowa C 4v ) składające się z jednego jonu tlenkowego i 5 cząsteczek wody. Podobną strukturę ma tytanyl, TiO 2+ . Uważa się, że wanad(V) występuje jako diokso-jon [VO 2 (H 2 O) 4 ] + przy pH niższym niż 2, ale dowody na istnienie tego jonu zależą od tworzenia kompleksów, takich jak kompleksy szczawianowe , które zostały pokazano, że ma jednostkę VO
+ 2 , z cis -VO wiązania, w stanie stałym. Jon chromu (IV) [CrO(H 2 O) 5 ] 2+ , podobny do jonu wanadu, został zaproponowany na podstawie dowodów pośrednich.
Jon uranylu, UO
2+ 2 , ma strukturę trans . Jon wodny UO
2+ 2 (aq) ma pięć cząsteczek wody w płaszczyźnie prostopadłej do osi OUO w pięciokątnej strukturze bipiramidy , grupa punktowa D 5h . Neptunyl i plutonyl mają taką samą budowę. Nic nie wiadomo o strukturach aktynowców (V).
Termodynamika
Głównym celem termodynamiki w tym kontekście jest oszacowanie wielkości termodynamicznych pojedynczych jonów, takich jak entalpia hydratacji i entropia hydratacji . Ilości te odnoszą się do reakcji
- M z+ (gaz) + rozpuszczalnik → M z+ (w roztworze)
Entalpii tej reakcji nie można bezpośrednio zmierzyć, ponieważ wszystkie pomiary wykorzystują roztwory soli zawierające zarówno kation, jak i anion. Większość pomiarów eksperymentalnych dotyczy ciepła wydzielanego podczas rozpuszczania soli w wodzie, co daje sumę entalpii solwatacji kationów i anionów. Następnie, biorąc pod uwagę dane dla różnych anionów z tym samym kationem i różnych kationów z tym samym anionem, uzyskuje się wartości pojedynczych jonów względem dowolnego zera.
Standardowa entalpia hydratacji pojedynczego jonu / kJ mol -1
Li + -514,6
Bądź 2+ -2487,0
Na + -404,6
Mg2 + -1922,1
A13 + -4659,7
K + -320,9
Ca2 + -1592,4
Sc 3+ -3960,2...
Gal3 + -4684,8
Rb + -296,2
Sr 2+ -1444,7
Y3 + -3620,0...
W 3+ -4108,7
Sn 2+ -1554,4
Cs + -263,2
Ba2 + -1303,7
La 3+ -3282,8...
Tl 3+ -4184.0
Pb2 + -1479,9
Inne wartości obejmują Zn2 + -2044,3, Cd2 + -1805,8 i Ag + -475,3 kJ mol -1 .
Istnieje doskonała korelacja liniowa między entalpią hydratacji a stosunkiem ładunku do kwadratu, z 2 , do odległości MO, r eff .
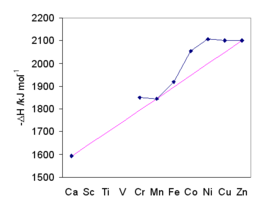
Na wartości metali przejściowych wpływa stabilizacja pola krystalicznego . Ogólny trend pokazuje purpurowa linia przechodząca przez Ca 2+ , Mn 2+ i Zn 2+ , dla których nie ma stabilizacji w polu oktaedrycznym kryształu. Energia hydratacji wzrasta wraz ze zmniejszaniem się rozmiaru. Rozszczepienie pola krystalicznego zapewnia dodatkową stabilność jonowi wodnemu. Maksymalna energia stabilizacji pola krystalicznego występuje przy Ni 2+ . Zgodność entalpii hydratacji z przewidywaniami stanowiła jedną z podstaw ogólnej akceptacji teorii pola krystalicznego.
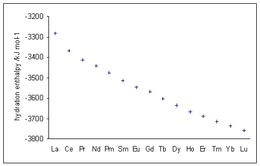
Entalpie hydratacji trójwartościowych jonów lantanowców wykazują coraz większe wartości ujemne przy wzroście liczby atomowej, zgodnie ze spadkiem promienia jonowego, znanym jako skurcz lantanowców .
Można wyprowadzić entropię hydratacji pojedynczego jonu. Wartości przedstawiono w poniższej tabeli. Im bardziej ujemna wartość, tym większy porządek w tworzeniu jonów wodnych. Warto zauważyć, że ciężkie metale alkaliczne mają raczej małe wartości entropii, co sugeruje, że zarówno pierwsza, jak i druga powłoka solwatacyjna są nieco niewyraźne.
Standardowa entropia hydratacji pojedynczego jonu w 25 ° C / J deg -1 mol -1
Li + -118,8
Na + -87,4
Mg2 + -267,8
A13 + -464,4
K + -51,9
Ca2 + -209,2...
Gal3 + -510,4
Rb + -40,2
Sr 2+ -205,0...
W 3+ -426,8
Cs + -36,8
Ba2 + -159,0
La 3+ -368,2...
Hydroliza jonów wodnych
Istnieją dwa sposoby patrzenia na równowagę obejmującą hydrolizę jonu wodnego. Uwzględnienie równowagi dysocjacji
- [M(H2O ) n ] z + - H + ⇌ [M(H2O ) n -1 (OH)] (z-1)+
aktywność produktu hydrolizy, pomijając cząsteczki wody, wyraża się wzorem
Alternatywą jest zapisanie równowagi jako reakcji kompleksowania lub podstawienia
- [M(H2O ) n ] z + +OH − ⇌ :[M(H2O ) n -1 ( OH)] (z-1)+ + H2O
W którym to przypadku
Stężenia jonów wodoru i wodorotlenków są powiązane przez samojonizację wody , K w = {H + } {OH − }, więc dwie stałe równowagi są powiązane jako
W praktyce pierwsza definicja jest bardziej użyteczna, ponieważ stałe równowagi wyznacza się na podstawie pomiarów stężeń jonów wodorowych. Ogólnie,
opłaty zostały pominięte ze względu na ogólność, a działania zostały zastąpione koncentracjami. to skumulowane stałe hydrolizy.
Modelowanie reakcji hydrolizy zachodzących w roztworze jest zwykle oparte na określeniu stałych równowagi na podstawie danych miareczkowania potencjometrycznego (pH). Proces ten nie jest prosty z różnych powodów. Czasami substancje w roztworze można wytrącić w postaci soli, a ich strukturę potwierdzić za pomocą krystalografii rentgenowskiej. W innych przypadkach wytrącone sole nie mają związku z tym, co postuluje się w roztworze, ponieważ określone substancje krystaliczne mogą mieć zarówno niską rozpuszczalność, jak i bardzo niskie stężenie w roztworach.
Pierwsza stała hydrolizy
Logarytm stałej hydrolizy K 1,-1 dla usunięcia jednego protonu z jonu wodnego
- [M(H 2 O) n ] z+ - H + ⇌ [M(H 2 O) n-1 (OH)] (z-1)+
- [ [M(OH)] {(z-1)+ ] = K. 1,-1 [M z+ ] [H + ] −1
pokazuje liniową zależność ze stosunkiem ładunku do odległości MO, z / d. Jony dzielą się na cztery grupy. Nachylenie linii prostej jest takie samo dla wszystkich grup, ale punkt przecięcia A jest inny.
log K 1,-1 = A + 11,0 z/d kation A
Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ Al 3+ , Y 3+ , La 3+−22,0 ± 0,5
Li + , Na + , K + Be 2+ , Mn 2+ , Fe 2+ , Co 2+ , Ni 2+ , Cu 2+ , Zn 2+ , Cd 2+ Sc 3+ , Ti 3+ , V 3+ , Cr 3+ , Fe 3+ , Rh 3+ , Ga 3+ , W 3+ Ce 4+ , Th 4+ , Pa 4+ , U 4+ , Np 4+ , pu 4+ ,−19,8 ± 1
Ag + , Tl + Pb 2+ Ti 3+ , Bi 3+ ,−15,9 ± 1 Sn 2+ , Hg 2+ , Sn 2+ , Pd 2+ ok. 12
Kationy najbardziej odporne na hydrolizę ze względu na swój rozmiar i ładunek to twarde jony metali przed przejściem przejściowym lub jony lantanowców. Do nieco mniej odpornej grupy należą jony metali przejściowych. Trzecia grupa zawiera głównie miękkie jony jonów metali post-przejściowych. Jony wykazujące najsilniejszą tendencję do hydrolizy ze względu na swój ładunek i rozmiar to Pd 2+ , Sn 2+ i Hg 2+ .
Standardowa zmiana entalpii dla pierwszego etapu hydrolizy generalnie nie różni się bardzo od zmiany dysocjacji czystej wody. W konsekwencji standardowa zmiana entalpii dla reakcji podstawienia
- [M(H2O ) n ] z + +OH − ⇌ :[M(H2O ) n -1 ( OH)] (z-1)+ + H2O
jest bliski zeru. Jest to typowe dla reakcji między twardym kationem a twardym anionem, takim jak jon wodorotlenkowy. Oznacza to, że standardowy ładunek entropii jest głównym czynnikiem przyczyniającym się do standardowej zmiany energii swobodnej, a tym samym do stałej równowagi.
Za efekt odpowiada zmiana ładunku jonowego, ponieważ jon wodny ma większy wpływ na uporządkowanie roztworu niż mniej naładowany kompleks hydroksylowy.
Wiele reakcji hydrolizy
Hydroliza berylu wykazuje wiele cech charakterystycznych dla wielu reakcji hydrolizy. Stężenia różnych form, w tym form wielopierścieniowych z mostkowymi jonami wodorotlenkowymi, zmieniają się w funkcji pH aż do wytrącenia nierozpuszczalnego wodorotlenku. Hydroliza berylu jest niezwykła, ponieważ stężenie [Be(H 2 O) 3 (OH)] + jest zbyt niskie, aby można je było zmierzyć. Zamiast tego trimer ([Be3 ( H2O ) 6 ( OH3 ) ) 3+ powstaje, którego budowę potwierdzono w solach stałych. Tworzenie form wielojądrowych jest napędzane przez zmniejszenie gęstości ładunku w cząsteczce jako całości. Lokalne środowisko jonów berylu jest zbliżone do [Be(H 2 O) 2 (OH) 2 ] + . Zmniejszenie ładunku efektywnego uwalnia energię swobodną w postaci zmniejszenia entropii uporządkowania w centrach ładowania.
Niektóre produkty hydrolizy wielojądrowej Formuła gatunku kationy Struktura M2 ( OH) +
Be 2+ , Mn 2+ , Co 2+ , Ni 2+ Zn 2+ , Cd 2+ , Hg 2+ , Pb 2+pojedynczy mostek wodorotlenkowy między dwoma kationami M2 (OH) (
2z-2)+ 2
Cu 2+ , Sn 2+ Al 3+ , Sc 3+ , Ln 3+ , Ti 3+ , Cr 3+ Th 4+ VO 2+ , UO
2+ 2 , NpO
2+ 2 , PuO
2+ 2podwójny mostek wodorotlenkowy między dwoma kationami M
3 (OH)
3+ 3Bądź 2+ , Hg 2+ sześcioczłonowy pierścień z naprzemiennymi grupami M n+ i OH- M3
( (OH)
3z-4)+ 4
Sn 2+ , Pb 2+ Al 3+ , Cr 3+ , Fe 3+ , W 3+Sześcian z naprzemiennymi wierzchołkami grup M n + i OH - , brakuje jednego wierzchołka M
4 (OH)
4+ 4Mg 2+ , Co 2+ , Ni 2+ , Cd 2+ , Pb 2+ Sześcian z naprzemiennymi wierzchołkami grup M n+ i OH − M
4 (OH)
8+ 8Zr 4+ , Cz 4+ Kwadrat jonów M n+ z podwójnymi mostkami wodorotlenkowymi po obu stronach kwadratu
Produkt hydrolizy glinu sformułowany jako [Al 13 O 4 (OH) 24 (H 2 O) 12 ] 7+ jest bardzo dobrze scharakteryzowany i może występować w naturze w wodzie o pH ok. 5.4.
Ogólną reakcję na utratę dwóch protonów z jonu wodnego można zapisać jako
- [M(H2O ) n ] z + - 2 H + ⇌ [M(H2O ) n -2 (OH) 2 ] (z-2)+
Jednak stała równowagi dla utraty dwóch protonów odnosi się równie dobrze do równowagi
- [M(H 2O ) n ] z+ - 2 H + ⇌ [MO(H 2 O) n-2 ] (z-2)+ + H 2 O
ponieważ zakłada się, że stężenie wody jest stałe. Dotyczy to ogólnie: każda stała równowagi jest równie ważna dla produktu z jonem tlenkowym, jak i dla produktu z dwoma jonami hydroksylowymi. Te dwie możliwości można rozróżnić jedynie poprzez określenie struktury soli w stanie stałym. Mostki okso zwykle występują, gdy stopień utlenienia metalu jest wysoki. Przykładem jest molibdenu (IV) [Mo 3 O 4 (H 2 O) 9 ] 4+ , w którym występuje trójkąt atomów molibdenu połączonych wiązaniami σ- z mostkiem tlenkowym na każdej krawędzi trójkąta i czwartym tlenkiem, który łączy mostki ze wszystkimi trzema atomami Mo.
oksyaniony
Istnieje bardzo niewiele jonów oxo-wodnych metali na stopniu utlenienia +5 lub wyższym. Raczej gatunki występujące w roztworze wodnym to monomeryczne i polimeryczne oksyaniony. Oksyaniony można postrzegać jako końcowe produkty hydrolizy, w których nie ma cząsteczek wody przyłączonych do metalu, a jedynie jony tlenkowe.
Kinetyka wymiany
Cząsteczka wody w pierwszej powłoce solwatacyjnej jonu wodnego może zamienić się miejscami z cząsteczką wody w rozpuszczalniku masowym. Zwykle przyjmuje się, że etapem determinującym szybkość jest reakcja dysocjacji .
- [M(H 2 O) n ] z+ → [M(H 2 O) n-1 ] z+ * + H 2 O
Symbol * oznacza, że jest to stan przejściowy w reakcji chemicznej. Szybkość tej reakcji jest proporcjonalna do stężenia jonu wodnego, [A].
- .
Stała proporcjonalności k nazywana jest stałą szybkości pierwszego rzędu w temperaturze T. Jednostką szybkości reakcji wymiany wody jest zwykle mol dm −3 s −1 .
Okres półtrwania dla tej reakcji jest równy log e 2 / k. Ta wielkość z wymiarem czasu jest użyteczna, ponieważ jest niezależna od koncentracji. Wielkość 1/k, również z wymiarem czasu, równa okresowi półtrwania podzielonemu przez 0,6932, jest znana jako czas przebywania lub stała czasowa .
Czas przebywania dla wymiany wody waha się od około 10-10 s dla Cs + do około 10 +10 s (ponad 200 y ) dla Ir 3+ . Zależy to od takich czynników, jak rozmiar i ładunek jonu oraz, w przypadku jonów metali przejściowych, efekty pola krystalicznego . Bardzo szybkie i bardzo wolne reakcje są trudne do zbadania. Najwięcej informacji na temat kinetyki wymiany wody pochodzi z systemów o czasie przebywania pomiędzy około 1 μs a 1 s. Entalpia i entropia aktywacji, ΔH ‡ i ΔS ‡ można uzyskać obserwując zmiany stałej szybkości wraz z temperaturą.
Parametry kinetyczne (przy 25 °C) wymiany wody: jony dwuwartościowe, M 2+ (aq) Być Mg V Kr Mn Fe Współ Ni Cu zn UO 2 Czas przebywania (μs) 0,001 2 0,00013 0,0032 0,0316 0,32 0,79 40 0,0005 0,032 1.3 ΔH ‡ (kJ mol −1 ) 43 69 13 34 32 33 43 23 ΔS ‡ (J stopień −1 mol −1 ) 8 21 -13 12 -13 -17 -22 25
Zwróć uwagę na ogólny wzrost czasu przebywania od wanadu do niklu, który odzwierciedla zmniejszanie się wielkości jonów wraz ze wzrostem liczby atomowej, co jest ogólną tendencją w układzie okresowym pierwiastków, chociaż nadano mu specyficzną nazwę tylko w przypadku skurczu lantanowców . Efekty pola krystalicznego nakładają się na okresowy trend.
Parametry kinetyczne (przy 25 °C) wymiany wody - jony trójwartościowe, M 3+ (aq) Glin Ti Kr Fe Ga Rh W La czas przebywania (μs) 6,3×10 6 16 2,0×10 12 316 501 3,2×10 13 50 0,050 ΔH ‡ (kJ mol −1 ) 11 26 109 37 26 134 17 ΔS ‡ (J stopień −1 mol −1 ) 117 -63 0 -54 -92 59
Wymiana rozpuszczalnika jest generalnie wolniejsza w przypadku jonów trójwartościowych niż w przypadku jonów dwuwartościowych, ponieważ wyższy ładunek elektryczny kationu powoduje silniejsze wiązanie M-OH 2 , aw konsekwencji wyższą energię aktywacji dla etapu reakcji dysocjacji, [M(H 2 O) n ] 3+ → [M(H 2 O) n-1 ] 3+ + H 2 O. Wartości w tabeli pokazują, że jest to spowodowane zarówno entalpią aktywacji, jak i współczynnikami entropii.
Jon [Al(H 2 O) 6 ] 3+ jest stosunkowo obojętny na reakcje podstawienia, ponieważ jego elektrony znajdują się w konfiguracji elektronowej z zamkniętą powłoką, [Ne]3s 2 3p 6 , co powoduje, że dysocjacja jest reakcją kosztowną energetycznie. Cr 3+ , który ma strukturę oktaedryczną i konfigurację elektronową ad 3 , jest również stosunkowo obojętny, podobnie jak Rh 3+ i Ir 3+ , które mają konfigurację d6 o niskim spinie .
Tworzenie kompleksów
Jony metali często biorą udział w tworzeniu kompleksów . Reakcję można zapisać jako
- pM x+ (aq) + qL y− → [M p L q ] (px-qy)+
W rzeczywistości jest to reakcja podstawienia, w której jedna lub więcej cząsteczek wody z pierwszej powłoki hydratacyjnej jonu metalu jest zastępowana przez ligandy L. Kompleks jest opisany jako kompleks sfery wewnętrznej. Kompleks taki jak [ML] (pq)+ można opisać jako kontaktową parę jonową .
Kiedy cząsteczka (cząsteczki) wody drugiej powłoki hydratacyjnej zostanie zastąpiona przez ligandy, mówi się, że kompleks jest kompleksem sfery zewnętrznej lub parą jonową współdzieloną z rozpuszczalnikiem. Tworzenie par jonowych współdzielonych z rozpuszczalnikiem lub kontaktowych jest szczególnie istotne przy określaniu liczby solwatacji jonów wodnych metodami wymagającymi użycia stężonych roztworów soli, ponieważ parowanie jonów jest zależne od stężenia. Rozważmy na przykład powstawanie kompleksu [MgCl] + w roztworach MgCl 2 . Stała formacji K kompleksu wynosi około 1, ale zmienia się wraz z siłą jonową. Stężenie raczej słabego kompleksu wzrasta od około 0,1% dla roztworu 10mM do około 70% dla roztworu 1M (1M = 1 mol dm- 3 ).
Elektrochemia
Standardowy potencjał elektrody dla równowagi półogniwa M z + + z e − ⇌ M ( s ) został zmierzony dla wszystkich metali z wyjątkiem najcięższych pierwiastków transuranowych.
Standardowe potencjały elektrod /V dla par M z+ /M(s) H +
0
Li + −3,040
Bądź 2+ −1,85
Na + -2,71
Mg2 + −2,372
A13 + −1,66
K + −2,931
Ca 2+ −2,868
Pc 3+ −2,90...
Zn2 + −0,751
Ga 3+ −0,53
Rdz 2+ +0,1
Rb + −2,98
Sr 2+ −2,899
Y 3+ −2,37...
CD2 + −0,403
W 3+ −0,342
Sn2 + −0,136
Sb 3+ +0,15
CS + −3,026
Ba 2+ −2,912
Łk 3+ −2,25...
Hg 2+ −0,854
Tl 3+ +0,73
Pb2 + −0,126
Bi 3+ +0,16
Po 4+ +0,76
Fr + −2,9
Ra 2+ −2,8
Lr 3+ −1,96
La 3+ −2,52
Ce 3+ −2,32
Pr 3+ −2,34
Sd 3+ −2,32
Ppm 3+ −2,30
Sm 3+ −2,28
UE 3+ −1,98
Gd 3+ −2,27
Tb 3+ −2,27
Dy 3+ −2,32
Ho 3+ −2,37
Er 3+ −2,33
Tm 3+ −2,30
Yb 3+ −2,23
Dz 3+ −2,18
Cz 4+ −1,83
Pa 4+ −1,46
U 4+ −1,51
Np 4+ −1,33
Pu 4+ −1,80
Poprawka 3+ −2.06
cm3 + −2,07
Bk 3+ −2,03
Por. 3+ −2.01
Es 3+ −1,99
Fm 3+ −1,97
Md 3+ −1,65
Nr 3+ −1,20
Standardowe potencjały elektrod /V dla 1. jony metali przejściowych rzędu Para Ti V Kr Mn Fe Współ Ni Cu M 2+ / M −1,63 −1,18 −0,91 −1,18 −0,473 −0,28 −0,228 +0,345 M 3+ / M −1,37 −0,87 −0,74 −0,28 −0,06 +0,41
Różne standardowe potencjały elektrod /V Ag + / Ag Pd 2+ / Pd Pkt 2+ / Pkt Zr 4+ / Zr HF 4+ / HF Au 3+ / Au Ce 4+ / Ce +0,799 +0,915 +1.18 −1,53 −1,70 +1,50 −1,32
Ponieważ standardowy potencjał elektrody jest bardziej ujemny, jon wodny jest trudniejszy do zredukowania . Na przykład porównując potencjały cynku (-0,75 V) z potencjałami żelaza (Fe(II) -0,47 V, Fe(III) -0,06 V) widać, że jony żelaza ulegają łatwiejszej redukcji niż jony cynku. Jest to podstawa do zastosowania cynku do ochrony anodowej dużych konstrukcji wykonanych z żeliwa lub do ochrony małych konstrukcji metodą cynkowania .
Bibliografia
- Baes, CF; Mesmer, RE (1986) [1976]. Hydroliza kationów . Malabar, Floryda: Robert E. Krieger. ISBN 978-0-89874-892-5 .
- Burgess, Jan (1978). Jony metali w roztworze . Chichester: Ellis Horwood. ISBN 978-0-85312-027-8 .
- Richens, Dawid. T. (1997). Chemia jonów wodnych . Wileya. ISBN 978-0-471-97058-3 .
- Stumm, Werner; Morgan, James J. (1995). Chemia wodna - równowaga chemiczna i stawki w wodach naturalnych (wyd. 3). Wiley-Blackwell. ISBN 978-0-471-51185-4 .
- Schweitzer, George K.; Pesterfield, Lester L. (2010). Chemia wodna pierwiastków . Oksford: OUP. ISBN 978-0-19-539335-4 .
Dalsza lektura
- HL Friedman, F. Franks, Roztwory wodne prostych elektrolitów, Springer; przedruk wydania z 1973 r., 2012 r. ISBN 1468429574





![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,-1}\{{\ce {M}}^{z+}\}\{{\ce {H}}^{+}\}^{-1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e176d25b98e44f238e312388c7778c2dd0da6fa5)
![{\displaystyle \{[{\ce {M(OH)}}]^{(z-1)+}\}=K_{1,1}\{{\ce {M}}^{z+}\}\{{\ce {OH}}^{-}\}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd140779b1efcea8279dd45e357bccbb9703423e)

![{\displaystyle [{\ce {M}}_{x}({\ce {OH}})_{y}]=\beta _{x,-y}*[{\ce {M}}]^{x}[{\ce {H}}]^{-y}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a0f51eff3529039469fab7a042189cb722207509)




![{\mathrm {rate}}=-\left({\frac {d[A]}{dt}}\right)_{T}=k[A]](https://wikimedia.org/api/rest_v1/media/math/render/svg/b55c4231b71d8a68c7ed0c741392e23a2ae8c18b)