Pseudopterozyna A

|
|
| Nazwy | |
|---|---|
|
nazwa IUPAC
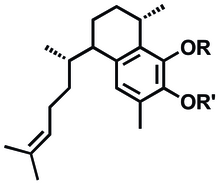
(3S , 7R , 9S , 9aR ) -5-hydroksy-3,6,9-trimetylo-7-(2-metyloprop-1-en-1-ylo)-2,3,7,8, 9,9a-heksahydro-1H - fenalen-4-ylo β- D -ksylopiranozyd
|
|
|
Preferowana nazwa IUPAC
(2S , 3R , 4S , 5R ) -2-{[(3S , 7R , 9S , 9aR ) -5-hydroksy-3,6,9-trimetylo-7-(2-metyloprop -1-en-1-ylo)-2,3,7,8,9,9a-heksahydro-1H - fenalen-4-ylo]oksy}oksano-3,4,5-triol |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CHEMBL | |
| ChemSpider | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
|
|
|
| Nieruchomości | |
| C25H36O6 _ _ _ _ _ | |
| Masa cząsteczkowa | 432,557 g · mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w stanie normalnym (przy 25°C [77°F], 100 kPa).
|
|
Pseudopterozyna A to glikozyd diterpenowy wyizolowany z bicza morskiego gorgonian Antillogorgia elisabethae , znalezionego na Bahamach i Florida Keys. Pseudopterozyny AD, które różnią się stopniem acetylacji w pierścieniu cukrowym, zostały po raz pierwszy wyizolowane i opisane w 1986 roku. Istnieje co najmniej 25 unikalnych diterpenów wyizolowanych z tego gatunku zwierząt morskich. próbki P. elisabethae z Bahamów mają wyższe stężenia pseudopterosyn niż populacje z Florida Keys, które mają większą różnorodność struktur diterpenowych.
Używa
Pseudopterozyny mają działanie przeciwzapalne i przeciwbólowe, a ich mechanizm działania różni się od zwykłych niesteroidowych leków przeciwzapalnych, NLPZ . Komercyjnie pseudopterozyny znajdują się w kremach do skóry jako miejscowe środki przeciwzapalne.
Biosynteza
Elisabethatriene ( 2 ) został zidentyfikowany jako kluczowy związek pośredni do syntezy klasy pseudopterozyn i seco -pseudopterozyn. Proponowany szlak mechanistyczny syntezy elisabetatrienu z pirofosforanu geranylogeranylu (GGPP, 1 ) opisano poniżej. Syntaza elisabetatrienowa, enzym cyklazy diterpenowej, katalizuje przemianę GGPP diterpenu w 10-członowy szkielet węglowy, a następnie migrację wodorków w kierunku bicyklicznego układu pierścieniowego. Ten enzym cyklazy został zidentyfikowany jako kluczowy enzym w tworzeniu szkieletu węglowego pseudopterosyn w jednym etapie. Zaproponowano alternatywny mechanizm, w którym najpierw tworzy się sześcioczłonowy pierścień, a następnie drugi pierścień zamykający się dla układu bicyklicznego.
Biosynteza pseudopterozyn jest kontynuowana przez aromatyzację do erogorgiaenu ( 3 ), dwa utleniania do dihydroksyerogorgiaenu ( 4 , następnie 5 ) i kolejne utlenianie do orto-hydroksychinonu ( 6 ). Zamknięcie pierścienia ( 7 ), ponowna aromatyzacja do ( 8 ) i glikozylacja dają Pseudopterozynę A ( 9 ). Jest to prawdopodobny szlak biosyntezy, a półprodukty 2 , 3 , 6 , 7 i 8 zostały zidentyfikowane za pomocą badań znakowania radiowego. Zaproponowano alternatywny mechanizm bez pośredniego hydroksychinonu ( 6 ). Zamiast tego cząsteczka 3 przechodzi dwa kolejne utleniania w C-6 i C-7 do struktury przypominającej 8 , a następnie glikozylację do pseudopterozyny.
Punkt rozgałęzienia dla biosyntezy tricyklicznych pseudopterozyn w porównaniu z bicyklicznymi seco -pseudopterozynami występuje w związku 11 , aromatyzowanym bicyklowym erogorgiaenie. 11 jest raz utleniany, a następnie hydroksylowany, a następnie glikozylowany, z wytworzeniem bicyklicznych seco -pseudopterozyn.
Proponowana synteza sztucznych metabolitów przeciwzapalnych jest wzorowana na pseudopterozynach i oparta na bicyklicznej strukturze seco -pseudopterozyny 6 .