Guz M2-PK
Guz M2-PK jest synonimem dimerycznej postaci izoenzymu kinazy pirogronianowej typu M2 ( PKM2 ), kluczowego enzymu w metabolizmie guza . M2-PK guza może być podwyższona w wielu typach nowotworów, zamiast być markerem nowotworu specyficznym dla narządu , takim jak PSA . Podwyższone poziomy w stolcu (kału) są badane jako metoda badań przesiewowych w kierunku nowotworów jelita grubego , a poziomy EDTA w osoczu są poddawane testom pod kątem możliwego zastosowania w obserwacji różnych nowotworów .
testy kanapkowe ELISA oparte na dwóch przeciwciałach monoklonalnych , które specyficznie rozpoznają M2-PK guza (dimeryczna postać M2-PK) do ilościowego oznaczania M2-PK guza odpowiednio w próbkach kału iw próbkach osocza z EDTA. Jako biomarker , ilość M2-PK guza w kale i osoczu z EDTA odzwierciedla specyficzny status metaboliczny guza.
Wczesne wykrywanie guzów i polipów jelita grubego
M2-PK, mierzona w kale , jest potencjalnym markerem nowotworowym raka jelita grubego . Przy pomiarze w kale z wartością odcięcia 4 U/ml czułość oszacowano na 85% (z 95% przedziałem ufności od 65 do 96%) w przypadku raka okrężnicy i 56% (przedział ufności 41–74%) na raka odbytnicy. Jego specyficzność wynosi 95%.
Test M2-PK nie jest zależny od krwi utajonej ( metoda ELISA ), dzięki czemu może wykryć krwawiącego lub niekrwawiącego raka jelita grubego, a także polipy z dużą czułością i wysoką swoistością bez wyników fałszywie ujemnych, ale mogą wystąpić wyniki fałszywie dodatnie.
Większość ludzi chętniej akceptuje nieinwazyjne badania profilaktyczne. Dlatego pomiar M2-PK guza w próbkach kału, z kontynuacją za pomocą kolonoskopii w celu wyjaśnienia pozytywnych wyników guza M2-PK, może okazać się postępem we wczesnym wykrywaniu raka jelita grubego. Test M2-PK z oznaczeniem CE jest dostępny w formie testu ELISA do uzyskania wyników ilościowych lub jako test punktowy, aby otrzymać wynik w ciągu kilku minut.
Guz M2-PK jest również przydatny do diagnozowania raka płuc i lepszy niż markery nowotworowe SCC i NSE . W przypadku raka nerkowokomórkowego (RCC) test M2PK ma czułość 66,7% dla RCC z przerzutami i 27,5% dla RCC bez przerzutów, ale test M2PK nie może wykryć raka przejściowokomórkowego pęcherza moczowego, raka gruczołu krokowego i łagodnego rozrostu gruczołu krokowego.
Śledzenie raka
Badania różnych międzynarodowych grup roboczych wykazały znacznie zwiększoną ilość M2-PK guza w próbkach osocza EDTA pacjentów z nowotworami nerek, płuc, piersi, szyjki macicy i przewodu pokarmowego (przełyku, żołądka, trzustki, okrężnicy, odbytnicy), jak również czerniaka, co korelowało ze stopniem zaawansowania nowotworu .
Połączenie Tumor M2-PK z odpowiednim klasycznym markerem nowotworowym, takim jak CEA dla raka jelita grubego, CA 19-9 dla raka trzustki i CA 72-4 dla raka żołądka, znacznie zwiększa czułość wykrywania różnych nowotworów.
Ważnym zastosowaniem testu Tumor M2-PK w osoczu z EDTA jest obserwacja podczas leczenia nowotworu, monitorowanie powodzenia lub niepowodzenia wybranego leczenia, a także przewidywanie szans na „wyleczenie” i przeżycie.
Jeśli poziomy M2-PK guza zmniejszają się podczas terapii, a następnie pozostają niskie po zakończeniu terapii, wskazuje to na pomyślne leczenie. Wzrost wartości M2-PK guza podczas lub po terapii wskazuje na nawrót i/lub przerzuty.
Podwyższone wartości M2-PK guza mogą czasami wystąpić również w ciężkich chorobach zapalnych , które należy wykluczyć w diagnostyce różnicowej.
Tetrameryczny i dimeryczny PKM2
Kinaza pirogronianowa katalizuje ostatni etap sekwencji glikolitycznej , defosforylację fosfoenolopirogronianu do pirogronianu i jest odpowiedzialna za wytwarzanie energii netto w szlaku glikolitycznym. W zależności od różnych funkcji metabolicznych tkanek, wyrażane są różne izoenzymy kinazy pirogronianowej.
M2-PK ( PKM2 ) jest dominującą izoformą kinazy pirogronianowej w proliferujących komórkach, takich jak fibroblasty , komórki embrionalne i dorosłe komórki macierzyste oraz większość tkanek ludzkich, w tym płuca, pęcherz moczowy, nerki i grasica; M2-PK ulega zwiększonej ekspresji w wielu ludzkich nowotworach.
M2-PK może występować w dwóch różnych formach w proliferujących komórkach:
- forma tetrameryczna, która składa się z czterech podjednostek
- forma dimeryczna, składająca się z dwóch podjednostek.
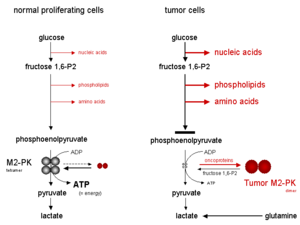
Tetrameryczna forma M2-PK ma wysokie powinowactwo do swojego substratu, fosfoenolopirogronianu (PEP) i jest wysoce aktywna w fizjologicznych stężeniach PEP. Ponadto tetrameryczna postać M2-PK jest związana z kilkoma innymi enzymami glikolitycznymi w ramach tak zwanego kompleksu enzymów glikolitycznych . Ze względu na bliskie sąsiedztwo enzymów, asocjacja w kompleksie enzymów glikolitycznych prowadzi do wysoce skutecznej konwersji glukozy do mleczanu. Kiedy M2-PK występuje głównie w wysoce aktywnej postaci tetramerycznej, co ma miejsce w większości normalnych komórek, glukoza jest głównie przekształcana w mleczan, z towarzyszącą produkcją energii.
W przeciwieństwie do tego, dimeryczna postać M2-PK ma niskie powinowactwo do fosfoenolopirogronianu, będąc prawie nieaktywną przy fizjologicznych stężeniach PEP. Kiedy M2-PK występuje głównie w postaci dimerycznej, co ma miejsce w komórkach nowotworowych, wszystkie fosfometabolity powyżej kinazy pirogronianowej gromadzą się i są kierowane do procesów syntezy, które odchodzą od glikolitycznych związków pośrednich, takich jak kwasy nukleinowe, fosfolipidy i aminokwasy , ważne komórki budulcowe dla wysoce proliferujących komórek, takich jak komórki nowotworowe.
W konsekwencji kluczowej pozycji kinazy pirogronianowej w glikolizie, stosunek tetrameru do dimeru M2-PK określa, czy węgle glukozy są przekształcane w pirogronian i mleczan wraz z produkcją energii (forma tetrameryczna), czy kierowane do procesów syntezy ( forma dimeryczna). W komórkach nowotworowych M2-PK występuje głównie w formie dimerycznej. Dlatego dimeryczna postać M2-PK została nazwana M2-PK nowotworu .
Dimeryzacja M2-PK w komórkach nowotworowych jest indukowana przez bezpośrednią interakcję M2-PK z różnymi onkoproteinami .
Jednak stosunek tetrameru do dimeru M2-PK nie jest stały.
Głód tlenu lub silnie nagromadzone glikolityczne związki pośrednie, takie jak 1,6-bisfosforan fruktozy (fruktoza 1,6-P2) lub aminokwas seryna, indukują ponowne połączenie formy dimerycznej M2-PK z formą tetrameryczną. W konsekwencji, w wyniku aktywacji M2-PK, glukoza jest przekształcana w pirogronian i mleczan w ramach produkcji energii, aż poziom fruktozy 1,6-P2 spadnie poniżej pewnej wartości progowej, co pozwala na dysocjację tetramerycznej postaci M2-PK PK do postaci dimerycznej. Następnie cykl oscylacji rozpoczyna się ponownie, gdy poziomy fruktozy 1,6-P2 osiągają pewną górną wartość progową, która indukuje tetrameryzację M2-PK.
Kiedy M2-PK występuje głównie w mniej aktywnej formie dimerycznej, energia jest wytwarzana przez degradację aminokwasu glutaminy do asparaginianu, pirogronianu i mleczanu, co nazywa się glutaminolizą .
W komórkach nowotworowych zwiększona szybkość produkcji mleczanu w obecności tlenu nazywana jest efektem Warburga .
Mutacje
Po raz pierwszy opisano enzym kinazę pirogronianową M2 z dwiema mutacjami zmiany sensu, H391Y i K422R, znalezionymi w komórkach pacjentów z zespołem Blooma , podatnych na rozwój raka. Wyniki pokazują, że pomimo obecności mutacji w domenie kontaktu między podjednostkami, zmutowane białka K422R i H391Y zachowały swoją strukturę homotetrameryczną, podobną do białka typu dzikiego, ale wykazywały utratę aktywności odpowiednio o 75 i 20%. H391Y wykazywał 6-krotny wzrost powinowactwa do swojego substratu fosfoenolopirogronianu i zachowywał się jak białko nieallosteryczne z upośledzonym wiązaniem kooperacyjnym. Jednak powinowactwo do fosfoenolopirogronianu zostało znacząco utracone w K422R. W przeciwieństwie do K422R, H391Y wykazywał zwiększoną stabilność termiczną, stabilność w zakresie wartości pH, mniejszy wpływ allosterycznego inhibitora Phe i odporność na zmiany strukturalne po związaniu aktywatora (1,6-bisfosforanu fruktozy) i inhibitora (Phe). Oba mutanty wykazywały nieznaczne przesunięcie optimum pH z 7,4 na 7,0. Koekspresja homotetramerycznego typu dzikiego i zmutowanego PKM2 w środowisku komórkowym, skutkująca interakcją między nimi na poziomie monomeru, została dodatkowo potwierdzona w doświadczeniach in vitro. Interakcja między monomerami znacząco zmieniła stan oligomeryczny PKM2, faworyzując dimeryzację i heterotetrameryzację. Badanie in silico dostarczyło dodatkowego wsparcia w wykazaniu, że heterooligomeryzacja była korzystna energetycznie. Heterooligomeryczne populacje PKM2 wykazywały zmienioną aktywność i powinowactwo, a ich ekspresja skutkowała zwiększonym tempem wzrostu Escherichia coli, jak również komórek ssaków, wraz ze zwiększonym tempem poliploidii. Wiadomo, że te cechy są niezbędne do progresji nowotworu.
Potencjalne białko wielofunkcyjne
Zobacz też
Stołek
- Hardt PD, Mazurek S, Toepler M, Schlierbach P, Bretzel RG, Eigenbrodt E, Kloer HU (2004). „Kinaza pirogronianowa M2 guza kału: nowe, czułe narzędzie do badań przesiewowych w kierunku raka jelita grubego. Brit. J” . Rak . 91 (5): 980–984. doi : 10.1038/sj.bjc.6602033 . PMC 2409989 . PMID 15266315 .
- Koss K, Maxton D, Jankowski JAZ. Potencjalne zastosowanie kałowej dimerycznej kinazy pirogronianowej M2 (Tumor M2-PK) w badaniach przesiewowych w kierunku raka jelita grubego (CRC). Abstrakt z Tygodnia Chorób Pokarmowych, maj 2005; Chicago, Stany Zjednoczone.
- Mc Loughlin R, Shiel E, Sebastian S, Ryan B, O'Connor HJ, O'Morain C. Tumor M2-PK, nowatorskie narzędzie do badań przesiewowych w kierunku raka jelita grubego. Abstrakt z Tygodnia Chorób Pokarmowych, maj 2005, Chicago/USA
Osocze
- Cerwenka H, Aigner R, Bacher H, Werkgartner G, El-Shabrawi A, Quehenberger F, Mischinger HJ (1999). „TUM2-PK (nowotwór typu kinazy pirogronianowej M2), CA19-9 i CEA u pacjentów z łagodnymi, złośliwymi i przerzutowymi zmianami trzustkowymi”. Przeciwnowotworowe Res. 19 (1B): 849–52. PMID 10216504 .
- Kaura B, Bagga R, Patel FD (2004). „Ocena guza izoenzymu kinazy pirogronianowej (Tu M2-PK) jako markera nowotworowego raka szyjki macicy”. J. Obstet. Ginekol. Rez. 30 (3): 193–196. doi : 10.1111/j.1447-0756.2004.00187.x . PMID 15210041 . S2CID 31214841 .
- Kim CW, Kim JI, Park SH i in. (listopad 2003). „Przydatność plazmatycznej kinazy pirogronianowej M2 w diagnostyce raka przewodu pokarmowego”. Koreański Dziennik Gastroenterologii = Taehan Sohwagi Hakhoe Chi . 42 (5): 387–93. PMID 14646575 .
- Lüftner D, Mesterharm J, Akrivakis C, Geppert R, Petrides PE, Wernecke KD, Possinger K (2000). „Ekspresja kinazy pirogronianowej M2 guza w zaawansowanym raku piersi”. Przeciwnowotworowe Res. 20 (6D): 5077–5082. PMID 11326672 .
- Oremek GM, Teigelkamp S, Kramer W, Eigenbrodt E, Usadel KH (1999). „Kinaza pirogronianowa izoenzymu nowotworu M2 (Tu M2-PK) jako marker nowotworowy raka nerki”. Przeciwnowotworowe Res. 19 (4A): 2599–2601. PMID 10470201 .
- Schneider J, Morr H, Velcovsky HG, Weisse G, Eigenbrodt E (2000). „Ilościowe wykrywanie nowotworowej kinazy pirogronianowej M2 w osoczu pacjentów z rakiem płuc w porównaniu z innymi chorobami płuc”. Wykrywanie i zapobieganie rakowi . 24 (6): 531–5. PMID 11198266 .
- Schneider J, Schulze G (2003). „Porównanie kinazy pirogronianowej M2 guza (guza M2-PK), antygenu rakowo-płodowego (CEA), antygenów węglowodanowych CA 19-9 i CA 724 w diagnostyce raka przewodu pokarmowego”. Przeciwnowotworowe Res. 23 (6D): 5089–5095. PMID 14981971 .
- Ugurel S, Bell N, Sucker A, Zimfer A, Rittgen W, Schadendorf D (2005). „Kinaza pirogronianowa typu M2 guza (TuM2-PK) jako nowy marker nowotworowy w osoczu w czerniaku” . Int. J. Rak . 117 (5): 825–830. doi : 10.1002/ijc.21073 . PMID 15957165 .
- Ventrucci M, Cipolla A, Racchini C, Casadei R, Simoni P, Gullo L (2004). „Kinaza pirogronianowa M2 guza, nowy marker metaboliczny raka trzustki”. Kopać. Dis. nauka 49 (7–8): 1149–1155. doi : 10.1023/B:DDAS.0000037803.32013.aa . PMID 15387337 . S2CID 1237419 .
- Wechsel HW, Petri E, Bichler KH, Feil G (1999). „Marker raka nerki (RCC): dimeryczna postać kinazy pirogronianowej typu M2 (Tu M2-PK)”. Przeciwnowotworowe Res. 19 (4A): 2583–2590. PMID 10470199 .
- Zhang B, Chen JY, Chen DD, Wang GB, Shen P (2004). „Ekspresja kinazy pirogronianowej guza typu M2 w raku żołądka, raku jelita grubego i kontrolach” . Świat J. Gastroenterol. 10 (11): 1643–1646. doi : 10.3748/wjg.v10.i11.1643 . PMC 4572770 . PMID 15162541 .
Tło naukowe
- Mazurek S, Boschek CB, Hugo F, Eigenbrodt E (2005). „Kinaza pirogronianowa typu M2 i jej rola we wzroście i rozprzestrzenianiu się guza”. Semin. Biol raka . 15 (4): 300–308. doi : 10.1016/j.semcancer.2005.04.009 . PMID 15908230 .