Fosforuktokinaza 2
| 6-fosfofrukto-2-kinaza Dimer | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 6-fosfofrukto-2-kinazy,
| |||||||||
| Identyfikatory ludzkiego serca | |||||||||
| nr WE | 2.7.1.105 | ||||||||
| nr CAS | 78689-77-7 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
| 6PF2K | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ludzkiej wątroby 6-fosfofrukto-2-kinaza/fruktozo-2,6-bisfosfataza
| |||||||||
| Identyfikatory | |||||||||
| Symbol | 6PF2K | ||||||||
| Pfam | PF01591 | ||||||||
| Klan Pfam | CL0023 | ||||||||
| InterPro | IPR013079 | ||||||||
| PROZYTA | PDOC00158 | ||||||||
| SCOP2 | 1bif / ZAKRES / SUPFAM | ||||||||
| |||||||||
| 6-fosfofrukto-2-kinaza/fruktozo-bisfosfataza-2 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 Struktura PFK2. Pokazano: domena kinazy (cyjan) i domena fosfatazy (zielona).
| |||||||||||
| Identyfikatory | |||||||||||
| Symbol | 6PF2K | ||||||||||
| Pfam | PF01591 | ||||||||||
| InterPro | IPR013079 | ||||||||||
| PROZYTA | PDOC00158 | ||||||||||
| SCOP2 | 1bif / ZAKRES / SUPFAM | ||||||||||
| |||||||||||
| identyfikatory | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| fruktozo-bisfosfatazy-2 | |||||||||
| Symbol | FBPaza-2 | ||||||||
| Pfam | PF00316 | ||||||||
| InterPro | IPR028343 | ||||||||
| PROZYTA | PDOC00114 | ||||||||
| |||||||||
Fosforuktokinaza-2 ( 6-fosfofrukto-2-kinaza , PFK-2 ) lub bisfosfataza fruktozowa-2 ( FBPaza-2 ), jest enzymem pośrednio odpowiedzialnym za regulację tempa glikolizy i glukoneogenezy w komórkach. Katalizuje tworzenie i degradację istotnego regulatora allosterycznego, fruktozo-2,6-bisfosforanu (Fru-2,6-P 2 ) z substratu fruktozo-6-fosforanowego . Fru-2,6-P 2 przyczynia się do etapu determinującego szybkość glikolizy, ponieważ aktywuje enzym fosfofruktokinazę 1 na szlaku glikolizy i hamuje fruktozo-1,6-bisfosfatazę 1 w glukoneogenezie. Ponieważ Fru-2,6-P 2 w różny sposób reguluje glikolizę i glukoneogenezę, może działać jako kluczowy sygnał do przełączania między przeciwnymi szlakami. Ponieważ PFK-2 wytwarza Fru-2,6-P 2 w odpowiedzi na sygnalizację hormonalną, metabolizm może być precyzyjniej i wydajniej kontrolowany, aby dostosować się do potrzeb glikolitycznych organizmu. Enzym ten uczestniczy we fruktozie i metabolizm mannozy . Enzym ten jest ważny w regulacji metabolizmu węglowodanów w wątrobie i występuje w największych ilościach w wątrobie, nerkach i sercu . U ssaków kilka genów często koduje różne izoformy, z których każda różni się rozmieszczeniem w tkankach i aktywnością enzymatyczną . Opisana tutaj rodzina jest podobna do fosfofruktokinaz kierowanych przez ATP, jednak mają one niewielką sekwencję podobieństwo, chociaż kilka reszt wydaje się kluczowych dla ich interakcji z fruktozo-6-fosforanem .
PFK-2 jest znany jako „enzym dwufunkcyjny” ze względu na swoją godną uwagi strukturę: chociaż oba znajdują się na jednym homodimerze białka , jego dwie domeny działają jako niezależnie funkcjonujące enzymy. Jeden koniec służy jako kinazy (dla PFK-2), podczas gdy drugi koniec działa jako domena fosfatazy (FBPase-2).
U ssaków mechanizmy genetyczne kodują różne izoformy PFK-2 , aby dostosować się do specyficznych potrzeb tkanki. Podczas gdy ogólna funkcja pozostaje taka sama, izoformy charakteryzują się niewielkimi różnicami we właściwościach enzymatycznych i są kontrolowane przez różne metody regulacji; różnice te omówiono poniżej.
Struktura
Monomery bifunkcjonalnego białka są wyraźnie podzielone na dwie domeny funkcjonalne. Domena kinazy znajduje się na N-końcu. Składa się z centralnego sześcioniciowego arkusza β, z pięcioma równoległymi pasmami i antyrównoległym pasmem brzegowym, otoczonym siedmioma helisami α. Domena zawiera fałd wiążący nukleotyd (nbf) na C-końcu pierwszej nici β. Domena PFK-2 wydaje się być blisko spokrewniona z nadrodziną białek wiążących mononukleotydy, w tym z cyklazą adenylanową .
Z drugiej strony domena fosfatazy znajduje się na C-końcu. Przypomina rodzinę białek, które obejmują mutazy fosfoglicerynianowe i kwaśne fosfatazy. Domena ma mieszaną strukturę α/β, z sześcioniciowym centralnym arkuszem β oraz dodatkową subdomeną α-helikalną, która obejmuje domniemane miejsce aktywne cząsteczki. Wreszcie region N-końcowy moduluje aktywność PFK-2 i FBPazy2 oraz stabilizuje postać dimeru enzymu.
Chociaż ten centralny rdzeń katalityczny pozostaje konserwowany we wszystkich formach PFK-2, istnieją niewielkie różnice strukturalne w izoformach w wyniku różnych sekwencji aminokwasów lub alternatywnego składania. Z kilkoma drobnymi wyjątkami wielkość enzymów PFK-2 wynosi zwykle około 55 kDa.
Naukowcy stawiają hipotezę, że unikalna dwufunkcyjna struktura tego enzymu powstała w wyniku fuzji genów między pierwotnym bakteryjnym PFK-1 a pierwotną mutazą/fosfatazą.
Funkcjonować
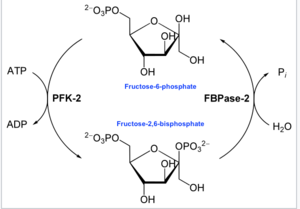
Główną funkcją tego enzymu jest synteza lub degradacja regulatora allosterycznego Fru-2,6-P 2 w odpowiedzi na potrzeby glikolityczne komórki lub organizmu, jak przedstawiono na załączonym schemacie.
W enzymologii 6-fosfofrukto-2-kinaza ( EC 2.7.1.105 ) jest enzymem , który katalizuje reakcję chemiczną :
- ATP + beta-D-fruktozo-6-fosforan ADP + beta-D-fruktozo-2,6-bisfosforan
Zatem domena kinazy hydrolizuje ATP w celu fosforylacji węgla-2 fruktozo-6-fosforanu, wytwarzając Fru-2,6-P2 i ADP . W reakcji powstaje półprodukt fosfohistydyny.
- Na drugim końcu domena fruktozo-2,6-bisfosforano-2-fosfatazy ( EC 3.1.3.46 ) defosforyluje Fru-2,6-P2 z dodatkiem wody. Ta przeciwna reakcja chemiczna to:
- 2,6-bisfosforan beta-D-fruktozy + H 2 O D-fruktozo-6-fosforan + fosforan
Ze względu na podwójne funkcje enzymu można go podzielić na wiele rodzin. Poprzez kategoryzację według reakcji kinazy, enzym ten należy do rodziny transferaz , w szczególności tych przenoszących grupy zawierające fosfor ( fosfotransferazy ) z grupą alkoholową jako akceptorem. Z drugiej strony reakcja fosfatazy jest charakterystyczna dla rodziny hydrolaz , w szczególności tych działających na wiązania monoestrowe fosforu .
Rozporządzenie
W prawie wszystkich izoformach PFK-2 podlega kowalencyjnej modyfikacji poprzez fosforylację/defosforylację w oparciu o sygnalizację hormonalną komórki. Fosforylacja określonej reszty może wywołać przesunięcie, które stabilizuje funkcję domeny kinazy lub fosfatazy. Ten sygnał regulacyjny kontroluje zatem, czy F-2,6-P2 będzie syntetyzowany czy degradowany.
Ponadto allosteryczna regulacja PFK2 jest bardzo podobna do regulacji PFK1 . Wysoki poziom AMP lub grupy fosforanowej oznacza stan ładunku o niskiej energii, a tym samym stymuluje PFK2. Z drugiej strony wysokie stężenie fosfoenolopirogronianu (PEP) i cytrynianu oznacza wysoki poziom prekursora biosyntezy, a tym samym hamuje PFK2. W przeciwieństwie do PFK1, PFK2 nie zależy od stężenia ATP.
izozymy
Izozymy białek to enzymy, które katalizują tę samą reakcję, ale są kodowane różnymi sekwencjami aminokwasowymi i jako takie wykazują niewielkie różnice we właściwościach białek. U ludzi cztery geny kodujące białka fosfofruktokinazy 2 obejmują PFKFB-1 , PFKFB2 , PFKFB3 i PFKFB4 .
Do tej pory opisano wiele izoform białka ssaków, z których różnica wzrasta albo w wyniku transkrypcji różnych enzymów, albo alternatywnego splicingu. Podczas gdy rdzeń strukturalny, który katalizuje reakcję PFK-2/FBPaza-2, jest wysoce konserwatywny we wszystkich izoformach, główne różnice wynikają z wysoce zmiennych sekwencji flankujących w izoformach na końcach aminowych i karboksylowych. Ponieważ obszary te często zawierają miejsca fosforylacji, zmiany w składzie aminokwasów lub długości końcowej mogą powodować bardzo różne kinetyki i właściwości enzymów. Każdy wariant różni się pierwotną tkanką ekspresji, odpowiedzią na regulację kinazy białkowej i stosunkiem aktywności domeny kinazy/fosfatazy. Podczas gdy wiele typów izozymów może składać się z tkanki, izozymy są identyfikowane na podstawie ich pierwotnej ekspresji w tkance i tkanki odkrytej poniżej.
PFKB1: Wątroba, mięśnie i płód
| 6-fosfofrukto-2-kinaza: PFKB1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Struktura krystaliczna ludzkiej wątroby 6-fosfofrukto-2-kinaza/fruktozo-2,6-bisfosfataza
| |||||||||
| Identyfikatory | |||||||||
| nr WE | 2.7.1.105 | ||||||||
| nr CAS | 78689-77-7 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Zlokalizowany na chromosomie X gen ten jest najbardziej znanym z czterech genów, szczególnie dlatego, że koduje wysoce zbadany enzym wątrobowy. Zmienny splicing mRNA PFKB1 daje trzy różne promotory (L, M i F), a zatem trzy warianty specyficzne dla tkanki, które różnią się regulacją:
- Typ L: tkanka wątroby
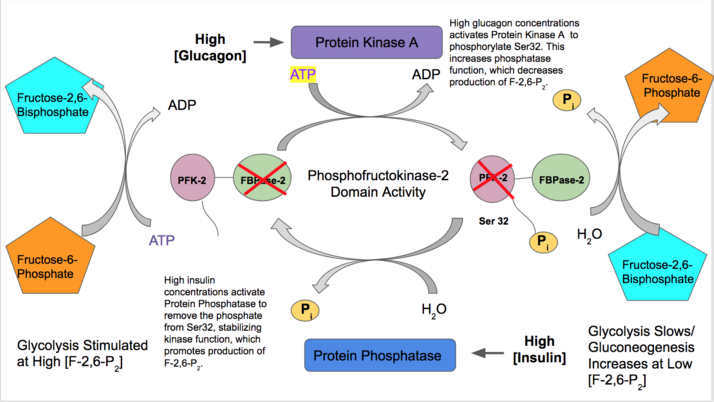
- Insulina aktywuje funkcję PFK-2 w wątrobie, aby wskazać, że duża ilość glukozy we krwi jest dostępna do glikolizy. Insulina aktywuje fosfatazę białkową , która defosforyluje kompleks PFK-2 i powoduje uprzywilejowaną aktywność PFK-2. PFK-2 następnie zwiększa produkcję F-2,6-P 2. Ponieważ ten produkt allosterycznie aktywuje PFK-1, aktywuje glikolizę i hamuje glukoneogenezę.
- Natomiast glukagon zwiększa aktywność FBPazy-2. Przy niskim stężeniu glukozy we krwi glukagon wyzwala kaskadę sygnału cAMP , a z kolei kinaza białkowa A (PKA) fosforyluje serynę 32 w pobliżu N-końca. To dezaktywuje zdolność bifunkcyjnego enzymu do działania jako kinaza i stabilizuje aktywność fosfatazy. Dlatego glukagon zmniejsza stężenie F-2,6-P 2, spowalnia tempo glikolizy i stymuluje szlak glukoneogenezy.
- Typ M: tkanka mięśni szkieletowych; Typ F: fibroblasty i tkanka płodowa
- W przeciwieństwie do większości innych tkanek PFK-2, PFK-2 zarówno w mięśniach szkieletowych, jak iw tkance płodowej jest regulowany wyłącznie przez stężenie fruktozo-6-fosforanu. W ich pierwszym eksonie nie ma miejsc regulatorowych, które wymagałyby fosforylacji / defosforylacji, aby wywołać zmianę funkcji. Wysokie stężenia F-6-P aktywują funkcję kinazy i zwiększają szybkość glikolizy, podczas gdy niskie stężenia F-6-P stabilizują działanie fosfatazy.
 dimer 6-fosfofrukto-2-kinazy
| |||||||||
| PFKB2 , | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identyfikatory ludzkiej tkanki serca | |||||||||
| nr WE | 2.7.1.105 | ||||||||
| nr CAS | 78689-77-7 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRYM | profil | ||||||||
| Struktury PDB | RCSB PDB PDBe PDB suma | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
PFKB2: serce (typ H)
Gen PFKB2 znajduje się na chromosomie 1. Kiedy krążą większe stężenia adrenaliny i/lub hormonu insuliny, aktywowany jest szlak kinazy białkowej A, który fosforyluje serynę 466 lub serynę 483 na C-końcu. Alternatywnie, kinaza białkowa B może również fosforylować te miejsca regulatorowe, które są częścią domeny FBPazy-2. Kiedy ta reszta seryny jest fosforylowana, funkcja FBPazy-2 jest inaktywowana i większa aktywność PFK-2 jest stabilizowana.
PFKB3: mózg, łożysko i indukcja
PFKB3 znajduje się na chromosomie 10 i transkrybuje dwie główne izoformy, typ indukowalny i typ wszechobecny. Formy te różnią się alternatywnym splicingiem eksonu 15 na ich C-końcu. Jednak są one podobne pod tym względem, że w obu przypadkach glukagon aktywuje cykliczny szlak AMP; powoduje to, że Kinaza Białkowa A, Kinaza Białkowa C lub Kinaza Białkowa aktywowana AMP fosforyluje resztę regulatorową na Serynie 461 na C-końcu w celu ustabilizowania funkcji kinazy PFK-2. Ponadto, obie izoformy transkrybowane z tego genu charakteryzują się szczególnie wysoką, dominującą szybkością aktywności kinazy, na co wskazuje stosunek aktywności kinazy do fosfatazy wynoszący 700 (podczas gdy izoenzymy wątroby, serca i jądra mają odpowiednio stosunki PFK-2/FBPaza-2 wynoszące 1,5, 80 i 4). Dlatego w szczególności PFKB3 stale wytwarza duże ilości F-2,6-P 2 i utrzymuje wysokie tempo glikolizy.
- I-Type: Inducible
- Nazwa tej izoformy jest wynikiem jej zwiększonej ekspresji w odpowiedzi na stres niedotlenienia; jego powstawanie jest indukowane brakiem tlenu. Ten typ ulega silnej ekspresji w szybko proliferujących komórkach, zwłaszcza komórkach nowotworowych.
- Typ U: wszechobecny; znany również jako łożysko lub mózg
- Chociaż odkryto je oddzielnie w tkankach łożyska, β-wysp trzustkowych lub mózgu, różne izoformy wydają się identyczne. Wszystkie tkanki, w których został odkryty, wymagają dużej energii do funkcjonowania, co może tłumaczyć przewagę PFKB3 w postaci tak wysokiego stosunku aktywności kinazy do fosfatazy.
- W szczególności izoforma mózgu ma długie regiony N- i C-końcowe, tak że ten typ jest prawie dwa razy większy niż typowy PFK-2, przy około 110 kDa.
PFKB4: jądro (typ T)
Gen PFKB4, zlokalizowany na chromosomie 3, wyraża PFK-2 w tkance ludzkiego jądra. Enzymy PFK-2 kodowane przez PFK-4 są porównywalne z enzymami wątrobowymi pod względem wielkości około 54 kDa i podobnie jak tkanka mięśniowa nie zawierają miejsca fosforylacji kinazy białkowej. Chociaż mniej badań wyjaśniło mechanizmy regulacyjne dla tej izoformy, badania potwierdziły, że modyfikacja z wielu czynników transkrypcyjnych w regionie flankującym 5' reguluje ilość ekspresji PFK-2 w rozwijającej się tkance jądra. Szczególnie uważa się, że ta izoforma jest modyfikowana i ulega nadmiernej ekspresji w celu przeżycia komórek raka prostaty.
Znaczenie kliniczne
Ponieważ ta rodzina enzymów utrzymuje tempo glikolizy i glukoneogenezy, wykazuje ogromny potencjał działania terapeutycznego w kontroli metabolizmu, szczególnie w cukrzycy i komórkach nowotworowych. Dane pokazują również, że wszystkie geny PFK-2 (chociaż odpowiedź genu PFKB3 pozostaje najbardziej drastyczna) zostały aktywowane przez ograniczenia tlenu. Stwierdzono, że kontrola aktywności PFK-2/FBP-azy2 jest powiązana z funkcjonowaniem serca, szczególnie w przypadku niedokrwienia , a kontrola przed niedotlenieniem . Badacze wysuwają hipotezę, że ta reagująca cecha genów PFK-2 może być silną, ewolucyjną adaptacją fizjologiczną. Jednak wiele typów ludzkich komórek nowotworowych (w tym rak białaczki, płuca, piersi, okrężnicy, trzustki i jajnika) wykazuje nadekspresję PFK3 i/lub PFK4; ta zmiana metabolizmu prawdopodobnie odgrywa rolę w efekcie Warburga .
Wreszcie, gen Pfkfb2 kodujący białko PFK2/FBPase2 jest powiązany z predyspozycją do schizofrenii .
- Van Schaftingen E, Hers HG (1981). „Fosforuktokinaza 2: enzym, który tworzy fruktozo-2,6-bisfosforan z fruktozo-6-fosforanu i ATP”. Biochem. Biofiza. Rez. Komuna . 101 (3): 1078–84. doi : 10.1016/0006-291X(81)91859-3 . PMID 6458291 .
Linki zewnętrzne
- Fruktoza + 2,6-bisfosfataza w US National Library of Medicine Medical Subject Headings (MeSH)
- 6-fosfofruktokinaza Arabidopsis thaliana w genome.jp
Ten artykuł zawiera tekst z domeny publicznej Pfam i InterPro IPR013079